
- •Альдегиды
- •Фармакологические свойства
- •Химические свойства
- •I. Реакции окисления.
- •II. Реакции нуклеофильного присоединения.
- •Получение
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Хлоралгидрат
- •Получение
- •Описание
- •Растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Хранение
- •Применение
- •Углеводы: моносахариды и полисахариды. Общие понятия о группе.
- •Анализ химической структуры моносахаридов.
- •Изомерия моносахаридов.
- •Характеристика химической активности углеводов.
- •Превращения под действием кислот и щелочей.
- •Глюкоза (декстроза) Glucosum
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение По фс сахара в порошке количественно не определяют
- •Хранение
- •Применение
- •Особенности приготовления и контроля качества в условиях аптек
- •Характеристика химической активности
- •Применение
- •Сахароза Sacharum (мнн)
- •Описание
- •Химические свойства.
- •Подлинность
- •Описание
- •Подлинность
- •Применение
Органические ЛС
Мы изучаем ЛС, поделенные на группы в соответствии с химической классификацией. Достоинством этой классификации является возможность выявления и исследования общих закономерностей при разработке методов получения препаратов, составляющих группу, методов фармацевтического анализа, основанных на физических и химических свойствах веществ, установления связи между химической структурой и фармакологическим действием.
Все ЛВ делятся на неорганические и органические. Неорганические, в свою очередь, классифицируются в соответствии с положением элементов в ПС. А органические – делятся на производные алифатического, алициклического, ароматического и гетероциклического ряда, каждый из которых подразделяется по классам: углеводороды, галогенпроизводные углеводородов, спирты, альдегиды, кетоны, кислоты, эфиры простые и сложные и т.д.
АЛИФАТИЧЕСКИЕ СОЕДИНЕНИЯ, КАК ЛС.
Препараты альдегидов и их производных. Углеводы
Альдегиды
К этой группе соединений относятся органические лекарственные вещества, содержащие альдегидную группу, или их функциональные производные.
Общая формула:
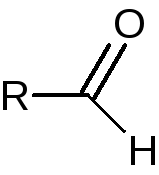
Фармакологические свойства
Введение альдегидной группы в структуру органического соединения сообщает ему наркотическое и антисептическое действие. В этом действие альдегидов сходно с действием спиртов. Но в отличие от спиртовой, альдегидная группа усиливает токсичность соединения.
Факторы влияния строения на фармакологическое действие:
удлинение алкильного радикала повышает активность, но одновременно растет токсичность;
такой же эффект имеет введение непредельной связи и галогенов;
к снижению токсичности приводит образование гидратной формы альдегида. Но способность к образованию устойчивой гидратной формы проявляется только у хлорпроизводных альдегидов. Так, формальдегид является протоплазматическим ядом, используется для дезинфекции, уксусный альдегид и хлораль не применяются в медицине из-за высокой токсичности, а хлоралгидрат – ЛС, применяется как снотворное, успокоительное.
Сила наркотического (фармакологического) действия и токсичность росли от формальдегида к ацетальдегиду и хлоралю. Образование гидратной формы (хлоралгидрат) позволяет резко снизить токсичность, сохранив фармакологический эффект.
По физическому состоянию альдегиды могут быть газообразными (низкомолекулярные), жидкостями и твердыми веществами. Низкомолекулярные имеют резкий неприятный запах, высокомолекулярные – приятный цветочный.
Химические свойства
В химическом отношении это высоко реакционноспособные вещества, что обусловлено наличием в их молекуле карбонильной группы.
Высокая реакционная способность альдегидов объясняется:
а) наличием поляризованной двойной связи
б) дипольным моментом карбонила
в) наличием частичного положительного заряда на атоме углерода карбонила
σ-


 O
O
 R - C
R - C
σ+H
Двойная связь между С и О, в отличие от двойной связи между двумя углеродами, сильно поляризована, так как кислород обладает значительно большей электроотрицательностью, чем углерод, и электронная плотность π-связи смещается к кислороду. Такая высокая поляризация определяет электрофильные свойства углерода карбонильной группы и его способность реагировать с нуклеофильными соединениями (вступать в реакции нуклеофильного присоединения). Кислород группы обладает нуклеофильными свойствами.
Характерны реакции окисления и нуклеофильного присоединения
I. Реакции окисления.
Альдегиды легко окисляются. Окисление альдегидов до кислот происходит под влиянием как сильных, так и слабых окислителей.
Многие металлы – серебро, ртуть, висмут, медь, восстанавливаются из растворов их солей, особенно в присутствии щелочи. Это отличает альдегиды от других органических соединений, способных к окислению – спиртов, непредельных соединений, для окисления которых необходимы более сильные окислители. Следовательно, реакции окисления альдегидов комплексно связанными катионами ртути, меди, серебра в щелочной среде можно применять для доказательства подлинности альдегидов.
I. 1.Реакция с аммиачным раствором нитрата серебра (реакция серебряного зеркала) рекомендуется ФС для подтверждения подлинности веществ с альдегидной группой. В основе окисление альдегида до кислоты и восстановление Ag+ до Ag↓.
AgNO3 + 2NH4OH → [Ag(NH3)2]NO3 +2H2O
НСОН + 2[Ag(NH3)2]NO3 + H2O → HCOONH4 + 2Ag↓+ 2NH4NO3+ NH3↑
Формальдегид, окисляясь до аммонийной соли муравьиной кислоты, восстанавливает до металлического серебро, которое осаждается на стенках пробирки в виде блестящего налета «зеркала» или серого осадка.
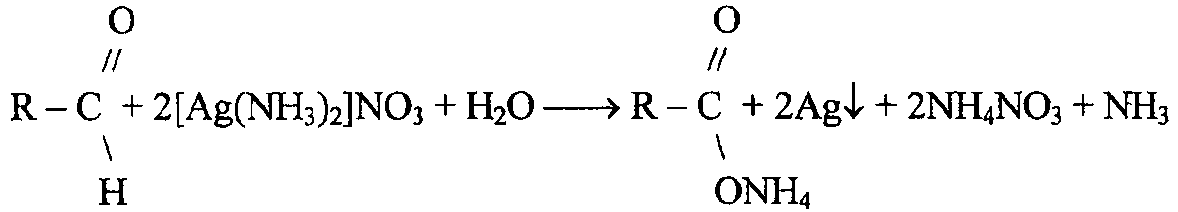
I. 2. Реакция с реактивом Фелинга (комплексное соединение меди (II) с калий-натриевой солью винной кислоты). Альдегиды восстанавливают соединение меди (II) до оксида меди (I), образуется кирпично-красный осадок. Готовят перед употреблением).
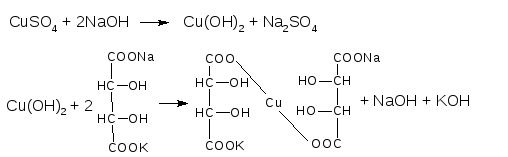
реактив Феллинга 1 - раствор CuSO4
реактив Феллинга 2 – щелочной раствор калий-натриевой соли винной кислоты
При смешавании 1:1 реактивов Феллинга 1 и 2 образуется синее комплексное соединение меди (II) с калий-натриевой солью винной кислоты:
синее окрашивание
При добавлении альдегида и нагревании синее окрашивание реактива исчезает, образуется промежуточный продукт - желтый осадок гидроксида меди (I), сразу разлагающийся на красный осадок оксида меди (I) и воду.
2KNa[Cu(C4H4O6)2] +R-COH+2NaOH+ 2KOH→R-COONa+4KNaC4H4O6+2CuOH↓+H2O
желтый
2CuOH↓ → Cu2O↓ + H2O
Желтый осадок кирпично-красный осадок
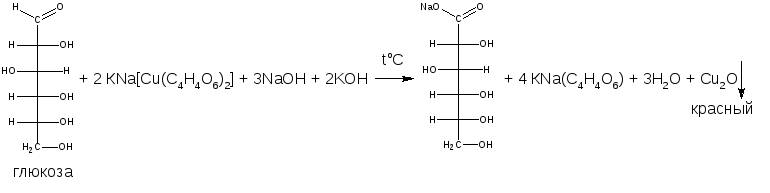
В учебниках иная общая схема реакции
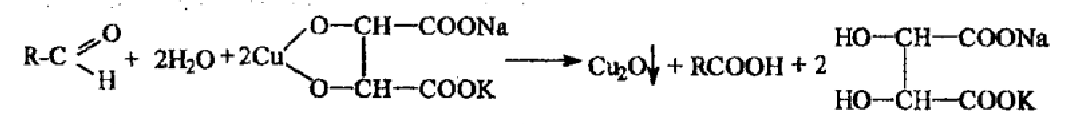
I. 3. Реакция с реактивом Несслера (щелочной раствор тетрайодмеркурат (II) калия). Формальдегид восстанавливает ион ртути до металлической ртути – осадок темно-серого цвета.
R-COH + K2[HgI4] +3KOH → R-COOK + 4KI + Hg↓ + 2H2O
черный
