
- •Государственное бюджетное образовательное учреждение
- •Предисловие
- •Тематические разделы дисциплины «Химия»
- •1. 1. Растворы. Способы выражения концентрации растворов
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.2. Введение в титриметрический анализ. Метод нейтрализации
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.3. Оксидиметрия. Перманганатометрия.
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.4. Элементы химической термодинамики
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.5. Энергетика химических процессов
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.6. Коллигативные свойства растворов. Осмос.
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.7. Водородный показатель среды растворов – pH.
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.8. Буферные системы
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.9. Электрохимия. Потенциометрия.
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.10. Окислительно-восстановительные потенциалы и электроды
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература
- •1.11. Комплексные соединения
- •Контрольные вопрросы
- •Типовые задачи
- •Тестовые задания
- •Контрольные задания
- •Литература
- •1.12. Поверхностные явления. Способы получения и свойства коллоидных растворов.
- •Контрольные вопросы
- •Тестовые задания
- •Контрольные задания
- •Литература
- •1.13. Свойства растворов высокомолекулярных веществ (вмв)
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания
- •Контрольные задания
- •Литература
- •1.14. Биогенные элементы
- •Контрольные вопросы
- •Типовые задачи
- •Тестовые задания
- •Темы рефератов
- •Литература
- •2. Инструкция по охране труда и пожарной безопасности для студентов при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •2.5. Требования безопасности по окончании работы
- •3. Кодификатор зачетной работы дисциплины «Химия» для студентов I курса специальностей
- •060101- Лечебное дело; 060103-педиатрия
- •Характеристика зачетной работы и инструкция по ее выполнению
- •Часть 2
- •Часть 3
- •Заключение
- •Глоссарий
- •Ответы на тестовые задания
- •Приложения
- •1. Основные физико-химические константы
- •2. Важнейшие единицы си и их соотношение с единицами других систем
- •3. Приставки для дольных и кратных единиц си
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 66 – 76, 101 – 107.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М. : Высш. шк., 2008. – С.45-50.
1.8. Буферные системы
Свойством всех живых организмов является постоянство рН биологических жидкостей, тканей и органов. Это постоянство поддерживается их буферными системами и необходимо для обеспечения нормальной деятельности ферментов, регулирования осмотического давления и других показателей.
Знания по теме «Буферные «системы» необходимы для понимания механизма их действия, количественной оценки способности буферных систем связывать посторонние кислоты и щелочи, понимания их взаимосвязи и роли в поддержании кислотно-основного гомеостаза.
Кроме того, важно уметь готовить буферные растворы для последующего использования их в различных медико-биологических, химических и клинических исследованиях.
Буферными называют системы, состоящие из двух сопряженных компонентов, способных до определенного предела противодействовать изменению рН среды при добавлении к ним небольших количеств кислоты и щелочи, а также при разбавлении раствора или концентрировании.
Способность буферных систем сохранять постоянство pH называется буферным действием.
По составу, с точки зрения протонной теории, буферные системы делят на кислые и основные.
Кислые буферные системы состоят из слабой кислоты и сопряженного с ней избытка сильного основания, создаваемого солью этой кислоты.
Например: Ацетатная буферная система – кислая буферная система, состоит из:
 СН3СООН
– слабая кислота;
СН3СООН
– слабая кислота;
СН3СООNa – растворимая соль (содержит сопряженное сильное основание СН3СОО- ).
Аммиачная буферная система – основная буферная система, состоит из:
N Н4ОН
– слабое основание;
Н4ОН
– слабое основание;
NН4Сl –растворимая соль (содержит сопряженную сильную кислоту NН4+).
Буферные системы в растворенном состоянии образуют буферные растворы.
Буферные растворы, в отличие от буферных систем, могут быть многокомпонентными.
Кровь относят к буферным растворам.
Водородный показатель среды буферного раствора рассчитывают по уравнению Гендерсона-Гассельбаха:
pH = pKa + lg[соль]/[кислота]
pH - водородный показатель среды буферного раствора,
pKa – показатель константы кислотности слабой кислоты,
[соль]/[кислота]– количества соли и кислоты в момент равновесия; буферное соотношение.
В
рабочем виде: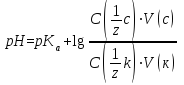
- C (1/z с), C (1/z к) – исходные молярные концентрации эквивалентов соли и кислоты, моль·дм-3;
- V (с), V (к) – объемы растворов соли и кислоты соответственно, см3.
Величину, характеризующую способность буферной системы противодействовать смещению реакции среды при добавлении кислот и щелочей, называют буферной емкостью (B). Буферную ёмкость можно определить по кислоте или по основанию.
Буферная ёмкость показывает сколько моль-эквивалентов сильной кислоты или щелочи следует добавить к 1 дм3 буферного раствора, чтобы изменить его рН на единицу.
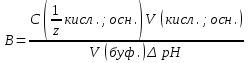
B – буферная ёмкость, моль дм-3;
C(1/z кисл.; осн.) – молярная концентрация эквивалента добавляемой кислоты или основания;
V(кисл.; осн.) – объем раствора добавляемой кислоты или основания, см3;
∆pH – изменение pH;
V (буф.)- объем буферного раствора, см3.
Для сохранения оптимальных условий обменных процессов необходимо постоянство pH внутренних сред организма. Постоянство кислотности сред, наряду с физиологическими механизмами поддерживается буферными системами организма.
