
- •Белорусский государственный медицинский университет
- •Биологическая химия
- •Содержание
- •Предисловие
- •Структура и функции белков и пептидов. Сложные белки
- •Классификация белков
- •I. Функциональная (по функции, выполняемой в организме)
- •II. По форме молекулы
- •Свойства аминокислот
- •Уровни структурной организации белковых молекул
- •Сложные белки
- •Методы исследования структуры белков и пептидов
- •Этапы исследования первичной структуры белков и пептидов
- •Методы разделения белков Отделение белков от низкомолекулярных примесей
- •Разделение белков по молекулярной массе
- •Выделение индивидуальных белков
- •Анализ гомологичных белков
- •Установление ак-последовательности белка
- •I. Определение n-концевой ак
- •II. Определение с-концевой ак
- •III. Определение ак-последовательности
- •Белки соединительных тканей (Молекулы внеклеточного матрикса)
- •Фибриллярные структурные белки
- •Фибриллярные адгезивные белки
- •Введение в энзимологию. Свойства ферментов
- •Классификация и номенклатура ферментов
- •Строение фермента
- •Единицы измерения активности
- •Влияние температуры
- •Влияние рН
- •Влияние концентрации субстрата
- •Регуляция активности ферментов Принципы регуляции химических процессов в клетке
- •Влияние ингибиторов
- •Ковалентная модификация структуры фермента
- •Примеры использования ингибиторов в медицинской практике
- •Множественные формы ферментов
- •Медицинские аспекты энзимологии
- •Причины гиперферментемий
- •Применение ферментов в медицине
- •2 Стороны метаболизма
- •Общая схема катаболизма пищевых веществ атф и адениловая система клетки
- •Окислительное декарбоксилирование пирувата
- •Последовательность реакций, катализируемых пируватдегидрогеназным комплексом
- •Регуляция пируватдегидрогеназного комплекса
- •Лимоннокислый цикл Кребса, цикл трикарбоновых кислот (цтк)
- •Функции цикла Кребса
- •Регуляция цтк
- •Тканевое дыхание, окислительное фосфорилирование
- •Комплексы дыхательной цепи
- •Пути утилизации кислорода клеткой
- •Переваривание, всасывание, поступление в клетку углеводов. Метаболизм гликогена
- •Переваривание углеводов
- •Всасывание углеводов
- •Транспорт глюкозы в клетки
- •Превращение глюкозы в клетках
- •Метаболизм гликогена
- •Синтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •Гликолиз. Аэробное окисление глюкозы. Глюконеогенез гликолиз
- •Патогенетическая взаимосвязь углеводов пищи и кариеса
- •Аэробное окисление глюкозы
- •Глюконеогенез
- •Пентозофосфатный путь. ГлюкуроновЫй путь пентозофосфатный путь
- •ГлюкуроновЫй путь
- •Переваривание липидов в желудочно-кишечном тракте, система их доставки в клетки Классификация липидов по химическому строению
- •Переваривание и всасывание
- •Ресинтез липидов в клетках слизистой тонкого кишечника:
- •Депонирование и мобилизация липидов из жировых депо, внутриклеточный обмен жирных кислот
- •Внутриклеточный метаболизм жирных кислот
- •Окисление жирных кислот в пероксисомах
- •Синтез жирных кислот
- •Происхождение ненасыщенных жирных кислот в клетках
- •Синтез и нарушения обмена холестерола, метаболизм кетоновых тел
- •Синтез холестерола de novo
- •Регуляция синтеза холестерола
- •Роль нарушений обмена холестерола в развитии атеросклероза
- •Факторы, влияющие на уровень лпнп у человека
- •Факторы, связанные с низким или высоким уровнем хс лпвп
- •Образование и утилизация кетоновых тел
- •Система свёртывания крови
- •Свёртывающая (гемокоагуляционная) система крови
- •Антикоагулянтная система
- •Фибринолитическая система
- •Оценка состояния обмена белков, протеолиз азотистый баланс
- •Протеолиз, свойства протеаз. Ограниченный и тотальный протеолиз
- •Переваривание белков в желудочно-кишечном тракте
- •Транспорт аминокислот в клетки
- •Внутриклеточный обмен аминокислот общие пути катаболизма аминокислот Реакции переаминирования
- •Реакции дезаминирования
- •Пути обезвреживания аммиака в организме — синтез глутамина и мочевины.
- •Химия нуклеопротеинов Нуклеиновые кислоты— биополимеры, мономерами которых являются нуклеотиды.
- •Строение рнк
- •Биосинтез нуклеотидов
- •Фосфорибозиламин
- •Инозинмонофосфат
- •ДТмф дУмф умф
- •Образование дезоксирибонуклеотидов
- •Биосинтез днк
- •Биосинтез рнк
- •Структура рнк-полимеразы прокариот
- •R Аминоацил-тРнк
- •Гормоны. Общий механизм действия гормонов
- •Механизм действия гормонов, взаимодействующих
- •Механизм действия гормонов, взаимодействующих с 1-тмс-рецепторами
- •Механизм действия гормонов, взаимодействующих с внутриклеточными (r)
- •Гормоны — производные белков, пептидов и аминокислот гормоны гипоталамуса
- •Гормоны аденогипофиза Это гормоны белково-пептидной природы.
- •Гормоны задней доли гипофиза
- •Гормоны поджелудочной железы
- •2. Окисление и изомеризация прегненолона в прогестерон. Прегненолон является предшественником всех стероидных гормонов.
- •Половые гормоны
- •Биохимия питания. Макро- и микроэлементы
- •Макроэлементы
- •Концентрация электролитов вне и внутри клетки существенно различается: натрий и кальций преобладают во внеклеточном пространстве, калий и магний — внутри клетки. Кальций
- •Кальцитонин
- •Паратирин (паратгормон)
- •Витамин д (кальциферол), антирахитический
- •Микроэлементы Железо
- •Биохимия питания. Витамины и другие незаменимые факторы питания. Синдром недостаточного питания
- •Витамины
- •Биохимия соединительных тканей и органов полости рта (костная, хрящевая ткани; зубы)
- •Неколлагеновые белки костной ткани и их роль в процессах минерализации
- •Химический состав тканей зуба и кости (весовые %)
- •Биохимия ротовой жидкости
- •Химический состав ротовой жидкости
- •Функции ротовой жидкости
- •1. Защитная.
- •3. Очищающая.
- •Ферменты ротовой жидкости и их роль
- •Поверхностные образования на эмали
- •Фтор (f) и его роль в организме
- •Биохимия печени
- •Функции печени
- •Миофибриллярные (сократительные) белки
- •Молекулярный механизм мышечного сокращения
- •Источники энергии мышечного сокращения
- •Механизмы энергообеспечения мышечного сокращения
Фтор (f) и его роль в организме
1. 99 % F в виде фторапатита входит в состав костей и зубов, придает им прочность и кислотоустойчивость.
2. Стимулирует реминерализацию костей и зубов (поступление в них кальция и фосфора).
3. Стимулирует синтез костной ткани, иммунитет (в том числе полости рта), гемопоэз.
4. Блокирует енолазу микроорганизмов (прекращается синтез лактата, который снижает рН ротовой жидкости) и синтез микроорганизмами внеклеточных полисахаридов.
5. Изменяет электрический потенциал поверхности эмали и препятствует адгезии бактерий к эмали.
Концентрация F выражается в мг/л и ppm (parts per million): 1 мг/л = 1 ppm; 1 % = 10000 ppm.
Рекомендации Всемирной организации здравоохранения (ВОЗ), 1994 г.:
за оптимум принято количество F, приближающееся к 4 мг/сут (1,5–4 мг/сут);
1,2 мг F — из воды (30 %); 2,0 мг — из пищи (50 %); 0,8 мг — из воздуха (20 %);
в жарких странах F в воде должно быть 0,5–0,8 мг/л, с умеренным климатом — 0,8–1,0 мг/л, в северных — 1,0–1,2 мг/л.
Больше всего F в морепродуктах, зеленом и черном чае, красном вине. Много F в районах комбинатов по выпуску фосфорных удобрений, сжигания каменного угля.
В Республике Беларусь F в воде 0,2 ppm (мг/л), в употребляемых продуктах — 0,6 ppm, из воздуха — 0,5 мг. В среднем мы получаем 0,6 мг + 0,8 мг + 0,5 мг = 1,9 мг F.
F-профилактика
|
Системная (эндогенная) |
Местная (экзогенная) |
|
Фторирование питьевой воды, поваренной соли, молока, таблетки «Витафтор» |
Фторсодержащие пасты, растворы, гели, лаки, герметики фиссур |
В зубной пасте для взрослых F должно быть 1500 ppm , для детей — 500 ppm.
При недостатке F — кариес, при избытке — флюороз: «крапчатая», «пятнистая» эмаль зубов; минерализация хрящей и связок, остеосклероз скелета; раннее старение; снижение иммунитета и гормональной активности.
Биохимия печени
Печень играет центральную роль в обмене веществ. Масса печени у взрослого человека составляет ≈ 1,5 кг, при этом на долю воды приходится 70–75 % . Из сухого остатка более 50 % составляют белки. 90 % этих белков — глобулины. В печени много ферментов, липидов, гликогена.
Функции печени
1. Гомеостатическая. Поддерживает постоянный состав крови (гомеостаз). Питательные вещества в желудочно-кишечном тракте всасываются периодически. Их концентрации в портальном кровотоке в разные периоды времени существенно различаются, но благодаря гомеостатической функции печени концентрации важнейших метаболитов в большом круге кровообращения практически постоянны.
2. Роль печени в обмене белков.Освобождающиеся в процессе пищеварения аминокислоты попадают с током крови в печень и используются для:
синтеза белков плазмы крови (альбуминов, глобулинов, факторов свёртывания крови);
образования α-кетокислот путём трансаминирования или окислительного дезаминирования аминокислот;
глюконеогенеза;
синтеза кетоновых тел;
получения энергии, подвергаясь превращениям в цикле трикарбоновых кислот;
синтеза мочевины;
синтеза креатина, холина.
3. Роль в обмене липидов.Печень играет ключевую роль в метаболизме липидов:
в ней синтезируются, распадаются, удлиняются и укорачиваются жирные кислоты, поступающие с пищей или образующиеся при распаде простых и сложных липидов;
распадаются и синтезируются триацилглицеролы;
синтезируется большинство липопротеинов и 90 % из общего количества холестерола в организме;
в печени из холестерола синтезируются желчные кислоты, которые входят в состав желчи, необходимой для переваривания липидов в кишечнике;
печень — единственный орган, в котором синтезируются кетоновые тела;
в печени синтезируются витамин А и 25-гидроксихолекальциферол (предшественник витамина D3), запасается (!) витамин В12.
4. Роль печени в обмене углеводов.Основная роль печени в метаболизме углеводов — это поддержание нормальной концентрации глюкозы в крови благодаря тому, что в печени имеются:
ферменты синтеза и распада гликогена;
ферменты глюконеогенеза;
ферменты, превращающие другие гексозы (галактозу и фруктозу) в глюкозу.
5. Антитоксическая функция. Поступающие в организм ксенобиотики (чужеродные вещества) и образующиеся в самом организме токсичные или непригодные для дальнейших превращений продукты метаболизма обезвреживаются в печени следующими способами:
метилированием (никотиновая кислота);
ацетилированием (сульфаниламидные препараты);
окислением (алкоголь, ароматические углеводороды, катехоламины, биогенные амины);
восстановлением (нитробензол);
путём синтеза мочевины (аммиак);
конъюгацией, т. е. связыванием с сильно полярными, отрицательно заряженными молекулами — активными формами глюкуроновой или серной кислот — УДФ-глюкуроновой кислотой и ФАФС (фосфоаденозинфосфосульфатом). Так метаболизируются стероидные гормоны, билирубин, продукты гниения белков в кишечнике, фенолы, желчные кислоты;
с помощью микросомной системы монооксигеназ (лекарственные препараты и канцерогены) и редуктаз (кетоны, альдегиды, красители);
с помощью ферментов пероксисомного окисления — оксидаз и каталаз (мочевая кислота, аминокислоты, лактат, пероксид водорода).
6. Роль печени в обмене желчных пигментов. Эритроциты живут приблизительно 120 дней, а затем разрушаются, главным образом, в печени, селезёнке и костном мозге, при этом разрушается и гемоглобин. Распад гемоглобина протекает в клетках макрофагов, в частности, в звёздчатых ретикулоэндотелиоцитах, а также в гистиоцитах соединительной ткани любого органа по следующей схеме:
 НАДФН∙Н+; О2глобин НАДФН∙Н+
НАДФН∙Н+; О2глобин НАДФН∙Н+
гемоглобинвердоглобинбиливердинбилирубин
вит. С; цит. Р450; Fe биливердинредуктаза
гемоксигеназа
 Метаболизм
желчных пигментов:
Метаболизм
желчных пигментов:
Образующийся при распаде гемоглобина билирубин поступает в кровь и связывается альбуминами плазмы — это непрямой билирубин. В отличие отпрямогобилирубина,непрямойне даёт цветную реакцию сдиазореактивом Эрлиха, пока белки плазмы крови не осаждены спиртом.Непрямойбилирубин называется такжесвободным, поскольку его связь с альбуминами плазмы не химическая (не ковалентная), а адсорбционная. Попадая впечень, билирубин ковалентно связывается с 2 молекуламиУДФ-глюкуроновой кислоты, образуядиглюкуронид билирубина, который называетсясвязанным билирубином. Связанный билирубин называется такжепрямым, поскольку он легко даёт цветную реакцию с диазореактивом Эрлиха. Прямой и небольшая часть непрямого билирубина вместес желчью поступают в тонкий кишечник, где от прямого билирубина отщепляется УДФ-глюкуроновая кислота и при этом образуетсямезобилирубин. Последний в конечных отделах тонкого кишечника под воздействием микроорганизмов восстанавливается вуробилиноген, часть которого всасывается по мезентериальным сосудам и поступает в печень(истинный уробилин), где разрушается до пиррольных соединений.
Большая часть уробилиногена поступает втолстый кишечник. Уробилиноген в толстом кишечнике восстанавливается встеркобилиноген. 80 % стеркобилиногена выделяется с калом и под влиянием кислорода воздуха окисляется встеркобилин, придающий характерную окраску стулу.Меньшаячасть стеркобилиногена всасывается по нижней и средней геморроидальным венам и попадает вбольшой круг кровообращения, поступает впочки, которыми и выделяется. Под влиянием кислорода воздуха стеркобилиноген мочи также окисляется до стеркобилина. Нередкостеркобилин мочи называютуробилином (stercorous — каловый,urinary — мочевой), однако это не истинный уробилин.В норме в моче истинный уробилин отсутствует.
Норма общего билирубина в крови — 8,55–20,52 мкмоль/л, из них более 80 % приходится на долю свободного билирубина. При повышении концентрации общего билирубина в крови более 25 мкмоль/л у человека желтеют кожные покровы, слизистые оболочки и склеры. Такое состояние называется«желтуха» (icterus)и требует врачебного вмешательства.
7. Синтез гемоглобина. Гемоглобин — сложный белок, состоящий из белка глобина и небелковой части — гема. Глобин синтезируется как обычный белок, а синтез гема представляет собой сложный многостадийный процесс, поэтому мы выделим в нём только основные этапы. Все клетки, имеющие ядро, могут синтезировать гем, но в количественном плане наиболее интенсивно синтез гема протекает в печени и костном мозге.
Этапы синтеза гема:
1
I .
Сукцинил ~
SКоА
+ глицин δ-аминолевулиновая кислота
(δ-АЛК)
.
Сукцинил ~
SКоА
+ глицин δ-аминолевулиновая кислота
(δ-АЛК)
КоА — SН + СО2
1 = δ-аминолевулинатсинтаза (δ-АЛС)
2
I I.
2 δ-АЛК порфобилиноген
( ПБГ)
I.
2 δ-АЛК порфобилиноген
( ПБГ)
2Н2О
2 = δ-аминолевулинатдегидратаза (δ-АЛД)
I II.
4 ПБГ протопорфирин IX
(ПП IX)
через ряд промежуточных стадий.
II.
4 ПБГ протопорфирин IX
(ПП IX)
через ряд промежуточных стадий.
3
I V.
ПП IX
+ Fe2
гем
V.
ПП IX
+ Fe2
гем
вит. В12; Cu2+
3 = гемсинтаза (феррохелатаза)
Регуляция синтеза гема. Фермент, лимитирующий скорость синтеза гема, — δ-АЛС. Она ингибируется гемом по принципу обратной связи, а активируется стероидными гормонами. Также ингибируется гемом δ-АЛД и гемсинтаза. Последняя к тому же очень чувствительна к свинцу, а δ-АЛД — вообще ко всем тяжёлым металлам.
Гем + белок → гемопротеины: гемоглобин, миглобин, цитохромы.
8. Экскреторная функция. Из печени различные вещества эндо- и экзогенного происхождения или поступают в желчные протоки и выводятся с желчью (более 40 соединений), или попадают в кровь, откуда выводятся почками.
БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
Мышцы составляют у взрослого человека 40 % от массы тела.
Функция мышц — напряжение и укорочение с последующим расслаблением.
Значение мышц — обеспечение подвижности организма и сопротивление механической силе, в том числе и статические нагрузки.
Механизм работы мышц — превращение химической энергии в механическую.
К мышечной ткани относятся:
скелетная мускулатура;
сердечная мышца;
гладкая мускулатура.
Скелетная и сердечная мышцы под микроскопом имеют поперечно-полосатое строение, а гладкая — нет. Мышечные клетки состоят из миофибрилл, а функциональной единицей миофибрилл является саркомер.
![]()
![]()
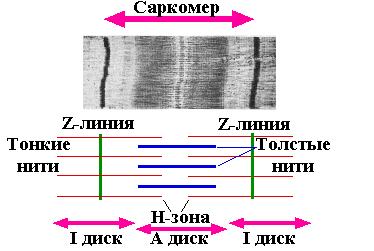
При рассмотрении
миофибриллы под электронным микроскопом
видны темные и светлые полосы или диски
(А и I
диски). Центральная зона А диска (H
зона) при этом кажется менее оптически
плотной, чем остальная его часть. I
участок (или I
диск) как бы делится на две части очень
плотной и узкой Z-линией.
Также видны два типа вытянутых нитей.
Один тип — это толстая
нить, соответствующая А диску. Второй
тип — тонкая
нить,
расположена в I![]() диске и проходит в А диск, не достигая
Н зоны.
диске и проходит в А диск, не достигая
Н зоны.
Около 25 % массы мышц составляют белки. Белки мышц делят на 3 группы:
миофибриллярные (сократительные) белки;
белки саркоплазмы;
белки стромы.
