
- •Белорусский государственный медицинский университет
- •Биологическая химия
- •Содержание
- •Предисловие
- •Структура и функции белков и пептидов. Сложные белки
- •Классификация белков
- •I. Функциональная (по функции, выполняемой в организме)
- •II. По форме молекулы
- •Свойства аминокислот
- •Уровни структурной организации белковых молекул
- •Сложные белки
- •Методы исследования структуры белков и пептидов
- •Этапы исследования первичной структуры белков и пептидов
- •Методы разделения белков Отделение белков от низкомолекулярных примесей
- •Разделение белков по молекулярной массе
- •Выделение индивидуальных белков
- •Анализ гомологичных белков
- •Установление ак-последовательности белка
- •I. Определение n-концевой ак
- •II. Определение с-концевой ак
- •III. Определение ак-последовательности
- •Белки соединительных тканей (Молекулы внеклеточного матрикса)
- •Фибриллярные структурные белки
- •Фибриллярные адгезивные белки
- •Введение в энзимологию. Свойства ферментов
- •Классификация и номенклатура ферментов
- •Строение фермента
- •Единицы измерения активности
- •Влияние температуры
- •Влияние рН
- •Влияние концентрации субстрата
- •Регуляция активности ферментов Принципы регуляции химических процессов в клетке
- •Влияние ингибиторов
- •Ковалентная модификация структуры фермента
- •Примеры использования ингибиторов в медицинской практике
- •Множественные формы ферментов
- •Медицинские аспекты энзимологии
- •Причины гиперферментемий
- •Применение ферментов в медицине
- •2 Стороны метаболизма
- •Общая схема катаболизма пищевых веществ атф и адениловая система клетки
- •Окислительное декарбоксилирование пирувата
- •Последовательность реакций, катализируемых пируватдегидрогеназным комплексом
- •Регуляция пируватдегидрогеназного комплекса
- •Лимоннокислый цикл Кребса, цикл трикарбоновых кислот (цтк)
- •Функции цикла Кребса
- •Регуляция цтк
- •Тканевое дыхание, окислительное фосфорилирование
- •Комплексы дыхательной цепи
- •Пути утилизации кислорода клеткой
- •Переваривание, всасывание, поступление в клетку углеводов. Метаболизм гликогена
- •Переваривание углеводов
- •Всасывание углеводов
- •Транспорт глюкозы в клетки
- •Превращение глюкозы в клетках
- •Метаболизм гликогена
- •Синтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •Гликолиз. Аэробное окисление глюкозы. Глюконеогенез гликолиз
- •Патогенетическая взаимосвязь углеводов пищи и кариеса
- •Аэробное окисление глюкозы
- •Глюконеогенез
- •Пентозофосфатный путь. ГлюкуроновЫй путь пентозофосфатный путь
- •ГлюкуроновЫй путь
- •Переваривание липидов в желудочно-кишечном тракте, система их доставки в клетки Классификация липидов по химическому строению
- •Переваривание и всасывание
- •Ресинтез липидов в клетках слизистой тонкого кишечника:
- •Депонирование и мобилизация липидов из жировых депо, внутриклеточный обмен жирных кислот
- •Внутриклеточный метаболизм жирных кислот
- •Окисление жирных кислот в пероксисомах
- •Синтез жирных кислот
- •Происхождение ненасыщенных жирных кислот в клетках
- •Синтез и нарушения обмена холестерола, метаболизм кетоновых тел
- •Синтез холестерола de novo
- •Регуляция синтеза холестерола
- •Роль нарушений обмена холестерола в развитии атеросклероза
- •Факторы, влияющие на уровень лпнп у человека
- •Факторы, связанные с низким или высоким уровнем хс лпвп
- •Образование и утилизация кетоновых тел
- •Система свёртывания крови
- •Свёртывающая (гемокоагуляционная) система крови
- •Антикоагулянтная система
- •Фибринолитическая система
- •Оценка состояния обмена белков, протеолиз азотистый баланс
- •Протеолиз, свойства протеаз. Ограниченный и тотальный протеолиз
- •Переваривание белков в желудочно-кишечном тракте
- •Транспорт аминокислот в клетки
- •Внутриклеточный обмен аминокислот общие пути катаболизма аминокислот Реакции переаминирования
- •Реакции дезаминирования
- •Пути обезвреживания аммиака в организме — синтез глутамина и мочевины.
- •Химия нуклеопротеинов Нуклеиновые кислоты— биополимеры, мономерами которых являются нуклеотиды.
- •Строение рнк
- •Биосинтез нуклеотидов
- •Фосфорибозиламин
- •Инозинмонофосфат
- •ДТмф дУмф умф
- •Образование дезоксирибонуклеотидов
- •Биосинтез днк
- •Биосинтез рнк
- •Структура рнк-полимеразы прокариот
- •R Аминоацил-тРнк
- •Гормоны. Общий механизм действия гормонов
- •Механизм действия гормонов, взаимодействующих
- •Механизм действия гормонов, взаимодействующих с 1-тмс-рецепторами
- •Механизм действия гормонов, взаимодействующих с внутриклеточными (r)
- •Гормоны — производные белков, пептидов и аминокислот гормоны гипоталамуса
- •Гормоны аденогипофиза Это гормоны белково-пептидной природы.
- •Гормоны задней доли гипофиза
- •Гормоны поджелудочной железы
- •2. Окисление и изомеризация прегненолона в прогестерон. Прегненолон является предшественником всех стероидных гормонов.
- •Половые гормоны
- •Биохимия питания. Макро- и микроэлементы
- •Макроэлементы
- •Концентрация электролитов вне и внутри клетки существенно различается: натрий и кальций преобладают во внеклеточном пространстве, калий и магний — внутри клетки. Кальций
- •Кальцитонин
- •Паратирин (паратгормон)
- •Витамин д (кальциферол), антирахитический
- •Микроэлементы Железо
- •Биохимия питания. Витамины и другие незаменимые факторы питания. Синдром недостаточного питания
- •Витамины
- •Биохимия соединительных тканей и органов полости рта (костная, хрящевая ткани; зубы)
- •Неколлагеновые белки костной ткани и их роль в процессах минерализации
- •Химический состав тканей зуба и кости (весовые %)
- •Биохимия ротовой жидкости
- •Химический состав ротовой жидкости
- •Функции ротовой жидкости
- •1. Защитная.
- •3. Очищающая.
- •Ферменты ротовой жидкости и их роль
- •Поверхностные образования на эмали
- •Фтор (f) и его роль в организме
- •Биохимия печени
- •Функции печени
- •Миофибриллярные (сократительные) белки
- •Молекулярный механизм мышечного сокращения
- •Источники энергии мышечного сокращения
- •Механизмы энергообеспечения мышечного сокращения
R Аминоацил-тРнк
Собственно трансляция проходит в три этапа: инициация, элонгация и терминация.
Инициация: иРНК поступает на ма-лую субъединицу рибосомы 5/-концом, к инициирующему кодону (АУГ) присоеди-няется первая аминоацил-тРНК (мет-тРНК), и комплекс «закрывается» большой субъединицей рибосомы. В образовании инициирующего комплекса участвуют белковые факторы инициации (IF-1, 2, 3) и используется энергия ГТФ.
 Элонгация:
в аминоацильный участок поступает
следующая аминоацил-тРНК. Фермент
пептидилтрансфераза образует пептидную
связь между активированной карбо-ксильной
группой первой аминокислоты и аминогруппой
второй аминокислоты. Образованный при
этом дипептид «зависает» в аминоацильном
центре. Затем с помощью транслоказы и
энергии ГТФ рибосома перемещается по
иРНК на один кодон, аминоацильный участок
освобождается, туда поступает новая
аминокислота.
Элонгация:
в аминоацильный участок поступает
следующая аминоацил-тРНК. Фермент
пептидилтрансфераза образует пептидную
связь между активированной карбо-ксильной
группой первой аминокислоты и аминогруппой
второй аминокислоты. Образованный при
этом дипептид «зависает» в аминоацильном
центре. Затем с помощью транслоказы и
энергии ГТФ рибосома перемещается по
иРНК на один кодон, аминоацильный участок
освобождается, туда поступает новая
аминокислота.
Терминация наступает тогда, когда в аминоацильном участке оказывается один из терминирующих (нонсенс) кодонов. К таким кодонам присоединяются специальные белки (рилизинг-факторы), которые высвобождают синтезированный пептид и вызывают диссоциацию субъединиц рибосомы.
Многие белки синтезируются в неактивном виде (в виде предшественников) и после схождения с рибосом подвергаются постсинтетической модификации. Виды модификации белков:
частичный протеолиз (удаление N-конце-вого мет и сигнального пептида, образование активных форм ферментов и гормонов);
объединение протомеров и формирование четвертичной структуры белков;
образование внутри- и межцепочечных S–S связей;
ковалентное присоединение кофакторов к ферментам (пиридоксальфосфат, биотин);
гликозилирование (гормоны, рецепторы);
модификация остатков аминокислот:
гидроксилирование про и лиз (коллаген);
йодирование тир (тиреоидные гормоны);
карбоксилирование глу (факторы свертывания крови);
фосфорилирование (казеин молока, регуляция активности ферментов);
ацетилирование (гистоны);
пренилирование (G-белки).
Регуляция биосинтеза белка в клетке
Синтез белка в клетке можно регулировать на этапе транскрипции, созревания иРНК, транспорта ее из ядра в цитоплазму, изменяя стабильность иРНК, в процессе трансляции и посттрансляционной модификации. Регуляция на самых ранних этапах (на уровне экспрессии генов) является наиболее выгодной и потому широко используется.
Примером регуляции экспрессии генов является работа lac-оперона у E. coli. Lac-опе-рон содержит 3 структурных гена ферментов, участвующих в метаболизме лактозы. В отсутствие лактозы оперон заблокирован белком репрессором.
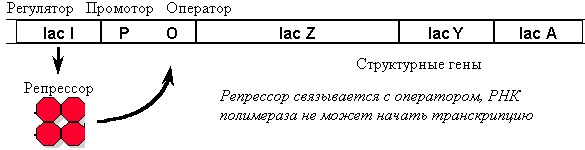
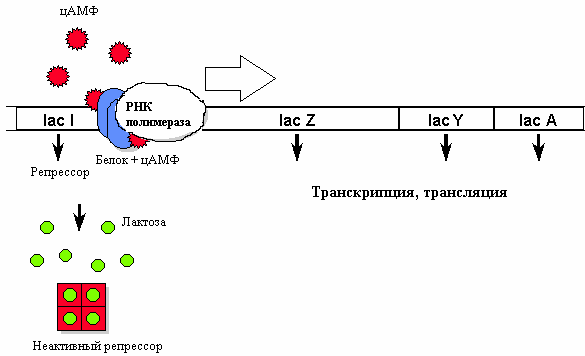
В присутствии индуктора (лактозы) репрессор меняет свою конформацию и отсоединяется от ДНК. Однако если в этот момент в среде имеется глюкоза (более доступный источник энергии), транскрипция не идет. В том случае, если глюкоза отсутствует, в клетке увеличивается уровень цАМФ (сигнал «голода») и цАМФ в комплексе со специальным белком (catabolite activator protein) связывается с промотором. Только в присутствии этого белка РНК-полимераза может образовать прочную связь с промотором и начать транскрипцию.
Белковые факторы, которые способствуют связыванию РНК-полимеразы с промотором, называются факторами транскрипции.
Регуляторная часть генов эукариот устроена более сложно. Имеются энхансеры (элементы, усиливающие транскрипцию), сайленсеры (ослабляющие), адапторные элементы. Факторы транскрипции могут связываться с любым из этих элементов, тем самым регулировать функции генов. В качестве индукторов биосинтеза белка на генетическом уровне могут выступать не только субстраты (лактоза для лактазы), но и стероидные гормоны, витамин Д, тиреоидные гормоны, ионы металлов и др.
СОВРЕМЕННЫЕ МЕТОДЫ МОЛЕКУЛЯРНОЙ БИОЛОГИИ
О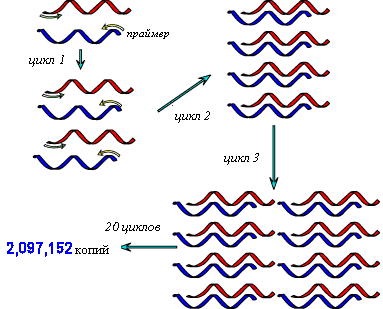 сновными
инструментами в работе молекулярного
биолога с нуклеиновыми кислотами
являются ферменты. Используютрестриктазы(эндонуклеазы, которые узнают специфические
последовательности в ДНК и разрезают
молекулу ДНК в этом месте),ДНК-полимеразы,ДНК-лигазы,экзонуклеазыи др.
сновными
инструментами в работе молекулярного
биолога с нуклеиновыми кислотами
являются ферменты. Используютрестриктазы(эндонуклеазы, которые узнают специфические
последовательности в ДНК и разрезают
молекулу ДНК в этом месте),ДНК-полимеразы,ДНК-лигазы,экзонуклеазыи др.
В настоящее время в основе большинства методов ДНК-диагностики лежит полимеразная цепная реакция (ПЦР). Она позволяет быстро получить большое количество копий молекул ДНК (или их фрагментов), достаточное для их даль-нейшего анализа.
Этапы проведения:
нагревание до 90С (денатура-ция ДНК);
добавление праймера и охлаж-дение до 55С (присоединение или «от-жиг» праймера);
добавление нуклеотидов (суб-стратов для синтеза) и ДНК-полимеразы, которая проводит удвоение ДНК; затем цикл повторяется.
Метод широко используется для диагностики инфекционных заболеваний (туберкулез, хламидиоз, цитомегаловирусная инфекция, СПИД и др.). ПЦР позволяет обнаружить возбудителя в биологическом материале даже тогда, когда другие методы оказываются неэффективны. Второе направление использования метода ПЦР — генетическое тестирование (обнаружение мутаций в генах и диагностика наследственной патологии).
Клонирование — способ получения большой популяции идентичных молекул, клеток, организмов — потомков одного предка.
Проводятся эксперименты по клонированию стволовых клеток человека и их использованию в стоматологической практике (заместительная клеточная терапия).
Д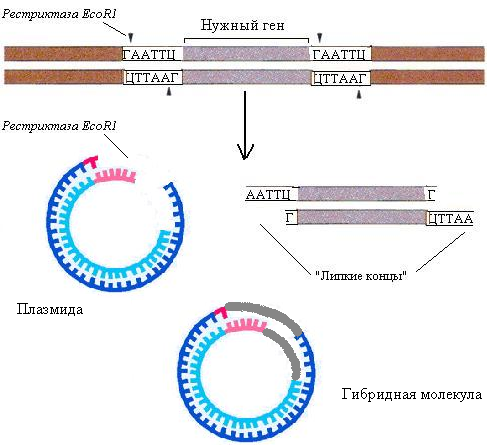 ля
клонирования отдельных генов используются
технологии рекомбинантных ДНК: нужный
ген на специальном носителе вводят в
бактериальную клетку. В процессе
размножения бактерий получают огромное
число копий гена.
ля
клонирования отдельных генов используются
технологии рекомбинантных ДНК: нужный
ген на специальном носителе вводят в
бактериальную клетку. В процессе
размножения бактерий получают огромное
число копий гена.
Вектор — носитель (плазмида или бактериофаг), в который может быть введена чужеродная ДНК с целью клонирования.
Плазмида — небольшая кольцевидная двухцепочечная ДНК, которая реплицируется независимо от ДНК хозяина.
Принципиальный подход к клонированию генов: в плазмиде создают дефект (брешь) с помощью рестриктазы. С помощью этой же рестриктазы вырезают участок ДНК с нужным геном. Благодаря «липким концам» происходит включение чужеродной ДНК в вектор, ДНК-лигаза восстанавливает целостность плазмиды и образованная гибридная молекула помещается в бактериальную клетку.
Экспрессия гена, закодированного в чужеродной ДНК, приводит к образованию бактериями нужного белка, его можно выделить и использовать. Технологии рекомбинантных ДНК позволяют получать для медицинской практики вакцины, инсулин, соматотропный гормон, интерфероны, эритропоэтин, белки эмали и др.
