
- •Белорусский государственный медицинский университет
- •Биологическая химия
- •Содержание
- •Предисловие
- •Структура и функции белков и пептидов. Сложные белки
- •Классификация белков
- •I. Функциональная (по функции, выполняемой в организме)
- •II. По форме молекулы
- •Свойства аминокислот
- •Уровни структурной организации белковых молекул
- •Сложные белки
- •Методы исследования структуры белков и пептидов
- •Этапы исследования первичной структуры белков и пептидов
- •Методы разделения белков Отделение белков от низкомолекулярных примесей
- •Разделение белков по молекулярной массе
- •Выделение индивидуальных белков
- •Анализ гомологичных белков
- •Установление ак-последовательности белка
- •I. Определение n-концевой ак
- •II. Определение с-концевой ак
- •III. Определение ак-последовательности
- •Белки соединительных тканей (Молекулы внеклеточного матрикса)
- •Фибриллярные структурные белки
- •Фибриллярные адгезивные белки
- •Введение в энзимологию. Свойства ферментов
- •Классификация и номенклатура ферментов
- •Строение фермента
- •Единицы измерения активности
- •Влияние температуры
- •Влияние рН
- •Влияние концентрации субстрата
- •Регуляция активности ферментов Принципы регуляции химических процессов в клетке
- •Влияние ингибиторов
- •Ковалентная модификация структуры фермента
- •Примеры использования ингибиторов в медицинской практике
- •Множественные формы ферментов
- •Медицинские аспекты энзимологии
- •Причины гиперферментемий
- •Применение ферментов в медицине
- •2 Стороны метаболизма
- •Общая схема катаболизма пищевых веществ атф и адениловая система клетки
- •Окислительное декарбоксилирование пирувата
- •Последовательность реакций, катализируемых пируватдегидрогеназным комплексом
- •Регуляция пируватдегидрогеназного комплекса
- •Лимоннокислый цикл Кребса, цикл трикарбоновых кислот (цтк)
- •Функции цикла Кребса
- •Регуляция цтк
- •Тканевое дыхание, окислительное фосфорилирование
- •Комплексы дыхательной цепи
- •Пути утилизации кислорода клеткой
- •Переваривание, всасывание, поступление в клетку углеводов. Метаболизм гликогена
- •Переваривание углеводов
- •Всасывание углеводов
- •Транспорт глюкозы в клетки
- •Превращение глюкозы в клетках
- •Метаболизм гликогена
- •Синтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •Гликолиз. Аэробное окисление глюкозы. Глюконеогенез гликолиз
- •Патогенетическая взаимосвязь углеводов пищи и кариеса
- •Аэробное окисление глюкозы
- •Глюконеогенез
- •Пентозофосфатный путь. ГлюкуроновЫй путь пентозофосфатный путь
- •ГлюкуроновЫй путь
- •Переваривание липидов в желудочно-кишечном тракте, система их доставки в клетки Классификация липидов по химическому строению
- •Переваривание и всасывание
- •Ресинтез липидов в клетках слизистой тонкого кишечника:
- •Депонирование и мобилизация липидов из жировых депо, внутриклеточный обмен жирных кислот
- •Внутриклеточный метаболизм жирных кислот
- •Окисление жирных кислот в пероксисомах
- •Синтез жирных кислот
- •Происхождение ненасыщенных жирных кислот в клетках
- •Синтез и нарушения обмена холестерола, метаболизм кетоновых тел
- •Синтез холестерола de novo
- •Регуляция синтеза холестерола
- •Роль нарушений обмена холестерола в развитии атеросклероза
- •Факторы, влияющие на уровень лпнп у человека
- •Факторы, связанные с низким или высоким уровнем хс лпвп
- •Образование и утилизация кетоновых тел
- •Система свёртывания крови
- •Свёртывающая (гемокоагуляционная) система крови
- •Антикоагулянтная система
- •Фибринолитическая система
- •Оценка состояния обмена белков, протеолиз азотистый баланс
- •Протеолиз, свойства протеаз. Ограниченный и тотальный протеолиз
- •Переваривание белков в желудочно-кишечном тракте
- •Транспорт аминокислот в клетки
- •Внутриклеточный обмен аминокислот общие пути катаболизма аминокислот Реакции переаминирования
- •Реакции дезаминирования
- •Пути обезвреживания аммиака в организме — синтез глутамина и мочевины.
- •Химия нуклеопротеинов Нуклеиновые кислоты— биополимеры, мономерами которых являются нуклеотиды.
- •Строение рнк
- •Биосинтез нуклеотидов
- •Фосфорибозиламин
- •Инозинмонофосфат
- •ДТмф дУмф умф
- •Образование дезоксирибонуклеотидов
- •Биосинтез днк
- •Биосинтез рнк
- •Структура рнк-полимеразы прокариот
- •R Аминоацил-тРнк
- •Гормоны. Общий механизм действия гормонов
- •Механизм действия гормонов, взаимодействующих
- •Механизм действия гормонов, взаимодействующих с 1-тмс-рецепторами
- •Механизм действия гормонов, взаимодействующих с внутриклеточными (r)
- •Гормоны — производные белков, пептидов и аминокислот гормоны гипоталамуса
- •Гормоны аденогипофиза Это гормоны белково-пептидной природы.
- •Гормоны задней доли гипофиза
- •Гормоны поджелудочной железы
- •2. Окисление и изомеризация прегненолона в прогестерон. Прегненолон является предшественником всех стероидных гормонов.
- •Половые гормоны
- •Биохимия питания. Макро- и микроэлементы
- •Макроэлементы
- •Концентрация электролитов вне и внутри клетки существенно различается: натрий и кальций преобладают во внеклеточном пространстве, калий и магний — внутри клетки. Кальций
- •Кальцитонин
- •Паратирин (паратгормон)
- •Витамин д (кальциферол), антирахитический
- •Микроэлементы Железо
- •Биохимия питания. Витамины и другие незаменимые факторы питания. Синдром недостаточного питания
- •Витамины
- •Биохимия соединительных тканей и органов полости рта (костная, хрящевая ткани; зубы)
- •Неколлагеновые белки костной ткани и их роль в процессах минерализации
- •Химический состав тканей зуба и кости (весовые %)
- •Биохимия ротовой жидкости
- •Химический состав ротовой жидкости
- •Функции ротовой жидкости
- •1. Защитная.
- •3. Очищающая.
- •Ферменты ротовой жидкости и их роль
- •Поверхностные образования на эмали
- •Фтор (f) и его роль в организме
- •Биохимия печени
- •Функции печени
- •Миофибриллярные (сократительные) белки
- •Молекулярный механизм мышечного сокращения
- •Источники энергии мышечного сокращения
- •Механизмы энергообеспечения мышечного сокращения
Гормоны. Общий механизм действия гормонов
Гормоны — это класс регуляторных молекул, синтезируемых специальными клетками.
Особенности биологического действия: 1) низкая концентрация в крови (10–6–10–12 М); 2) обязательная связь с рецептором – (R), включающим каскадный механизм усиления гормонального сигнала; 3) изменение скорости синтеза ферментов или их активности; 4) регуляция секреции по принципу прямой и (или) обратной связи.
Взаимодействие гормона и (R) характеризуется высокой специфичностью, которая обеспечивается комплементарностью между структурой гормона и активного центра (R). В результате эффекта кооперативности, возникающего при взаимодействии гормона и (R), существенно изменяется активность (R) — это есть феномен амплификации (усиления) гормонального сигнала. Механизм амплификации включает участие специальных ферментов и молекул — вторичных посредников. Гормональный сигнал способен «выключаться» в результате инактивирования (R) путём его фосфорилирования, либо удаления (R) с поверхности клетки (эндоцитоз) и т. д. Множество разных сигналов, воспринимаемых клеткой, суммируется в один определённый ответ.
Клеточные (R) в зависимости от их локализации делятся на 2 большие группы: 1) (R) плазматической мембраны; и 2) внутриклеточные (R).
(R) плазматической мембраны клеток обеспечивают узнавание, связывание и передачу регуляторного сигнала внутрь клетки. Среди них различают:
1. 7-ТМС-(R) — это интегральные мембранные белки с семью трансмембранными спиральными сегментами, соединенными гидрофильными внеклеточными и внутриклеточными петлями. Внутриклеточные петли этих (R) содержат центры связывания G-белка.
2. 1-TMС-(R) — это интегральные мембранные белки с одним трансмембранным сегментом и глобулярными доменами на вне- и внутриклеточной поверхностях мембраны. Внеклеточный домен содержит участок узнавания и связывания гормона, а внутриклеточный обладает каталитической активностью. Когда (R) активируется гормоном, его внутриклеточный домен катализирует образование внутриклеточных вторичных посредников.
3. Каналообразующие (R) — состоят из белковых субъединиц, каждая из которых содержит несколько трансмембранных сегментов.
Внутриклеточные (R) расположены в цитозоле или ядре клетки. После связывания с гормоном они изменяют скорость транскрипции и трансляции определённых генов.
По химической природе гормоны делят на:
пептиды (глюкагон, котрикотропин) и белки (сложные белки — тиреотропин, гонадотропины; простые белки — соматотропин, инсулин);
производные аминокислот (адреналин, серотонин, тироксин);
стероиды (альдостерон, кортизол, половые гормоны, витамин Д и ретиноевая кислота);
производные липидов (эйкозаноиды).
Механизм действия гормонов, взаимодействующих
с 7-ТМС-рецепторами
Первый этап действия гормона заключается во взаимодействии гормона с 7-ТМС-(R) (к ним относятся α- и β-адренергические (R), (R) гистамина, серотонина, соматостатина, гликопротеиновых гормонов, глюкагона, паратирина, кальцитонина, гормонов гипоталамуса).
 Второй
участник передачи гормонального сигнала
—G-белки.
Обнаружены: 1) большие, состоящие из
нескольких субъединиц G-белки
(связаны с мембранами); 2) низкомолекулярные,
состоящие из одной полипептидной цепи
(цитозольные). Все G-белки
обладают ГТФ-азной активностью, и их
конформация зависит от того, связаны
ли они в данный момент с ГДФ или ГТФ.
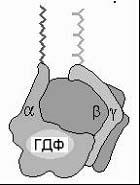
Мембранный G-белок
состоит из 3 субъединиц: α, β и γ.
Второй
участник передачи гормонального сигнала
—G-белки.
Обнаружены: 1) большие, состоящие из
нескольких субъединиц G-белки
(связаны с мембранами); 2) низкомолекулярные,
состоящие из одной полипептидной цепи
(цитозольные). Все G-белки
обладают ГТФ-азной активностью, и их
конформация зависит от того, связаны
ли они в данный момент с ГДФ или ГТФ.
Мембранный G-белок
состоит из 3 субъединиц: α, β и γ.
В неактивном состоянии три субъединицы соединены вместе, и α-субъединица связана с ГДФ. После присоединения гормона к 7-ТМС-(R) и взаимодействия гормон-рецепторного комплекса с G-белком в последнем происходит замена ГДФ на ГТФ, вследствие чего G-белок диссоциирует с образованием свободной α-субъединицы и димера субъединиц β, γ. Затем α-субъединица перемещается по мембране и взаимодействует с мембраносвязанными ферментами (аденилатциклазой или фосфолипазой С), катализирующими образование низкомолекулярных вторичных посредников. Продолжительность эффекта G-белка определяется ГТФ-азной активностью его α-субъединицы: после гидролиза ГТФ до ГДФ действие субъединицы прекращается и G-белок возвращается в исходное тримерное состояние
Аденилатциклаза. Различные типы аденилатциклаз реагируют с α-субъединицами, выполняющими разные функции: если связывание осуществляется с αs-субъединицей G-белка, то фермент активируется, если с αI-cубъединицей, то ингибируется. Аденилатциклаза катализирует образование цАМФ из АТФ. Уровень цАМФ в клетках очень низок, но при активировании аденилатциклазы он может быстро и значительно увеличиваться. Однако это повышение кратковременно. Распад цАМФ катализируется цАМФ-фосфодиэстеразами (ФДЭ), гидролизующими фосфодиэфирную связь в молекуле цАМФ. ФДЭ — регулируемый фермент (его ингибирует кофеин, что приводит к повышению уровня цАМФ).
ц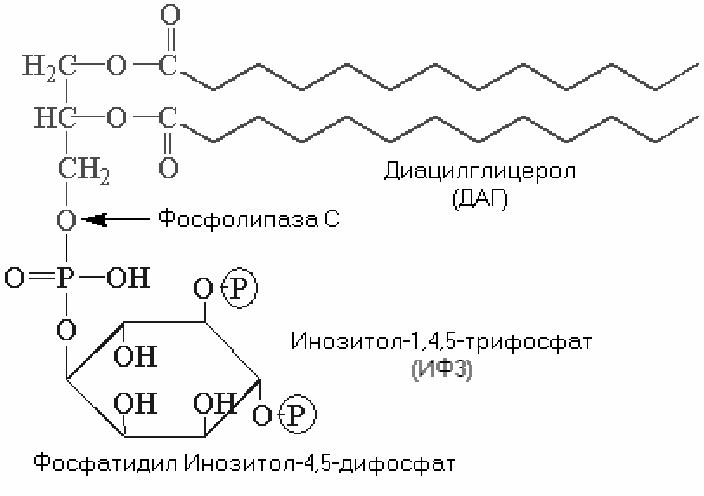 АМФ
является аллостерическим регуляторомпротеинкиназы
А (существуют
разные типы этих ферментов).
Протеинкиназы
— это гетеромеры, состоящие из
двухкаталитических и одной регуляторной
субъединиц. Присоединение цАМФ к
регуляторной субъединице высвобождает
каталитические субъединиц. Последние
переносят фосфорный остаток с АТФ на
серин или треонин некоторых ферментов,
которые при этом переходят в активное
или неактивное состояние (это зависит
от свойств данного фермента: так,
фосфорилирование
гликогенфосфорилазы
активирует ее, а фосфорилирование
гликогенсинтазы её угнетает). цАМФ
регулирует также открытие цАМФ-зависимых
ионных каналов. Повышение уровня цАМФ
может приводить к активации транскрипции
определенных генов.
АМФ
является аллостерическим регуляторомпротеинкиназы
А (существуют
разные типы этих ферментов).
Протеинкиназы
— это гетеромеры, состоящие из
двухкаталитических и одной регуляторной
субъединиц. Присоединение цАМФ к
регуляторной субъединице высвобождает
каталитические субъединиц. Последние
переносят фосфорный остаток с АТФ на
серин или треонин некоторых ферментов,
которые при этом переходят в активное
или неактивное состояние (это зависит
от свойств данного фермента: так,
фосфорилирование
гликогенфосфорилазы
активирует ее, а фосфорилирование
гликогенсинтазы её угнетает). цАМФ
регулирует также открытие цАМФ-зависимых
ионных каналов. Повышение уровня цАМФ
может приводить к активации транскрипции
определенных генов.
Фосфолипаза С. Субстратом этого фермента является фосфатидилинозитол-4,5-дифосфат. Фосфолипаза С катализирует образование двух мощных вторичных посредников: диацилглицерола (ДАГ) и инозитол-1,4,5-трифосфата (ИТФ).
ИТФ связывается с (R) кальцисом, что приводит к открытию лиганд-зависимых кальциевых каналов кальцисом. В результате в цитозоле резко увеличивается концентрация Са2+. Высвободившийся Са2+ захватывается специальными кальций-связывающими белками, например, калмодулином. Когда уровень внутриклеточного Са2+ повышается, кальций-калмодулиновый комплекс присоединяется к различным белкам-мишеням, что сопровождается изменением их активности. Кальмодулин-зависимые протеинкиназы регулируют активность многих ферментов. Они также способны проникать в ядро клетки, где фосфорилируют белки, ответственные за активацию транскрипции.
Таким образом, ИТФ повышает концентрацию Са2+ в цитозоле. ДАГ остается в плазматической мембране и либо гидролизуется с образованием арахидоновой кислоты (необходимой для синтеза простагландинов), либо активирует протеинкиназу С. При низком внутриклеточном уровне Са2+ и отсутствии ДАГ протеинкиназа С находится в цитоплазме в неактивном состоянии. При связывании ДАГ конформация протеинкиназы С изменяется, увеличивается её сродство к Са2+ и она начинает активировать разнообразные белки-мишени (так, С-киназа фосфорилирует и тем самым активирует Na+/H+ обменный насос плазматической мембраны, контролирующий внутриклеточный рН). Активная С-киназа способна усиливать транскрипцию генов.
