
- •Белорусский государственный медицинский университет
- •Биологическая химия
- •Содержание
- •Предисловие
- •Структура и функции белков и пептидов. Сложные белки
- •Классификация белков
- •I. Функциональная (по функции, выполняемой в организме)
- •II. По форме молекулы
- •Свойства аминокислот
- •Уровни структурной организации белковых молекул
- •Сложные белки
- •Методы исследования структуры белков и пептидов
- •Этапы исследования первичной структуры белков и пептидов
- •Методы разделения белков Отделение белков от низкомолекулярных примесей
- •Разделение белков по молекулярной массе
- •Выделение индивидуальных белков
- •Анализ гомологичных белков
- •Установление ак-последовательности белка
- •I. Определение n-концевой ак
- •II. Определение с-концевой ак
- •III. Определение ак-последовательности
- •Белки соединительных тканей (Молекулы внеклеточного матрикса)
- •Фибриллярные структурные белки
- •Фибриллярные адгезивные белки
- •Введение в энзимологию. Свойства ферментов
- •Классификация и номенклатура ферментов
- •Строение фермента
- •Единицы измерения активности
- •Влияние температуры
- •Влияние рН
- •Влияние концентрации субстрата
- •Регуляция активности ферментов Принципы регуляции химических процессов в клетке
- •Влияние ингибиторов
- •Ковалентная модификация структуры фермента
- •Примеры использования ингибиторов в медицинской практике
- •Множественные формы ферментов
- •Медицинские аспекты энзимологии
- •Причины гиперферментемий
- •Применение ферментов в медицине
- •2 Стороны метаболизма
- •Общая схема катаболизма пищевых веществ атф и адениловая система клетки
- •Окислительное декарбоксилирование пирувата
- •Последовательность реакций, катализируемых пируватдегидрогеназным комплексом
- •Регуляция пируватдегидрогеназного комплекса
- •Лимоннокислый цикл Кребса, цикл трикарбоновых кислот (цтк)
- •Функции цикла Кребса
- •Регуляция цтк
- •Тканевое дыхание, окислительное фосфорилирование
- •Комплексы дыхательной цепи
- •Пути утилизации кислорода клеткой
- •Переваривание, всасывание, поступление в клетку углеводов. Метаболизм гликогена
- •Переваривание углеводов
- •Всасывание углеводов
- •Транспорт глюкозы в клетки
- •Превращение глюкозы в клетках
- •Метаболизм гликогена
- •Синтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •Гликолиз. Аэробное окисление глюкозы. Глюконеогенез гликолиз
- •Патогенетическая взаимосвязь углеводов пищи и кариеса
- •Аэробное окисление глюкозы
- •Глюконеогенез
- •Пентозофосфатный путь. ГлюкуроновЫй путь пентозофосфатный путь
- •ГлюкуроновЫй путь
- •Переваривание липидов в желудочно-кишечном тракте, система их доставки в клетки Классификация липидов по химическому строению
- •Переваривание и всасывание
- •Ресинтез липидов в клетках слизистой тонкого кишечника:
- •Депонирование и мобилизация липидов из жировых депо, внутриклеточный обмен жирных кислот
- •Внутриклеточный метаболизм жирных кислот
- •Окисление жирных кислот в пероксисомах
- •Синтез жирных кислот
- •Происхождение ненасыщенных жирных кислот в клетках
- •Синтез и нарушения обмена холестерола, метаболизм кетоновых тел
- •Синтез холестерола de novo
- •Регуляция синтеза холестерола
- •Роль нарушений обмена холестерола в развитии атеросклероза
- •Факторы, влияющие на уровень лпнп у человека
- •Факторы, связанные с низким или высоким уровнем хс лпвп
- •Образование и утилизация кетоновых тел
- •Система свёртывания крови
- •Свёртывающая (гемокоагуляционная) система крови
- •Антикоагулянтная система
- •Фибринолитическая система
- •Оценка состояния обмена белков, протеолиз азотистый баланс
- •Протеолиз, свойства протеаз. Ограниченный и тотальный протеолиз
- •Переваривание белков в желудочно-кишечном тракте
- •Транспорт аминокислот в клетки
- •Внутриклеточный обмен аминокислот общие пути катаболизма аминокислот Реакции переаминирования
- •Реакции дезаминирования
- •Пути обезвреживания аммиака в организме — синтез глутамина и мочевины.
- •Химия нуклеопротеинов Нуклеиновые кислоты— биополимеры, мономерами которых являются нуклеотиды.
- •Строение рнк
- •Биосинтез нуклеотидов
- •Фосфорибозиламин
- •Инозинмонофосфат
- •ДТмф дУмф умф
- •Образование дезоксирибонуклеотидов
- •Биосинтез днк
- •Биосинтез рнк
- •Структура рнк-полимеразы прокариот
- •R Аминоацил-тРнк
- •Гормоны. Общий механизм действия гормонов
- •Механизм действия гормонов, взаимодействующих
- •Механизм действия гормонов, взаимодействующих с 1-тмс-рецепторами
- •Механизм действия гормонов, взаимодействующих с внутриклеточными (r)
- •Гормоны — производные белков, пептидов и аминокислот гормоны гипоталамуса
- •Гормоны аденогипофиза Это гормоны белково-пептидной природы.
- •Гормоны задней доли гипофиза
- •Гормоны поджелудочной железы
- •2. Окисление и изомеризация прегненолона в прогестерон. Прегненолон является предшественником всех стероидных гормонов.
- •Половые гормоны
- •Биохимия питания. Макро- и микроэлементы
- •Макроэлементы
- •Концентрация электролитов вне и внутри клетки существенно различается: натрий и кальций преобладают во внеклеточном пространстве, калий и магний — внутри клетки. Кальций
- •Кальцитонин
- •Паратирин (паратгормон)
- •Витамин д (кальциферол), антирахитический
- •Микроэлементы Железо
- •Биохимия питания. Витамины и другие незаменимые факторы питания. Синдром недостаточного питания
- •Витамины
- •Биохимия соединительных тканей и органов полости рта (костная, хрящевая ткани; зубы)
- •Неколлагеновые белки костной ткани и их роль в процессах минерализации
- •Химический состав тканей зуба и кости (весовые %)
- •Биохимия ротовой жидкости
- •Химический состав ротовой жидкости
- •Функции ротовой жидкости
- •1. Защитная.
- •3. Очищающая.
- •Ферменты ротовой жидкости и их роль
- •Поверхностные образования на эмали
- •Фтор (f) и его роль в организме
- •Биохимия печени
- •Функции печени
- •Миофибриллярные (сократительные) белки
- •Молекулярный механизм мышечного сокращения
- •Источники энергии мышечного сокращения
- •Механизмы энергообеспечения мышечного сокращения
Свойства аминокислот
Кислотно-основные свойства
Амфотерность
Аминокислоты имеют 2 функциональные группы с противоположными свойствами: кислую карбоксильную и основную аминогруппу. Поэтому в водном растворе аминокислоты существуют в виде биполярного иона.
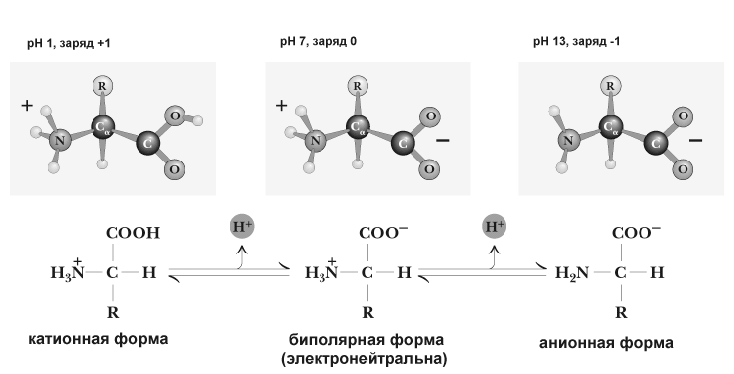
При добавлении в раствор аминокислот дополнительного количества протонов (кислоты) подавляется диссоциация карбоксильных групп и увеличивается количество NH3+-групп. Аминокислоты при этом переходят в катионную форму (приобретают положительный заряд). При добавлении щелочи, наоборот, увеличивается диссоциация карбоксильных групп. Аминокислоты переходят в анионную форму (приобретают отрицательный заряд). Изменяя, таким образом, pH раствора, можно изменять заряд молекул аминокислот.
Нейтральные аминокислоты в воде не имеют заряда. Дикарбоновые аминокислоты имеют две карбоксильные группы, которые диссоциируют, отдавая 2 протона, но поскольку у них только одна аминогруппа, принимающая один протон, то такие аминокислоты ведут себя как кислоты и раствор их имеет кислую реакцию. Сам ион аминокислоты заряжается отрицательно.
Д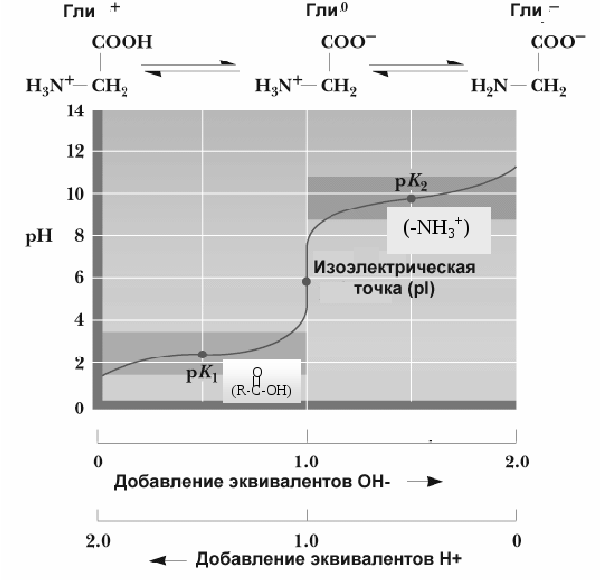 иаминомонокарбоновые
аминокислоты реагируют в водном растворе
как слабые основания, так как один
протон, который освобождается при
диссоциации карбоксильной группы таких
аминокислот, связывается с одной из
аминогрупп, а вторая аминогруппа
связывает протон из водного окружения,
в результате увеличивается количество
OH–
групп и повышается pH. Заряд иона таких
аминокислот будет положительным.
иаминомонокарбоновые
аминокислоты реагируют в водном растворе
как слабые основания, так как один
протон, который освобождается при
диссоциации карбоксильной группы таких
аминокислот, связывается с одной из
аминогрупп, а вторая аминогруппа
связывает протон из водного окружения,
в результате увеличивается количество
OH–
групп и повышается pH. Заряд иона таких
аминокислот будет положительным.
Добавляя к раствору аминокислоты определенное количество кислоты или щелочи, можно изменить их заряд. При определенном значении pH наступает такое состояние, при котором заряд аминокислоты становится нейтральным. Такое значение pH получило название изоэлектрической точки (ИЭТ). При значении pH, равном изоэлектрической точке, аминокислоты не перемещаются в электрическом поле. Если pH ниже изоэлектрической точки, катион аминокислоты движется к катоду, а при pH выше ИЭТ анион аминокислоты — к аноду. На этих свойствах аминокислот основана возможность разделения их в электрическом поле (электрофорез). Кислые аминокислоты имеют ИЭТ в слабокислой среде, основные — в слабоосновной, а нейтральные — в нейтральной.
С
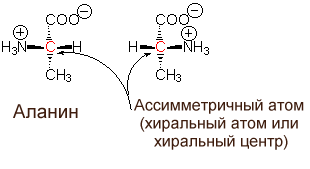 тереоизомерия
тереоизомерия
Обусловлена наличием у аминокислоты ассиметричного атома углерода (называется хиральный центр).
по абсолютной конфигурации (эталон — глицериновый альдегид).
А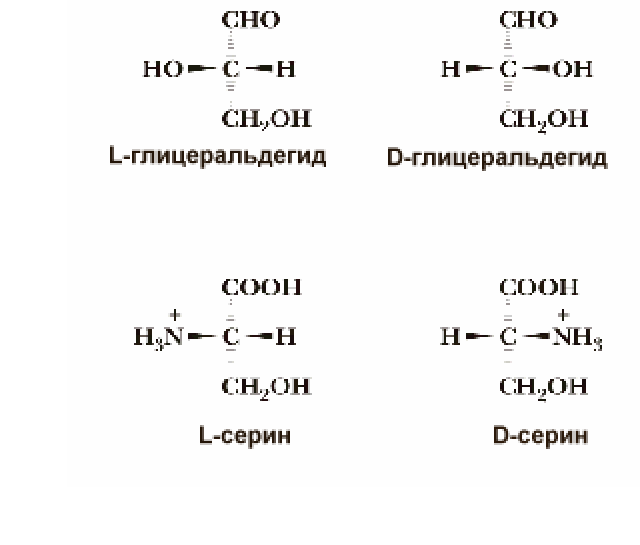 К
могут быть L- или D-стереоизомеры. В состав
белков организма входятL-стереоизомеры
аминокислот.
К
могут быть L- или D-стереоизомеры. В состав
белков организма входятL-стереоизомеры
аминокислот.
Спектральные свойства
Все аминокислоты поглощают свет в инфракрасной области спектра. Три циклических аминокислоты (фенилаланин, тирозин и триптофан) поглощают свет в ультрафиолетовой области при 280 нм.
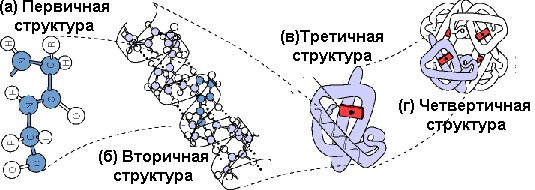
Уровни структурной организации белковых молекул
Первичная структура — это конфигурация полипептидной цепи, которая формируется в результате образования пептидной связи между остатками АК.
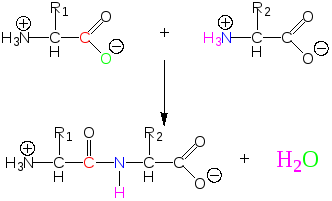
Постулаты (принципы формирования пептидной связи), сформулированные Л. Поллингом и Р. Кори:
1) атомы, образующие пептидную связь, копланарны (расположены в одной плоскости); вращение атомов или групп атомов вокруг пептидной связи невозможно;
2) принцип эквивалентности вклада АК-остатков в образование пептидной связи и, тем самым, в образование полипептидной цепи (исключение пролин);
3) принцип максимума водородных связей.
Первичную структуру белка стабилизируют (поддерживают):
пептидные связи (между АК-остатками);
дисульфидные связи (между свободными –SH-группами цистеина).
Первичная структура белка несет информацию о его пространственной структуре.
Вторичная структура белка — локальная конформация, обусловленная вращением отдельных участков полипептидной цепи вокруг одинарных ковалентных связей.
Основные связи, которые стабилизируют вторичную структуру, — водородные.
Виды вторичной структуры:
α-спираль (правозакрученная)

β-структура • β-слой
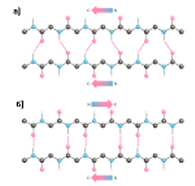
Параллельная
Антипараллельная
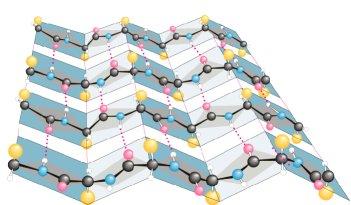
β-поворот

Несколько участков полипептидной цепи, организованных в пространстве в форме -спирали или -структуры, могут объединяться, формируя надвторичную структуру. В результате в молекуле белка образуются домены (функциональные или структурные).
Третичная структура белка — это расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют собственную локальную конформацию.
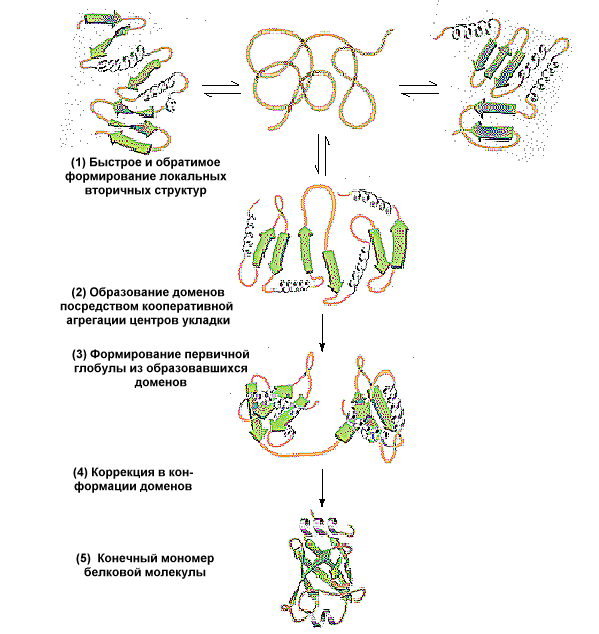
Этапы формирования третичной структуры (см. рис.):
Поддержанию третичной структуры белка способствуют гидрофобные связи, которые образуются внутри молекулы. В образовании этих связей принимают участие неполярные радикалы аминокислот. Могут также образовываться другие нековалентные связи.
У белка, имеющего третичную структуру, на поверхности молекулы формируется участок, который может присоединять к себе другие молекулы, называемые лигандами. Этот участок называется активный центр и формируется из радикалов аминокислот, которые сближаются друг с другом при формировании третичной структуры. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда.
Четвертичная структура формируется при объединении нескольких полипептидных цепей, имеющих третичную структуру. Образованный таким образом белок обладает новой функцией.
![]()
![]()
Белки с четвертичной структурой называются олигомерными, а составляющие их индивидуальные полипептидные цепи — протомерами или мономерами. Такие соединения стабилизируются водородными связями и электростатическими взаимодействиями между АК-остатками, расположенными на поверхности протомеров.
Преимущества белков с четвертичной структурой:
1) экономия генетического материала;
2) уменьшение числа ошибок при синтезе белка;
3) качественное разнообразие белков — появление у белков новых функций.
