
УПП Физическая химия 260800.62
.pdf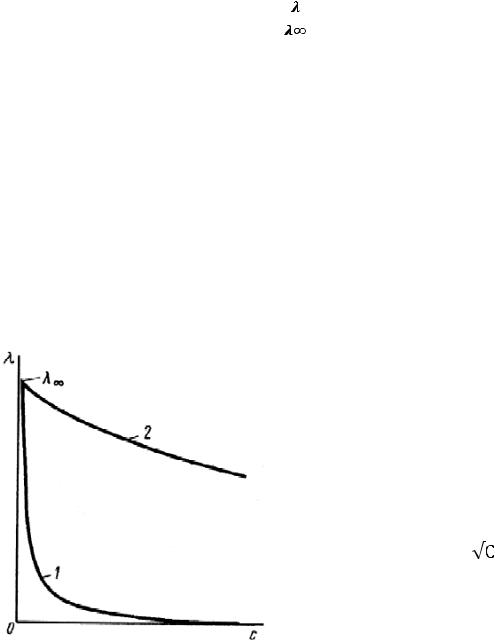
α = |
|
(173) |
|
Из выражения (173) следует, что степень диссоциации раствора слабого электролита при изменении концентрации можно определить, используя экспериментальные данные значений молярной электрической проводимости его разбавленных растворов. Так как λ∞ для электролита постоянна, то изменение электрической проводимости разбавленного раствора слабого электролита при изменении его концентрации определяется только зависимостью от концентрации раствора.
В растворах сильных электролитов изменение молярной электрической проводимости с концентрацией обусловлено влиянием электростатического взаимодействия ионов на скорость их движения.
График зависимости молярной электрической проводимости от концентрации раствора для слабых электролитов выражается более резким уменьшением λ при увеличении концентрации, чем кривая этой же зависимости для сильных электролитов (рис. 14).
Зависимость молярной проводимости раствора от концентрации сильных электролитов изучалась многими исследователями. Наиболее известно эмперическое уравнение Кольрауша для разбавленных растворов, называемое законом квадратного корня:
|
|
|
λ = λ∞ - h |
|
|
(174) |
||
|
|
где |
h |
– |
|
эмперический |
||
|
|
коэффициент. |
|
|
|
|
||
|
|
Эта зависимость подтверждена |
||||||
Рис. 14. Зависимость молярной |
многочисленными экспериментами и |
|||||||
теоретически |
обоснована |
в теории |
||||||
электрической |
проводимости |
|||||||
Дебая-Хюккеля-Онзагера. |
|
|||||||
растворов слабых (1) |
и сильных (2) |
|
||||||
электролитов от их концентрации.
Согласно этой теории уменьшение молярной электрической проводимости разбавленных растворов сильных электролитов при увеличении концентрации электролита объясняется уменьшением скорости движения ионов за счет электростатического взаимодействия ионов, окруженных их ионосферами, при движении таких ионов в электрическом поле.
6.3. Кондуктометрия
Кондуктометрия – метод исследования, основанный на измерении электрической проводимости растворов электролитов. Этот метод
71
достаточно прост, точен, позволяет решить ряд важных научноисследовательских и производственных задач.
Кондуктометрия находит широкое применение в биохимических, биологических, биотехнологических, технохимических, санитарногигиенических, клинических и самых различных других аналитических исследованиях.
Этот метод позволяет определить общее содержание и электролитный состав минеральных вод, продуктов питания, пищевого и биотехнологического сырья (сахарных сиропов, патоки, влажного зерна, молочной сыворотки и т.д.), а также плазмы и сыворотки крови и других биологических жидкостей.
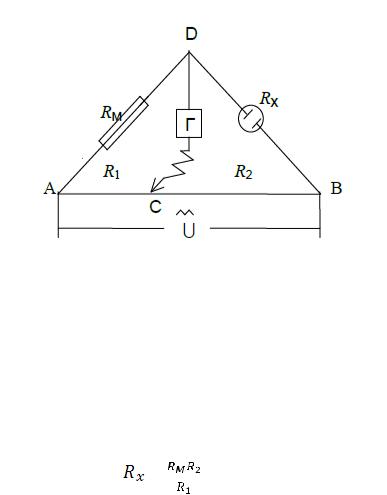
Измеряя электрическую проводимость растворов, определяют основность органических кислот, растворимость и произведение растворимости малорастворимых соединений, константу и степень диссоциации слабых электролитов. Широко используется кондуктометрическое титрование различных (особенно мутных) растворов. Экспериментальное определение электрической проводимости раствора электролита основано на измерении сопротивления раствора при прохождении электрического тока методом компенсации. Для этого используется мостовая схема (рис. 15):
Рис.15. Схема установки для измерения электрического сопротивления раствора: АВ – реохорд с фиксированными значениями сопротивлений в различных положениях скользящего контакта С; Rм – магазин сопротивлений; Rx – сосуд с исследуемым раствором, сопротивление которого следует определить; Г – нульинструмент (гальванометр или осциллограф); – генератор тока высокой частоты.
Перемещая контакт С по реохорду АВ, добиваются отсутствия тока или его минимума в цепи CD. При этом справедливо соотношение: RM/Rx = R1/R2, отсюда:
= |
|
(175) |
|
72
Переменный ток высокой частоты (в схеме измерения) используется для того, чтобы избежать последствий электролиза на электродах в сосуде с исследуемым раствором и для уменьшения емкостного сопротивления.
6.4. Электрохимические процессы
Электрохимические процессы - это окислительно-восстановительные реакции, которые сопровождаются возникновением электрического тока или вызываются электрическим током. Выделяют две группы электрохимических процессов:
-процессы превращения электрической энергии в химическую (электролиз);
-процессы превращения химической энергии в электрическую (гальванические элементы)
Ктипу электрохимических реакций относятся электродные процессы,
вкоторых осуществляется перенос носителей заряда через границу раздела проводников тока. Любой электродный процесс протекает в двух направлениях: катодном, если перенос электронов осуществляется от электрода к молекулам или ионам (восстановление), и анодном, если происходит переход электронов на электрод (окисление).
Состояние равновесия электродного процесса определяется электродным потенциалом Е. Разность электродных потенциалов Е – это электродвижущая сила (ЭДС) гальванического элемента. ЭДС можно измерить компенсационным методом, при котором ток в цепи не протекает и
потенциалы на электродах сохраняются постоянными. Этот метод заключается в том, что от внешнего источника тока на электроды методом подбора подают такое напряжение, которое равно разности потенциалов между электродами, но противоположно по знаку. При этом ток в системе будет отсутствовать и на электродах установится состояние, максимально приближающееся к равновесному. Таким образом, измерение потенциала сводится к измерению компенсирующего напряжения, а прибор для измерения ЭДС этим методом называется потенциометром.
6.5. Электродные процессы
Электродные процессы - химические превращения в растворах или расплавах, при которых происходит перенос заряда через границу между электродом и электролитом.
При контакте двух конденсированных тел (жидких и твердых) на границе раздела фаз возникает электрический потенциал Е, характеризующий электродвижущую силу (ЭДС) изучаемых систем, в том числе биологических. Это относится к растворам белков, к растительным и животным клеткам, нервным и мышечным волокнам, к биосырью, химическим электродам, коррозионным процессам.
73

6.6. Классификация электродов
Электродом называется устройство, состоящее из твердого тела (металл, стекло), опущенного в раствор электролита, в котором на границе раздела фаз возникает электрический заряд, или электродный потенциал Е.
Химически активные металлы (цинк, алюминий, железо) дают отрицательные электродные потенциалы, а металлы малоактивные (медь, ртуть, платина, серебро) – положительные.
Электрохимические электроды подразделяют на два основных типа: обратимые электроды и необратимые электроды. На обратимых электродах при изменении направления тока протекает та же реакция, но в обратном направлении. На необратимых электродах при перемене направления тока возникает новый химический процесс. Примером обратимого электрода служит медь в растворе, содержащем Сu2+, к необратимым электродам относится медь в растворе кислоты.
По природе окислителей и восстановителей, которые участвуют в электродном процессе, обратимые электроды подразделяются на следующие классы:
а) Электроды 1-го рода – металл в контакте с раствором своей соли. Эти электроды являются основой большинства гальванических элементов.
б) Электроды 2-го рода – на поверхность металла наносится слой его труднорастворимой соли, а раствор содержит анионы этой соли. Они используются для определения произведения растворимости (ПР) солей.
в) Электроды 3-го рода (окислительно-восстановительные электроды)
– платиновая пластина, погруженная в раствор смеси веществ, содержащей химический элемент в различных степенях окисления. С помощью таких электродов определяются электрохимические потенциалы окислительновосстановительных реакций.
г) Ионообменные (ионоселективные) электроды – мембранные конструкции, содержащие растворы солей, ионы которых могут проходить сквозь мембрану. Они применяются для измерения концентраций ионов.
6.6.1. Электроды первого рода
Электроды первого рода состоят из металла, опущенного в раствор своей соли.
Ме |
Ме |
74
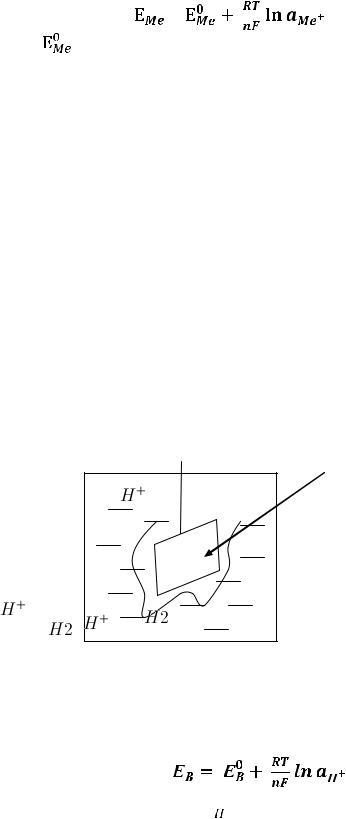
Потенциал Е определяется по следующему уравнению Нернста:
|
= |
|
(176) |
|
|
||
где: |
– стандартный потенциал, то есть измеренный при Р=1атм., |
||
Т=25° С, n – число электронов, a – активность металла в растворе, R – универсальная газовая постоянная (равна 8,314 Дж/моль К), Т – абсолютная температура, F– постоянная Фарадея, равная 96 484 Кл/ моль.
К электродам первого рода относятся металлические электроды (Cu, Zn, Ni), из которых можно составлять различные гальванические цепи, позволяющие получать источники тока, гальванические батарейки, а также водородный электрод.
Водородный электрод
Для того, чтобы сравнить электродные потенциалы различных систем между собой был выбран стандартный электрод сравнения – водородный электрод, потенциал которого при а =1 моль и Р=1 атм условно был принят за ноль (Е =0). Составляя схему из двух электродов, один из которых водородный, можно измерить электродный потенциал любой системы.
Водородный электрод представляет собой пористую платиновую пластину, опущенную в раствор, содержащий газообразный водород и ионы водорода.
Pt |
|
|
На данном электроде протекает следующая реакция:
1/2Н2 → Н+ + е-
и его потенциал, рассчитанный по уравнению Нернста равен:
при 
 = 1 и Р = 1 атм.
= 1 и Р = 1 атм.
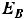 =
= 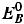 = 0
= 0
75

6.6.2. Электроды второго рода
Электроды второго рода состоят из металлической пластины или стержня, покрытого труднорастворимой солью данного металла и опущенного в раствор электролита, имеющего анион, общий с анионом труднорастворимой соли.
Me |
Их потенциал определяется по уравнению Нернста:
где 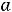 - активность аниона в растворе электролита.
- активность аниона в растворе электролита.
Вкачестве примеров электродов второго рода можно привести:
1)хлорсеребряный, состоящий из серебряного стержня, покрытого труднорастворимой солью AgCl и опущенного в раствор KCl
Ag |
AgCl |
KCl |
На данном электроде протекает следующая окислительно- |
восстановительная реакция: |
2)Каломельный, состоящий из платинового электрода, опущенного в
ртуть, покрытого труднорастворимой каломелью (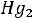
 ), сверху заполненного насыщенным раствором KCl.
), сверху заполненного насыщенным раствором KCl.
76
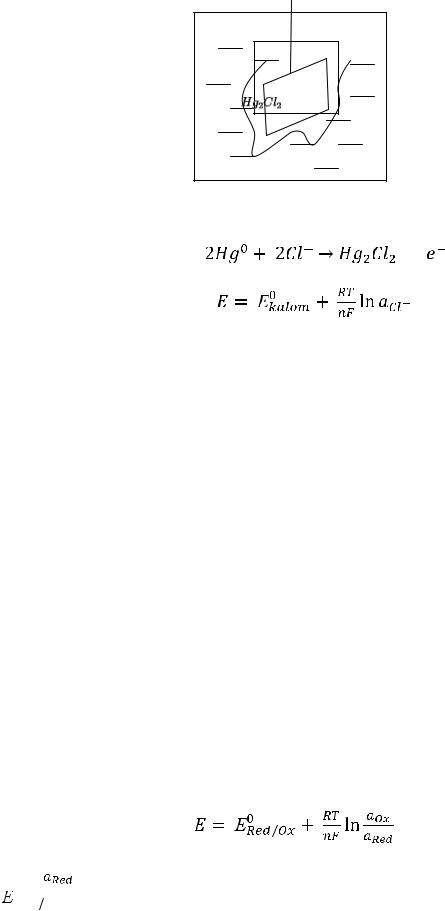
Pt |
Hg |
KCl |
На электроде протекает следующая окислительно-восстановительная |
реакция: |
+ 2 |
Электроды второго рода имеют постоянное значение Е = f(T) и используются наряду с водородным электродом в качестве электродов сравнения в различных гальванических цепях. Например, при концентрации KCl, равной 0,1 н, электродный потенциал (Е) каломельного электрода составит +0,336 В, а хлорсеребряного электрода + 0,29 В. При концентрации KCl равной 1 н, на каломельном электроде потенциал будет равен + 0,281 В, а на хлорсеребряном электроде + 0,238 В.
6.6.3. Электроды третьего рода
Электроды третьего рода – окислительно-восстановительные электроды (редокс - электроды). Примером таких электродов служит инертный металл (платиновая пластина или проволока), опущенный в раствор, содержащий двухвалентное железо FeCl2 и трехвалентное – FeCl3, в которых протекает следующий электродный процесс:
Fe2+ Fe3+ + e-
или в общем случае
Red Ox + ne-
где: Red – восстановленная форма вещества, Ох – окисленная форма вещества.
Электродный потенциал Е таких электродов рассчитывается по уравнению Нернста:
(177)
где: 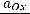 - активность окисленной и восстановленной формы вещества,
- активность окисленной и восстановленной формы вещества, 
 - его стандартный окислительно-восстановительный потенциал.
- его стандартный окислительно-восстановительный потенциал.
77
При исследовании биологических объектов часто приходится иметь дело со сложными редокс-системами, в которых присутствуют окислительные и восстановительные формы различных соединений.
В таблице 10 приведены некоторые окислительно-восстановительные электродные потенциалы, играющие важную роль в биологических системах при ферментативном окислении субстратов, при дыхательных процессах, при синтезе АТФ.
Таблица 10. Некоторые окислительно-восстановительные системы
Электрод Red/Ox |
Электродная реакция |
Электродный |
|||||||||||
потенциал, В |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Fe3+/Fe2+ |
Fe3+ + e- Fe2+ |
0,77 |
|||||||||||
H+/H2 |
2H+ + 2e- H2 |
0,0 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1,51 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Fe3+/Fe2+ гемоглобина |
Fe3+ + e- Fe2+ |
0,254 |
|||||||||||
Пируват/лактат |
СН3СОСОО- + 2Н+ + 2 |
|
|
0,185 |
|||||||||
|
|||||||||||||
|
|
|
СН3СНОНСО |
|
|||||||||
Хинон/гидрохинон |
С6Н4О2 + 2Н+ +2 |
|
|
0,70 |
|||||||||
|
|||||||||||||
С6Н4О2/С6Н4(ОН)2 |
|
|
С6Н4(ОН)2 |
|
|||||||||
В двух последних окислительно-восстановительных электродных процессах принимают участие не только электроны, но и ионы  , поэтому
, поэтому
вподобных системах электродный потенциал определяется концентрацией ионов водорода в растворе. Эти электродные системы могут использоваться для определения рН растворов. Чаще всего используется хингидронный электрод, представляющий собой платиновый электрод, опущенный в насыщенный раствор хингидрона с различными значениями рН=1 - 8. Хингидронный электрод просто изготовить, он дает хорошо воспроизводимые результаты и широко используется для измерения рН растворов. но его нельзя применять в щелочных средах (при рН > 8), а также
вприсутствии других окислителей и восстановителей, а также некоторых солей.
Практически во всех пищевых технологиях протекают биохимические ферментативные превращения сырья. Каждый фермент проявляет свою активность при строго определенном значении рН среды, и любое отклонение от рН оптимума вызывает снижение или прекращение его активности. Поэтому контроль рН пищевого сырья является обязательным. Этот контроль удобнее всего проводить с помощью индикаторных электродов, например, водородного или стеклянного, который более удобен в работе, подключенных к рН – метру.
Стеклянный электрод
Стеклянный электрод - сосуд из тонкого стекла, наполненный раствором кислоты или соли, в который погружена для контакта проволока.
78
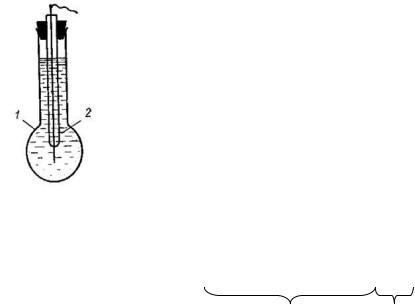
1 – серебряная проволока, покрытая AgCl
2 – 0.1 н раствор HCl
Рис. 16. Устройство стеклянного электрода.
Реакция, протекающая на стеклянном электроде, опущенном в раствор, содержащий ионы Н+:
Ag/AgCl/HCl/стекло]Н+
стеклянный электрод |
рН измеряемой среды |
При измерении рН с помощью стеклянного электрода в пищевое сырье не попадают никакие посторонние химические вещества, но прежде чем использовать стеклянный электрод для измерения рН неизвестного раствора, его калибруют по буферному раствору с известным значением рН. Стеклянный электрод работает в широком интервале значений рН (1 – 11) и не подвержен действию окислителей, восстановителей и других активных соединений. Стеклянный электрод относится к ионообменным электродам, но в области рН от 2 до 9 это электрод используется как водородный, а при рН > 9 - уже как ионоселективный.
Контрольные вопросы
1.Удельная электрическая проводимость, ее зависимость от концентрации электролита, единицы измерения.
2.Молярная электрическая проводимость, ее зависимость от концентрации слабых и сильных электролитов, единицы измерения.
3.Связь между удельной и молярной электрическими проводимостями.
4.Молярная электрическая проводимость при бесконечном разведении.
5.Подвижность ионов и числа переноса.
6.Влияние заряда и радиуса ионов на их электрическую подвижность.
7.Закон независимого движения ионов Кольрауша.
8.Степень диссоциации и электрическая проводимость электролитов.
9.Вывод закона разведения Оствальда для одновалентного электролита.
10.Закон квадратного корня Кольрауша.
11.Электрофоретическое и релаксационное торможение ионов.
12.Понятие электрохимического элемента. Электроды I и II рода.
13.Термодинамика гальванического элемента. ЭДС элемента и электродные потенциалы.
14.Возникновение потенциала на границе раздела фаз. Уравнение Нернста.
15.Электродвижущая сила элемента. Экспериментальное измерение.
79
16.Работа и энергия Гиббса обратимого электродного процесса.
17.Уравнение Нернста для электродов I рода. Приведите примеры.
18.Устройство водородного электрода и уравнение Нернста для него.
19.Стандартный электродный потенциал и электрохимический ряд напряжений металлов.
20.Связь теплового эффекта электрохимической реакции с температурным коэффициентом ЭДС.
21.Уравнение Нернста для электродов II рода. Электроды сравнения и их примеры.
22.Электродная реакция, потенциал и устройство хлорсеребряного электрода.
23.Потенциометрическое определение рН. Стеклянный электрод.
Тема 7. ХИМИЧЕСКАЯ КИНЕТИКА
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – изучение механизма и скорости химической реакции – являются предметом химической кинетики.
7.1. Основные понятия химической кинетики
Химическая кинетика – наука изучающая скорость химических реакций и механизм химических превращений. Химическая реакция заключается в превращении одного или нескольких химических веществ, называемых исходными веществами, в одно или несколько других химических веществ, называемых продуктами реакции. Химические превращения, происходящие в ходе реакции, представляют собой очень сложный процесс, при котором изменяется природа отдельных частиц и их межмолекулярные связи. В большинстве случаев химический процесс происходит не путем прямого превращения исходных веществ в продукты реакции, а состоит из нескольких стадий. Каждую из этих стадий можно рассматривать как самостоятельную химическую реакцию со своими исходными веществами и продуктами. Такую стадию называют элементарной.
Элементарная стадия является наиболее простой составной частью сложного химического процесса и представляет собой совокупность большого числа однотипных элементарных актов непосредственного превращения одной частицы в другую или взаимодействия нескольких частиц. Элементарные стадии химического превращения могут быть весьма разнообразны. Это может быть внутримолекулярная перегруппировка какойлибо одной молекулы, распад молекулы на несколько частиц, или взаимодействие двух и более частиц и др. Совокупность и
80
