
УПП Физическая химия 260800.62
.pdf
Поэтому молярная теплоемкость при постоянных объеме и давлении
Сv = |
|
(21) и |
Cp = |
|
(22) |
|
|
Эти уравнения определяют температурную зависимость внутренней энергии или энтальпии через температурную зависимость соответствующей теплоемкости.
При V = const |
Qv = |
U = Cv |
T |
Qv = |
(23) |
При Р = const |
dQp = |
H = Cp |
T |
Qp = |
(24) |
Чтобы найти связь между Сv и Ср, продифференцируем Н = U + PV по температуре и учтем PV = RT
+ R |
(25) |
или Ср = Сv + R |
(26) |
Зависимость теплоемкости от температуры определяют экспериментально и представляют аналитически в виде интерполяционных полиномов (которые пригодны только для тех интервалов температур, которые указаны в справочниках).
Например, для простых и неорганических соединений принято использовать следующий полином:
Ср = а + bT + |
|
, |
(27) |
|
а для органических соединений |
|
Ср = а+bT +сТ2 + dT3, |
(28) |
где a, b, c, d - коэффициенты, приводимые в справочниках.
1.6. Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа
В общем случае тепловой эффект химической реакции зависит от температуры и давления, при которых проводится реакция. Влиянием давления на ∆H и ∆U реакции обычно пренебрегают. Опираясь на закон Гесса, можно рассчитать тепловой эффект химической реакции только при стандартной температуре 298 К. Влияние температуры на величину теплового эффекта химической реакции описывает закон Кирхгофа:
Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции.
Математическая запись закона Кирхгофа:
= – = ∆CP |
(29) |
11
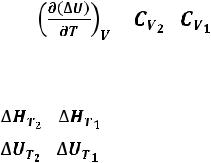
= – =∆CV |
(30) |
Если проинтегрировать выражения от Т = Т1 до Т = Т2, считая ∆СР (∆СV) не зависящим от температуры, получим интегральную форму закона Кирхгофа:
= |
+ ∆СР (Т2 – Т1) |
(31) |
= |
+ ∆CV(T2 – T1) |
(32) |
1.7. Второй закон термодинамики. Понятие об энтропии Основные понятия и определения
Самопроизвольные процессы – процессы, которые протекают без вмешательства со стороны окружающей среды. Такие процессы сопровождаются уменьшением внутренней энергии системы и передачей энергии в окружающую среду в форме теплоты или работы или наоборот, увеличением внутренней энергии за счет теплоты или работы, полученной из окружающей среды.
Несамопроизвольные процессы – процессы, которые сами собой совершаться не могут и протекают за счет «вмешательства извне». Несамопроизвольные процессы в изолированных системах невозможны.
Обратимые процессы – процессы, после протекания которых, и систему, и окружающую среду можно вернуть в первоначальное состояние. При этом в обратимом процессе система проходит через те же промежуточные состояния, что и в прямом процессе, но в обратном порядке. В обратимом процессе все термодинамические функции принимают экстремальные значения. Обратимые процессы являются идеализацией реальных процессов.
Необратимые процессы – процессы, после которых систему и окружающую среду одновременно нельзя вернуть в прежнее состояние. При необратимом процессе систему можно вернуть в первоначальное состояние, но при этом в окружающей среде пройдут некоторые изменения. Необратимые самопроизвольные процессы протекают в направлении, которое приближает систему к состоянию равновесия.
Второй закон термодинамики позволяет определить: 1) будет ли процесс положительным или отрицательным; 2) при каком соотношении концентраций реагентов установится состояние равновесия химической реакции; 3) как температура и давление влияют на это состояние равновесия.
Смысл этого закона состоит в том, что любой самопроизвольный (а значит и необратимый) процесс в замкнутой системе сопровождается возрастанием энтропии системы.
Второй закон термодинамики имеет несколько формулировок:
- Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому (постулат Клаузиуса).
12
-Невозможен процесс, единственным результатом которого является превращение теплоты в работу (постулат Топмсона).
-Невозможно создание вечного двигателя второго рода (формулировка Оствальда). Под вечным двигателем второго рода понимают машину, которая производила бы работу только за счет поглощения теплоты из окружающей среды без передачи части тепла холодильнику, создание которого невозможно.
Вышеизложенные формулировки сводятся к тому, что протекание самопроизвольных процессов сопровождается рассеиванием тепла в окружающую среду. Для количественной характеристики рассеянной энергии в 1865 г. Клаузиус ввел понятие "энтропия", которая является функцией теплоты процесса
S = f(Q) |
(33) |
Следует подчеркнуть, что действие второго закона термодинамики ограничено для изолированных систем. А вот понятие энтропии применимо ко всем видам термодинамических систем и играет важную роль в понимании механизма термодинамических процессов.
Величина энтропии является критерием работоспособности изолированной системы: чем больше S, тем больше связанная энергия (TS), и меньше свободная энергия (так как их сумма – величина постоянная), тем меньше работоспособность системы.
Поскольку тепло – это та часть кинетической энергии частиц системы, которая связана исключительно с хаотическим движением, можно сказать, что понятие тепла выявляет особую качественную характеристику системы – еѐ хаотичность. А энтропия – количественная мера хаотичности системы.
Другой подход к определению энтропии развил Л.Больцман, исходя из вероятностного подхода к описанию термодинамических систем.
Он связал хаотичность с непредсказуемостью – чем более хаотична система, тем более трудно предсказать ее конкретную структуру в определенном термодинамическом состоянии, т.е. при заданных параметрах, например, для газов, указать конкретные координаты и импульсы всех молекул в заданном объеме при определенных P,V,T. Больцман ввел такое понятие как термодинамическая вероятность W.
Термодинамическая вероятность W – это число возможных микросостояний системы, которые обеспечивают параметры данного макросостояния.
Больцман показал, что такая, вероятностная, трактовка хаотичности связана с энтропией по Клаузиусу соотношением:
S = k·lnW |
(34) |
где k – постоянная Больцмана (1,38·10-23 Дж/К),
W –термодинамическая вероятность данного состояния.
Энтропия. Математически энтропия S определяется как функция состояния системы, дифференциалом которой является, а выражение
13
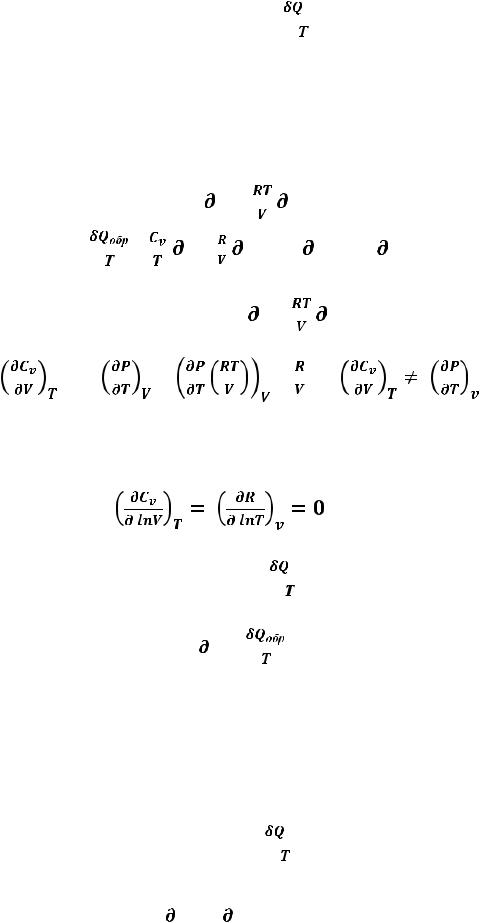
 S =
S =  (35)
(35)
является математической формулировкой второго закона
термодинамики.
Действительно, на примере одного моля идеального газа в случае, когда можно пренебречь всеми другими видами работы кроме работы расширения газа δА = P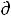 V первое начало термодинамики δQ =
V первое начало термодинамики δQ = 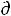 U + δА=
U + δА=
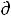 U+P
U+P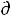 V можно записать как
V можно записать как
откуда |
|
|
δQобр= CV |
T + |
|
V |
(36) |
(37) |
|||||||||||||||||
|
|||||||||||||||||||||||||
|
|
|
= |
|
|
T + |
|
|
|
V = Cv |
lnT + R lnV |
||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
|
Учитывая, что для идеального газа CV не зависит от объема, получаем |
||||||||||||||||||||||||
для количества теплоты |
|
δQобр= CV |
T + |
|
|
|
V |
|
|
||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
= 0, |
|
|
|
|
= |
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
(38) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Таким образом, теплота δQобр не является полным дифференциалом, в то время как для приведенной теплоты
(39)
Таким образом, приведенная теплота 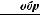 для идеального газа представляет собой полный дифференциал функции состояния – энтропии.
для идеального газа представляет собой полный дифференциал функции состояния – энтропии.
S = |
|
(40) |
|
Энтропия – величина экстенсивная, зависящая от количества вещества в системе.
Она подчиняется закону аддитивности: энтропия равновесной системы равна сумме энтропий отдельных ее частей, а изменение энтропии всей системы равно сумме изменений энтропий ее частей. Изменение энтропии в сложном процессе равно сумме изменений энтропий на отдельных стадиях процесса.
Для обратимого процесса 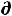 S =
S = 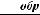 или δQобр=T
или δQобр=T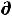 S. Поэтому (только
S. Поэтому (только
для обратимых процессов) первый закон термодинамики δQ = 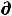 U + δА можно записать в виде
U + δА можно записать в виде
U = T S – δА |
(41) |
14
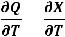
1.8. Третий закон термодинамики
Для вычисления стандартных энтропий веществ важное значение имеет третий закон термодинамики, сформулированный Нернстом (Теорема Нернста, 1905) и М. Планком (Постулат Планка, 1911).
Тепловая теорема Нернста позволяет рассчитать величину «свободной» энергии, т.е. той части внутренней энергии системы, которую можно превратить в работу.
Основные положения тепловой теоремы заключаются в следующем:
1. При абсолютном нуле температуры свободная энергия X равна теплоте процесса.
Х0 = Q0 |
(42) |
2. При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю.
= =0 (43)
В 1911 М. Планк сформулировал третий закон термодинамики, как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю: S0 = 0, что даѐт возможность определять абсолютное значения энтропии и др. термодинамических потенциалов. Энтропию можно выразить через термодинамическую вероятность (W) состояния системы: S = k lnW (Больцмана принцип). При абсолютном нуле температуры система находится в основном квантово-механическом состоянии, если оно невырождено, для которого W = 1 (состояние реализуется единственным микрораспределением). Следовательно, энтропия S при Т = 0 равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем может стать существенной при T → 0 дискретность квантовых уровней макроскопической системы, приводящая к явлениям квантового вырождения.
lnW (Больцмана принцип). При абсолютном нуле температуры система находится в основном квантово-механическом состоянии, если оно невырождено, для которого W = 1 (состояние реализуется единственным микрораспределением). Следовательно, энтропия S при Т = 0 равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем может стать существенной при T → 0 дискретность квантовых уровней макроскопической системы, приводящая к явлениям квантового вырождения.
Постулат Планка:
При абсолютном нуле энтропия правильно построенного кристалла любого химического элемента или соединения в чистом состоянии равна нулю.
∆S = S(T) - S(0) => ∆S ≈ S(T) |
(44) |
При стандартных условиях (Р=1атм., Т=298К) определяют стандартную абсолютную энтропию.
Третий закон термодинамики гласит, что при стремлении температуры к нулю энтропия для равновесных состояний также стремится к нулю.
1.9. Термодинамические потенциалы
Изменение энтропии однозначно определяет направление и предел самопроизвольного протекания процесса лишь для наиболее простых систем – изолированных. Для характеристики процессов, протекающих в закрытых системах, были введены новые термодинамические функции
15

состояния: изобарно-изотермический потенциал (свободная энергия Гиббса) и изохорно-изотермический потенциал (свободная энергия Гельмгольца).
Работа процесса δА в общем случае состоит из полезной работы δА' и механической работы расширения Р V
V
δА=δА'+ Р V |
(45) |
С учѐтом неравенства Клаузиуса TdS ≥ δQ, объединенное выражение первого и второго законов термодинамики
U ≤ T S – δА |
(46) |
будет иметь вид
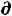 U ≤ T
U ≤ T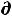 S – δА' – Р
S – δА' – Р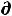 V (47)
V (47)
откуда полезная работа, совершаемая системой
δА' ≤ - 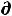 U +T
U +T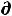 S - Р
S - Р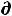 V (48)
V (48)
При обратимом процессе полезная работа достигает максимального уровня, при этих условиях имеет место равенство
δА'max = - 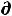 U + T
U + T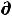 S – Р
S – Р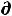 V (49)
V (49)
В термодинамике для описания обратимых процессов рассматриваются особые функции, характеризующие состояние системы, называемые термодинамическими потенциалами, которые характеризуют эту систему в начальном и конечном ее состоянии.
Термодинамические потенциалы являются частным случаем так называемых характеристических функций.
Характеристической функцией называется функция состояния, посредством которой, и ее частных производных разных порядков по соответствующим переменным, могут быть наиболее просто и в явном виде выражены все термодинамические свойства системы (Р, V, T, S и др.).
В зависимости от условий протекания процесса различают четыре термодинамических потенциала.
1) Внутренняя энергия
При V,S = const уравнение δА'max = -  U + T
U + T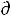 S – P
S – P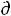 V переходит в
V переходит в
δА'max = - UV,S или |
UV,S=А'max (50) |
Для систем, в которых совершается только механическая работа (δА'= 0)
U =T S – Р V |
(51) |
16

2) Энтальпия |
|
При S = const уравнение δА'max = - U + T S – Р V примет вид |
|
δА'max = - (U + РV) = - HР,S или -∆HР,S= А'max |
(52) |
Для систем, в которых совершается только механическая работа (δА'= 0)
- U + T S –Р V = 0; H = U +Р V + V Р= T S + V Р |
(53) |
|
H = T S + V Р |
(54) |
|
По общему признаку S=const функции U и S называют изоэнтропийными потенциалами.
Следует отличать тепловые эффекты ∆UV,T и ∆HР,T, равные выделяющейся или поглощаемой теплоте при равенстве температур исходных веществ и продуктов реакции и отсутствии полезной работы, от термодинамических потенциалов ∆UV,S и ∆HP,S, равных максимально полезной работе (с обратным знаком).
3) Энергия Гельмгольца
При V,T = const уравнение δА'max = - 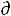 U + T
U + T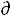 S – Р
S – Р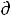 V примет вид
V примет вид
δА'max = - (U -TS) = - AV,T или |
-∆AV,T= А'max (55) |
где A = U – TS – энергия Гельмгольца или свободная энергия – новая функция состояния – изохорно-изотермический потенциал (чаще называемый изохорный потенциал).
Изменение изохорного потенциала |
|
A= U – T S –S T |
(56) |
С другой стороны, при отсутствии механической работы (δА'=0)
δА'max = - 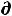 U + T
U + T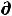 S –Р
S –Р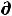 V = 0 , откуда Р
V = 0 , откуда Р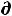 V = -
V = - 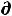 U+ T
U+ T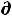 S, (57)
S, (57)
а значит
A = – Р V – S T |
(58) |
Следовательно,
(59)
(60)
4) Энергия Гиббса
При T = const уравнение δА'max = -  U + T
U + T S – Р
S – Р V примет вид
V примет вид
17
δА'max = - (U - TS +РV) = - GР,T или -∆GР,T= А'max |
(61) |
где G = U - TS + РV = H – TS = A + РV - энергия Гиббса или свободная энтальпия – новая функция состояния – изобарно-изотермический потенциал (чаще называемый изобарный потенциал).
Изменение изобарного потенциала:
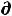 G =
G =  U – T
U – T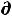 S – S
S – S T + Р
T + Р V + V
V + V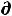 Р (62)
Р (62)
При условии, когда отсутствует механическая работа (δА'=0)
δА'max = - 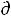 U + T
U + T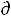 S – Р
S – Р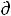 V = 0 , а значит
V = 0 , а значит 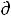 G = - S
G = - S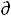 T + V
T + V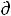 Р
Р
Следовательно,
(63)
= -S (64)
Таким образом, и энергия Гельмгольца, и энергия Гиббса являются характеристическими функциями и через их производные выражаются термодинамические свойства системы.
Зависимость термодинамических потенциалов от их переменных описывается основным уравнением объединяющим первый и второй законы термодинамики. Это уравнение можно записать в четырех эквивалентных формах:
U =T S – Р V, |
(65) |
H = T S + V Р, |
(66) |
A= –Р V– S T, |
(67) |
G = –S T + V Р |
(68) |
(только для закрытых систем, в которых совершается только механическая работа расширения).
Процессы, которые сопровождаются увеличением термодинамических потенциалов, протекают лишь при совершении работы извне над системой. В химии наиболее часто используется изобарноизотермический потенциал, поскольку большинство химических процессов происходит при постоянном давлении. Для этих процессов величину ΔG можно рассчитать, зная ΔH и ΔS процесса, по уравнению, либо пользуясь таблицами стандартных термодинамических потенциалов образования веществ ΔG°обр; в этом случае ΔG° реакции рассчитывается аналогично Н° по уравнению:
18
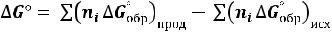
(69)
Величина изменения изобарно-изотермического потенциала в ходе химической реакции ΔG°298 есть мера химического сродства исходных веществ. Основываясь на уравнении можно оценить вклад энтальпийного и энтропийного факторов в величину ΔG и сделать некоторые обобщающие заключения о возможности самопроизвольного протекания химических процессов, основываясь на знаке величин Н и ΔS.
1. Экзотермические реакции; ΔH < 0.
а) Если ΔS > 0, то ΔG всегда отрицательно; экзотермические реакции, сопровождающиеся увеличением энтропии, всегда протекают самопроизвольно.
б) Если ΔS < 0, реакция будет идти самопроизвольно при Н > TΔS (низкая температура).
2. Эндотермические реакции; ΔH > 0.
а) Если ΔS > 0, процесс будет самопроизвольным при Н < TΔS (высокая температура).
б) Если ΔS < 0, то ΔG всегда положительно; самопроизвольное протекание эндотермических реакций, сопровождающихся уменьшением энтропии, невозможно.
1.10. Термодинамика живых систем
Состояние живых систем в любой момент времени (динамическое состояние) характеризуется тем, что элементы системы постоянно разрушаются и восстанавливаются заново. Этот процесс носит название биологического обновления. Для обновления элементов в живых системах требуется постоянный приток извне веществ и энергии, а также вывод во внешнюю среду тепла и продуктов распада. Это означает, что живые системы обязательно должны быть открытыми системами. Благодаря этому в них создается и поддерживается химическое и физическое неравновесие. Именно на этом неравновесии основана работоспособность живой системы, направленная на поддержание высокой упорядоченности своей структуры, а значит, на сохранение жизни, и осуществление различных жизненных функций. Кроме того, живая система, способна достигать состояния стационарности, т.е. стабильности своего неравновесного состояния.
Для живых систем характерна самоорганизация, которую чилийский нейробиолог Умберто Матурана назвал в 1970 г. автопоэз (самосозидание). Живые системы способствуют возникновению неравновесных условий существования окружающей среды.
В изолированной системе (т.е. которая не обменивается с внешней средой веществом и энергией), находящейся в неравновесном состоянии, происходят необратимые процессы, которые стремятся привести систему в равновесное состояние. Переход живой системы в такое состояние означает для нее гибель.
19
В связи с этим весьма важным является вопрос о применимости законов термодинамики к живым системам.
I закон термодинамики. Первый закон термодинамики гласит: изменение энергии системы равно количеству тепла, полученному системой, плюс работа внешних сил, совершенная над системой
E = Q + A |
(70) |
Для адиабатически изолированных (Q = 0, то есть обмена теплом с внешней средой не происходит) и замкнутых (А = 0, то есть внешние силы отсутствуют) систем DE = 0. Последнее утверждение является законом сохранения энергии: при всех изменениях, происходящих в адиабатически изолированных и замкнутых системах полная энергия системы остается постоянной.
Если рассматривать термодинамическую систему, состоящую только из живой системы, то закон сохранения энергии неприменим, так как живая система является открытой. Для термодинамической системы, включающей в себя живую систему и среду, с которой система обменивается энергией и веществом, закон сохранения энергии выполняется. Действительно, как показали опыты, общее количество энергии, которое получает организм за некоторый промежуток времени, вновь обнаруживается впоследствии в виде:
а) выделяемого тепла; б) выделяемых веществах;
в) совершаемой внешней работы; г) теплоты сгорания веществ, синтезированных за этот промежуток
времени за счет энергии, поступившей извне.
II закон термодинамики. Второй закон термодинамики утверждает, что в изолированной термодинамической системе энтропия никогда не может уменьшаться. Она равна нулю при обратимых процессах и может только увеличиваться при необратимых процессах, то есть dS > 0. Переход системы из неравновесного состояния в равновесное необратим, поэтому также dS > 0.
Есть также определенная связь между упорядоченностью системы и информацией (большая упорядоченность соответствует большему количеству информации). Например, увеличение энтропии соответствует переходу системы из более упорядоченного в менее упорядоченное состояние. Такой переход сопровождается уменьшением информации, содержащейся в структуре системы.
Вспомним физический смысл энтропии. Все процессы, самопроизвольно протекающие в природе, необратимы и способствуют переходу системы в равновесное состояние, которое всегда характеризуется тем, что:
а) в процессе этого перехода всегда безвозвратно выделяется некоторая энергия и для совершения полезной работы она использована быть не может;
20
