
УПП Физическая химия 260800.62
.pdf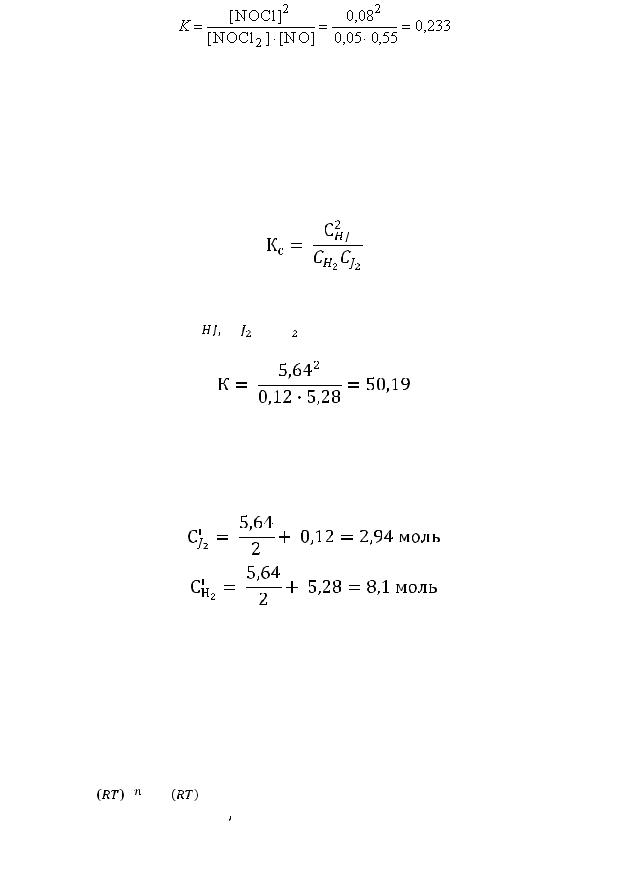
каждой из концентраций должно быть возведено в степень, равную стехиометрическому коэффициенту перед соответствующим веществом в уравнении реакции. Поэтому
Пример 2. При нагревании водорода и иода в замкнутом сосуде до 444 протекает реакция Н2 + J2 = 2HJ.
протекает реакция Н2 + J2 = 2HJ.
Равновесная смесь при этой температуре содержит 5,64 моль иодистого водорода, 0,12 моль иода и 5,28 моль водорода. вычислить константу равновесия указанной реакции и исходные концентрации водорода и иода.
Решение: Согласно соотношению
Так как данная реакция идет без изменения объема, то значение константы будет одинаково при всех способах выражения концентраций. Вместо концентраций 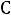
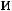
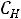 можно подставить числа молей этих веществ
можно подставить числа молей этих веществ
Определяем исходные концентрации иода и водорода. Для образования 2 моль HJ расходуется 1 моль Н2 и 1 моль J2. К моменту достижения равновесия в смеси образовалось 5,64 моль HJ. Прореагирует 5,64/2 моль Н2 и J2. Учитывая равновесные концентрации Н2 и J2 находим концентрации этих веществ:
Пример 3. Константа равновесия КР реакции синтеза аммиака N2 + 3H2 
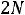
 при 350
при 350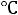 равна 2,32·10-13. Вычислить значение Кс для этого процесса при той же температуре.
равна 2,32·10-13. Вычислить значение Кс для этого процесса при той же температуре.
Решение: Определим 
 по формуле КР = Кс
по формуле КР = Кс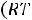
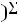
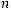
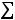
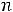
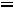
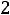



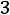
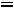

 /
/
Следовательно,
Кс = 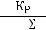
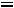
 =
= 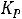

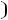
T = 350+273 = 623 R = 8,314·103 Дж/кмоль·град.,
R = 8,314·103 Дж/кмоль·град.,
Кс = 2,32·10-13(8,314·103·623)2 = 6,224.
101

Тема 4. Фазовое равновесие
Пример 1. Вычислить давление, необходимое для понижения температуры замерзания воды на 1о, и температуру, при которой будет плавиться лед при повышении давления на 1 атм. При 0оС удельная теплота плавления льда равна 333,5 103 Дж/кг, плотность воды 0,9998 103 кг/м3, плотность льда 0,9168 103 кг/м3.
Решение: Используем уравнение Клапейрона для фазовых превращений в однокомпонентных системах:
где P/ Т – изменение давления фазового превращения при изменении температуры на 1 градус; L – удельная теплота фазового превращения при температуре Т; V = (Vж – Vтв) – изменение удельного объема при фазовом переходе.
Удельные объемы – величины обратные плотности, следовательно:
Vж=1/9,998 102=1,0002 10–3 м3/кг;
Vтв=1/9,168 102=1,0908 10–3 м3/кг;
и V=1,0002 10–3 – 1,0908 10–3 = –9,06 10–5 м3/кг;

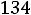


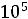 Па/К
Па/К
Знак «минус» указывает на то, что для уменьшения температуры кристаллизации воды (или плавления льда) давление должно быть повышено. Следовательно, для понижения температуры замерзания воды на 1оС необходимо давление повысить на 134,8·105 Па (или 133 атм), т.е. довести его до 134 атм.
Изменение температуры фазового перехода при изменении давления на единицу найдем с помощью преобразования уравнения:
или
Следовательно, при повышении давления на 1 атм температура плавления льда уменьшается на 0,0075К и становится равной 0,0075оС.
Пример 2. При сплавлении солей KCl и NaNO3 возможна реакция
KCl + NaNO3 ↔ КNO3 + NaCl
Определить число степеней свободы, если жидкий расплав находиться в равновесии с кристаллами NaNO3.
Решение: Число независимых компонентов находим по разности: число составных частей системы минус число химических реакций,
протекающих в данной системе при данных условиях К 4-1=3.
102

Ф = 2 (жидкий расплав и кристаллы NaNO3).
Соли KCl, КNO3, NaCl и NaNO3 нелетучи, поэтому можно считать систему конденсированной. используем уравнение правила фаз С = К + 1 - Ф = 3+1-2=2.
Система двухвариантна.
Тема 5. Растворы
Пример 1. Техническая уксусная кислота замерзает при 16,4°С. Температура замерзания уксусной кислоты 16,7°С, ее криоскопическая постоянная равна 3,9. Определите молярную концентрацию примесей в технической уксусной кислоте.
Решение:

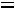
 =
=  = 0,08 моль/1000 г.
= 0,08 моль/1000 г.
Молярная концентрация в уксусной кислоте составляет 0,08 моль/л.
Пример 2. Раствор, содержащий 0,8718 моль/л тростникового сахара, при Т = 291К, изотоничен с раствором хлорида натрия, содержащим 0,5 моль/л NaCl. Рассчитайте: а) изотонический и осмотический коэффициенты для хлорида натрия; б) кажущуюся степень его диссоциации.
Решение: а) Для раствора сахара осмотическое давление рассчитывается по уравнению Вант-Гоффа для неэлектролитов: 1 = С1RT; а
для раствора NaCl по уравнению для электролитов: 2 = iC2RT, где i изотонический коэффициент. Так как осмотические давления растворов
равны, т.е. 1 = 2, и значит С1RT = iC2RT.
Отсюда i = С1/С2 = 0,8718/0,5 = 1,7436.
По величине изотонического коэффициента рассчитываем осмотический коэффициент g:
g = i/ = 1,7436/2 = 0,8718,
где – число ионов, образующихся при диссоциации одной молекулы.
б) Кажущуюся степень диссоциации вычисляем с помощью уравнения, связавющего ее с изотоническим коэффициентом:
i = 1 + ( –1); Отсюда = (i –1)/( –1) = (1,7436 –1)/(2 –1) = 0,7436.
Пример 3. В 100 г воды растворено 1,53 г глицерина. Давление пара воды при 298 К равно 3167,2 Н/м2. Вычислите: а) понижение давления пара воды над раствором; б) температуру кипения раствора; в) температуру его замерзания; г) его осмотическое давление.
Решение: а) В соответствии с законом Рауля относительное понижение давления равновесного с раствором пара равно:
103

где Хгл – мольная доля глицерина в растворе.
Хгл =
где n – количество вещества (моль).
nводы = 100/18 = 5,555 моль; nгл = 1,53/92 = 0,017 моль;
Значит, Хгл= 0,017/(0,017 + 5,555) = 0,003, тогда р/3167,2 = 0,03; Р = 95,02
Па.
б) Повышение температуры кипения раствора неэлектролита можно вычислить по эбуллиоскопической формуле:
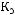
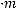
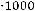 ,
,
где Кэ – эбуллиоскопическая константа растворителя (для воды она равна 0,52); m – масса растворенного вещества в граммах; М – его молярная масса; а – масса растворителя в граммах. Отсюда
Следовательно, температура кипения раствора будет равна 100,090С.
в) Понижение (депрессия) температуры замерзания раствора рассчитывается по криоскопической формуле:
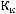
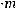
 ,
,
где Кк криоскопическая константа растворителя (для воды 1,86):
Следовательно, раствор будет замерзать при –0,31оС.
г) в соответствии с законом Вант–Гоффа осмотическое давление в растворах неэлектролитов можно рассчитать по уравнению
= CRT,
где С – молярная концентрация раствора.
При пересчете в систему СИ концентрация должна быть выражена в моль/м3. Считая плотность раствора равной плотности воды, получим:
С = 
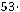
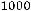
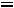 0,17 моль/л = 0,17·103 моль/м3
0,17 моль/л = 0,17·103 моль/м3
Тогда
= 0,17 103·8,314·298 = 421187,2 Па ( 4,2 атм).
Тема 6. Электрохимия
Пример 1. Удельная электрическая проводимость 0,05 М раствора роданида аммония равна 0,572·10-2 См/см. Рассчитайте степень диссоциации соли.
Решение: 1.Рассчитываем молярную электрическую проводимость по уравнению:
104

λ= 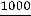 ĸ
ĸ

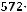
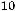 =114,4 См·см2/ моль.
=114,4 См·см2/ моль.
2.По справочнику находим значения подвижностей ионов и рассчитываем λ∞ по уравнению:
λ∞ =
 +
+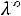
 =73,5+66,4=139,9 См·см2/моль
=73,5+66,4=139,9 См·см2/моль
3.Степень диссоциации роданида аммония рассчитываем по уравнению:
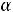
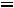
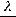 =
=

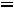
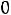
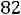
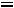

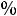 .
.
Пример 2. Молярная электрическая проводимость 0,02 М раствора уксусной кислоты равна 12,77 См·см2/моль. Вычислите константу диссоциации и pH этого раствора
Решение:
1.Согласно справочным данным при 25˚С предельная молярная электрическая проводимость уксусной кислоты составит:
λ∞=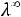
 +
+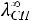
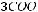

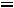
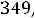
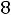
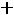
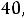
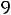
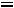
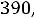
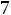
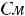

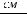 2. Рассчитаем степень диссоциации уксусной кислоты по уравнению:
2. Рассчитаем степень диссоциации уксусной кислоты по уравнению:
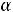
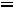
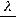 =
=
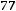 =0,033 3. Рассчитаем константу диссоциации уксусной кислоты по уравнению:
=0,033 3. Рассчитаем константу диссоциации уксусной кислоты по уравнению:
К=
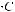 =
=
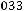
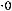
 =1,7·10-5.
=1,7·10-5.
4.Так как уксусная кислота является слабым электролитом, то концентрация ионов водорода, полученных в результате электролитической диссоциации кислоты, будет равна:
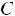
 =λ·Ск-ты=0,033·0,015=4,95·10-4=моль/л
=λ·Ск-ты=0,033·0,015=4,95·10-4=моль/л
5. Рассчитаем рН раствора уксусной кислоты:
рН = -lg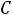

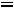


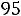

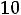

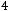
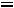
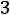
 .
.
Пример 3. Вычислите при 298 К значение ЭДС следующего элемента: (-)Zn/ZnCl2(aq)//CdCl2(aq)/Cd(+). Стандартные электродные потенциалы Cd2+/CdиZn2+/Znсоответственно равны : -0,402 и -0,763 В. Концентрации растворов составляют : СZnCl2=0,005 M ; CCdCl2=2,0 M. Средние коэффициенты активности равны: 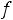
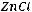 =0.789 ;
=0.789 ; 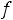
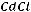 =0,044
=0,044
Решение: Имеем гальванический элемент, составленный из двух разных электродов первого рода. Так как стандартный электродный потенциал кадмиевого электрода более положительный, чем стандартный электродный потенциал электрода, то на электродах будут протекать
реакции:
(+) Cd2+ + 2ē = Cd0 ;
(-) Zn0- 2ē = Zn2+;илиZn0=Zn2++2ē
Суммарная реакция, протекающая при работе элемента:
Zn0+Cd2+=Zn2++Cd
За счет протекания этой реакции возникает ЭДС, которая зависит от активностей компонентов следующим образом:
105

E= |
- |
+ |
|
lg |
|
= -0,402-(-0,763)+ |
|
lg |
|
=0,400 В, |
|
|
|
|
|||||||
где α±=v±f±c; |
|
= |
|
=(11·22)1/3=1,59. |
|
|
|
|
||
|
|
Тема 7. Химическая кинетика |
|
|||||||
Пример 1. Период полураспада некоторого вещества составляет 9,93 мин. Рассчитайте, сколько процентов этого вещества разложиться за 1 час.
Решение: 1) Разложение – реакция первого порядка: A→продукты. 2) Из уравнения t1/2 =  , отсюда:
, отсюда:
K=

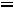

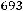
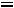

 -1.
-1.
3) Пусть начальная концентрация вещества составляла 100%.Запишем уравнение для расчета константы скорости реакции первого порядка:
k = |
|
ln |
|
|
|
ln |
|
|
|
= 0, 07 мин-1 |
|
||||||||||
|
|
|
|
|
|
4) Решим это уравнение относительно x:
Х=98,48%
Пример 2. При получении кинетики реакция первого порядка были получены следующие данные:
Время, мин |
|
|
|
|
|
0 |
15 |
30 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
Концентрация исходного вещества, моль/л. |
0,20 |
0,08 |
0,03 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рассчитайте константу скорости. |
|
|
|
||||||
|
|
Решение: Проводим расчет значений констант скоростей при всех |
|||||||||
временах, отличных от нуля по уравнению: |
|
|
|
||||||||
K1 |
|
ln |
|
= 0,061мин-1 ; k2= |
|
ln |
|
|
-1 |
|
|
|
|
|
|
|
|
|
|||||
Равенство значений констант скоростей при разных значениях времени подтверждается то, что данная реакция является реакцией первого порядка. Рассчитываем среднее значение константы скорости реакции:
kcр =0,062мин -1.
Пример 3. Рассчитайте время разрушения аэрозольного препарата «Камфомен» на 10%, считая константу скорости разложения основного действующего вещества (фурацилина) равной 1,210–5 час–1 при 20oС.
Решение: Считая исходное количество вещества равным 100%, и используя кинетическое уравнение для реакции 1-го порядка
k = 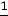 ln
ln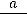
получим:
t = 

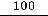

 = 8775 часов ≈ 1 год.
= 8775 часов ≈ 1 год.
106
Тесты
1. Если температурный коэффициент химической реакции равен 2, то при повышении температуры от 20°С до 50°С скорость реакции….
1.уменьшается в 2 раза
2.уменьшается в 4 раза
3.увеличивается в 8 раз
4.увеличивается в 6 раз
2. Раствор, содержащий 11,6 г вещества в 400 г воды, замерзает при
|
|
|
1,86 |
град кг |
|
температуре -0,93°С. К |
Н О |
|
. Молярная масса растворенного |
||
|
|||||
|
|
2 |
|
моль |
|
|
|
|
|
|
|
вещества равна…. |
|
|
|
|
|
1. |
116 г/моль |
|
|
|
|
2. |
87 г/моль |
|
|
|
|
3. |
29 г/моль |
|
|
|
|
4. |
58 г/моль |
|
|
|
|
3. Если энтальпия образования SO2 равна -297 кДж/моль, тогда количество теплоты, выделяемое при сгорании 16 г серы, равно…
1.74,25 кДж
2.297 кДж
3.594 кДж
4.148,5 кДж
4. Осмотическое давление раствора, содержащего 45г глюкозы в 200 мл раствора при 298 К равно….кПа
1.6120
2.1548
3.3095
4.4643
5. В основе потенциометрического метода анализа лежит уравнение….
1.Нернста
2.Фарадея
3.Ламберта-Бугера-Бера
4.Гиббса
6. рН раствора, в 1 литре которого содержится 0,2 моль гидроксида аммония
(Kb=1,8·10-5), равен…
1.10,7
2.2,7
3.3,3
4.11,3
7. Рефрактометрия – это
а) Измерение концентрации вещества; б) Измерение, основанное на определении показателя преломления;
107
в) Измерение электропроводности.
8.Показатель преломления вещества зависит от: а) окраски вещества; б) температуры жидкости;
в) концентрации раствора.
9.Рефрактометр относится к разряду
а) оптических приборов; б) физических приборов;
в) измерительных приборов.
10.Калориметр – это прибор для определения а) протекания реакции; б) теплоты растворения; в) определения калорий.
11.При растворении поваренной соли энтальпия системы
а) повышается; б) понижается; в) не изменяется.
12.Применение соляной кислоты во время протекания реакции омыления этилацетата определяется:
а) Созданием определенной кислотности среды; б) Еѐ каталитической активностью;
в) тем, что она является одним из исходных веществ.
13.Гомогенный катализ – это
а) применение жидкого катализатора; б) применение твердого катализатора;
в) применение катализатора, соответствующего фазе исходных веществ.
14. Порядок реакции определяется а) числом молекул исходного вещества; б) числом образовавшихся молекул;
в) исходной концентрацией вещества.
15.Скорость реакции зависит от а) состояния исходного вещества; б) только от катализатора; в) концентрации и давления.
16.Инверсия - это:
а) Разложение сложного вещества на простые; б) Каталитическая реакция; в) реакция нейтрализации.
17. Отметьте неправильные утверждения, если они есть, среди следующих:
108
а) Закрытая система не может обмениваться энергией с окружающей средой. б) Плотность вещества является интенсивной величиной.
в) Человек, с точки зрения термодинамики, является открытой системой. г) Гомогенная система должна быть чистым веществом.
д) Система, содержащая только одно вещество, является гомогенной.
18. Среди следующих величин, отметьте экстенсивные: а) температура, б) давление, в) объѐм,
г) концентрация, д) теплоѐмкость,
е) напряженность электрического поля, ж) вязкость, з) молярная энтальпия.
19. Отметьте неправильные утверждения, если они есть, среди следующих:
а) Работа обратимого изменения объѐма закрытой системы всегда равна рV, б) В уравнении 1-ого закона U = q + w символ w означает работу окружающей среды над системой.
в) Чтобы вычислить работу любого процесса изменения объѐма, достаточно знать начальное и конечное состояния процесса.
г) Уравнение w = –pdV справедливо только для изобарного процесса.
20. Назовите неправильные утверждения среди следующих:
а) В закрытой системе S не может быть отрицательной величиной б) В обратимом процессе в закрытой системе должно быть S = 0. в) В любом процессе в изолированной системе не возможно S 0. г) В адиабатическом процессе в закрытой системе всегда S = 0.
д) В любом самопроизвольном процессе S 0.
21. Какое из следующих утверждений является правильным:
а) Величины U, H, A и G – все имеют размерность.
б) Выражение G = H – ТS справедливо для любых процессов. в) Выражение G = А + рV справедливо для любых состояний.
г) При 0 °С и р = 1 атм энергия Гиббса воды больше, чем энергия Гиббса того же количества льда.
22. Отметьте неправильные утверждения, если они есть, среди следующих: а) Когда экзотермическая химическая реакция происходит в закрытой изохорной адиабатической системе, rU = 0.
б) Если вещество в стандартном состоянии, его температура равна 25 °С в) Когда экзотермическая химическая реакция протекает в изолированной системе, Т 0.
г) Когда экзотермическая химическая реакция протекает в изотермической системе (в термостате), теплота меньше нуля.
109
23. Увеличивается или уменьшается энтропия в следующих реакциях, и в какой из них изменение больше по абсолютной величине?
а) Н2 (г) + О2 (г) Н2О2 (ж) б) 2Н2 (г) + О2 (г) 2Н2О (ж)
24. Отметьте неправильные утверждения, если они есть, среди следующих: а) Когда сахароза сжигается в адиабатическом изохорном калориметре, U = 0.
б) В реакции N2 (г) + 3H2 (г) 2NH3 (г) rН rU. при одной и той же температуре.
в) Увеличение стехиометрических коэффициентов реакции в 2 раза увеличивает молярную энтальпию реакции в 2 раза.
25. Какое из следующих веществ имеет наибольшую, а какое – наименьшую молярную энтропию при одной и той же температуре:
а) СН2Cl2 (г)
б) СНCl3 (г) в) СН3Cl (г)
26. Выберите правильные утверждения из следующих:
а) Стандартное состояние вещества – состояние с наибольшей термодинамической устойчивостью б) Стандартное состояние компонента газовой смеси – состояние того же газа в чистом виде
в) Стандартное состояние любого вещества – состояние с определенными значениями Т и р.
27. Отметьте неправильные утверждения, если они есть, среди следующих: а) Так как тремя возможными фазами являются твердая жидкпя и газовая, то по правилу фаз Гиббса максимальное число фаз равно 3.
б) Число степеней свободы F – число интенсивных переменных, необходимых для определѐнности термодинамического состояния.
в) по правилу фаз, минимальное возможное число фаз равно 1.
28. Какие из следующих утверждений неправильны?:
а) Нормальная точка кипения – это температура, при которой давление пара жидкости равно 1 атм.
б) В критической точке чистого вещества плотности пара и жидкости равны. в) Нормальная температура кипения чистой воды равна 100 °С точно.
г) Вдоль любой кривой на фазовой диаграмме однокомпонентного вещества число степеней свободы равно 1.
д) Диоксид углерода не имеет нормальной точки кипения.
29. Какие из следующих утверждений правильны?:
а) Уравнение 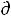 lnР/
lnР/ T H/RT2 не применимо к равновесиям твердое/газ.
T H/RT2 не применимо к равновесиям твердое/газ.
б) Уравнение 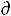 lnР/
lnР/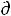 T H/RT2 не применимо к равновесиям твердое/жидкость.
T H/RT2 не применимо к равновесиям твердое/жидкость.
в) Уравнение 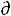 lnР/dT H/RT2 не применимо к равновесиям в тройной точке.
lnР/dT H/RT2 не применимо к равновесиям в тройной точке.
110
