
УПП Физическая химия 260800.62
.pdf
2.4.1 Поляризация и межмолекулярные взаимодействия
Рефрактометрические и поляризационные исследования жидкостей позволяют определить диэлектрические свойства молекул (дипольный момент и поляризуемость) от которых во многом зависят важнейшие технологические свойства веществ (рефракционная способность, межмолекулярное взаимодействие, растворимость в различных средах и т.д.).
Все молекулы делятся на полярные и неполярные. У полярных молекул электрические заряды распределены неравномерно. При равенстве положительного и отрицательного зарядов 
 ,
,  находящихся друг от друга на расстоянии l, молекула становится диполем.
находящихся друг от друга на расстоянии l, молекула становится диполем.
У некоторых молекул подобное расположение зарядов отсутствует. Дипольный момент µ, характеризующий полярность молекулы,
является векторной величиной, равной произведению величины заряда q и расстояния l:
(78)
 - Кл
- Кл
 или Д (дебай).
или Д (дебай).
Различают дипольные моменты молекул и связей. Для двухатомных молекул они совпадают. Если дипольный момент не равен нулю, молекулы и химические связи называются полярными, например HCl, NO, KJ и др.
Чем больше µ, тем выше поляризованность молекул и химических связей. Если двухатомные молекулы состоят из одинаковых атомов (Cl2, N2,O2 и др.), то такие молекулы и их химические связи неполярны, а дипольный момент равен нулю.
Дипольные моменты многоатомных молекул определяются дипольными моментами химических связей и их относительным расположением.
В качестве примера хотелось бы привести молекулу диоксида углерода СО2, имеющую следующую структурную формулу:
q- |
q+ |
q- |
О  С
С  О
О
-  = 2,7 D - 2,7 D = 0
= 2,7 D - 2,7 D = 0
Большинство молекул неорганических и органических соединений являются полярными. Для симметричных молекул углеводородов (С6Н6) характерна компенсация дипольных моментов химических связей. Связь С-Н является слабо полярной, т.к. ее дипольный момент равен всего 0,12 D.
Органические соединения имеют полярные группы, полярность которых вызвана смещением орбит электронов в:
31

O
Карбиде  -C
-C
O
Альдегиде R-C
H
Спиртовых группах R - OH Пептидных связях R1 - C - N - R2
При диссоциации в воде неиногенных карбоксильных аминогрупп возникают заряды, усиливающие их полярность.
Полярная структура молекул оказывает влияние на многие свойства и является причиной межмолекулярных (Ван-дер-Ваальсовских) взаимодействий, не приводящих к разрыву или образованию новых химических связей. Величина межмолекулярного взаимодействия зависит от природы молекул (дипольного момента и поляризуемости), расстояния между ними и их энергии.
Специфической формой межмолекулярного взаимодействия является образование водородной связи, возникающей в ассоциированных жидкостях (вода, спирт, карбоновые кислоты). Исключительно большое значение водородная связь играет в формировании структур белков и ДНК.
В растворах могут возникать междипольные и ион-дипольные взаимодействия, приводящие к образованию сольватных или гидратных слоев.
Поляризация – это смещение электронов и (или) атомов, а также ориентация молекул под действием внешнего электрического поля.
Поляризация (П) складывается из ориентационной (Пор) и деформационной (Пдеф) поляризации
П = Пор + Пдеф = Пор + Пат + Пэл (79)
В основе всех видов поляризации лежат электростатические взаимодействия разноименных зарядов, одни из которых принадлежат молекуле вещества, а другие инициируются внешним полем. Способность молекулы к деформации под действием постоянного внешнего электрического поля (Е) называется поляризуемостью (α).
|
|
(80) |
|
|
|
||
(81) |
|
||
Поляризуемость молекул равна сумме атомной ( |
) и электронной |
||
( ) поляризуемостей |
|
||
|
|
|
32 |

(82)
Поляризуемость и поляризация характеризуют микросостояние вещества, а диэлектрическая проницаемость - его макросостояние.
Размерность α – м3 а еѐ порядок равен 10-30 м3.
Уравнение Клаузиуса-Моссоти отражает связь между ε, α, Пдеф:
(83)
где М - молекулярная масса веществ; ρ - его плотность;  - мольный объем
- мольный объем
вещества.
2.4.2. Рефракция
Поляризация вещества может происходить и под действием переменного электрического поля, определяющую роль при этом играет частота колебаний (см. рис.4).
ε, П
|
|
|
|
|
|
107 |
1011 |
|
1015 |
V, c-1 |
|
|
|||||
|
|||||
|
|
|
|
|
|
Рис.4. Зависимости диэлектрической проницаемости и поляризации от частоты внешнего переменного поля.
Как следует из рис. 4, при частоте колебаний 



 (частоте видимого света) в веществе сохраняется только электронная поляризация (Пэл), которая определяется показателем преломления n, связанным с ε следующим выражением:
(частоте видимого света) в веществе сохраняется только электронная поляризация (Пэл), которая определяется показателем преломления n, связанным с ε следующим выражением:
(84)
где  - показатель преломления света при
- показатель преломления света при 
Преломление света характеризуется не только параметром n, но и молярной рефракцией - RM , то есть изменением направления световых волн при изменении показателя преломления среды, которую рассчитывают исходя из уравнения Лорентца-Лоренца:
(85)
33

где  и RM имеют одинаковую размерность - м3/моль , и не зависят от агрегатного состояния вещества и температуры.
и RM имеют одинаковую размерность - м3/моль , и не зависят от агрегатного состояния вещества и температуры.
Показатель преломления (n) является константой не только индивидуальных химически чистых веществ, но и различных растворов или жидких пищевых продуктов (меда, молочной сыворотки, бульона, растительных масел и т.д.) и легко определяется на рефрактометрах различной конструкции. В таблице 4 представлены показатели преломления некоторых веществ и пищевых продуктов.
|
|
|
|
Таблица 4. |
|
Показатели преломления некоторых веществ и пищевых продуктов |
|||||
|
|
|
|
|
|
Вещество |
Льняное масло |
Подсолнечное |
Глицерин |
Этанол |
|
масло |
|||||
|
|
|
|
||
|
|
|
|
|
|
Показатель |
1,485 |
1,470 |
1,3437 |
1,361 |
|
преломления, n |
|
|
|
|
|
|
|
|
|
|
|
Для индивидуальных веществ или смеси различных веществ, процентный состав которых известен, молярную рефракцию можно рассчитать также по правилу аддитивности, которая равна сумме молярных рефракций всех молекул, входящих в состав одного моля вещества. Двойные, тройные связи, а также напряженные циклы, образованные за счет π-связей с легко подвижными электронами, увеличивают поляризацию и молярную рефракцию исследуемых соединений.
(86)
где m, n, k - число атомов, кратных связей, циклов; R - рефракции.
Значения рефракций атомов и связей представлены в таблице 5.
|
|
Таблица 5. |
Значения рефракций атомов и связей |
|
|
|
|
|
Атомы, кратные связи и циклы |
Рефракция |
, см3/моль |
|
|
|
С |
2,4 |
|
|
|
|
Н |
1,1 |
|
|
|
|
СООН - карбонильный |
1,64 |
|
|
|
|
ОН - гидроксильный |
1,52 |
|
|
|
|
С=С |
1,73 |
|
|
|
|
С≡С |
2,4 |
|
|
|
|
СН2 |
4,6 |
|
|
|
|
N - первичный амин |
2,3 |
|
|
|
|
|
|
34 |

N - вторичный амин |
2,5 |
|
|
N - третичный амин |
2,8 |
|
|
N - ароматический амин |
3,0 |
|
|
N - нитрильный амин |
3,1 |
|
|
Cl |
1,0 |
|
|
2.4.3. Парахор
Поверхностное натяжение жидкости, как и любого вещества или продукта есть константа, линейно изменяемая с изменением температуры. С позиции термодинамики поверхностное натяжение ζ определяется силами межмолекулярного взаимодействия и обусловлено неравнозначностью этих сил в поверхностном слое и в объеме фазы вещества. Для жидкостей существует следующая зависимость между поверхностным натяжением и плотностью жидкости, находящейся в равновесии со своим паром.
|
|
4 - уравнение Бачинского, |
(87) |
|
|
||
где С - константа, зависящая от свойств вещества, ζ - поверхностное |
|||
натяжение дин/см, |
|
- плотности вещества в жидкой и газообразной |
|
формах; 

 Плотность является одной из важнейших характеристик жидкостей.
Плотность является одной из важнейших характеристик жидкостей.
Плотность жидкости 
 называется масса единицы объема жидкости, (кг/см3, г/см3). Плотность жидкостей зависит от температуры, что выражается уравнением Менделеева:
называется масса единицы объема жидкости, (кг/см3, г/см3). Плотность жидкостей зависит от температуры, что выражается уравнением Менделеева:
(88)
где 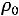
 - плотности жидкости при 0°С и при определяемой температуре t; β - коэффициент объемного расширения жидкости.
- плотности жидкости при 0°С и при определяемой температуре t; β - коэффициент объемного расширения жидкости.
Для органических жидкостей β в 2-5 раз больше, чем для воды. Плотность растворов является функцией концентрации. Эта
зависимость является линейной только в тех случаях, когда происходит смешение компонентов без изменении объема раствора, что встречается очень редко.
Наиболее распространенным методом определения поверхностного натяжения жидкостей является манометрический метод Ребиндера:
= |
|
, |
(89) |
|
где 


 - поверхностное натяжение исследуемой и эталонной жидкостей, Рх и Р Н2О - давление в манометре, создаваемые ими.
- поверхностное натяжение исследуемой и эталонной жидкостей, Рх и Р Н2О - давление в манометре, создаваемые ими.
При преобразовании уравнения с учетом молекулярной массы исследуемого вещества, получается следующее выражение
35

(90)
Парахор (Р) – молекулярная константа вещества, не зависящая от температуры, имеющая размерность см3/моль и обладающая свойством аддитивности.
Поверхностное натяжение линейно уменьшается с ростом температуры и при достижении Ткр становится равным нулю. Вблизи Ткр при ζ = 1 дин/см молекулы любого вещества занимают строго фиксированные объемы, соответствующие их структурным формулам (табл. 6).
|
Таблица 6. |
Значения парахоров атомов и связей |
|
|
|
Атомы, кратные связи и циклы |
Парахор Р, см3/моль |
|
|
H |
17,1 |
|
|
C |
4,8 |
|
|
СН2 |
40,0 |
|
|
Cl |
54,3 |
|
|
N |
12,5 |
|
|
P |
37,7 |
|
|
S |
48,2 |
|
|
O-гидроксильный |
13,7 |
|
|
СООНкарбонильный |
20 |
|
|
С=С |
23,2 |
|
|
С≡С |
46,6 |
|
|
С6Н6 |
6,1(-0,15) |
|
|
2.4.4. Вязкость
Одним из важнейших свойств жидкостей, имеющих большое теоретической значение, является их внутреннее трение, или вязкость.
Сила трения F между слоями жидкости пропорциональна площади
соприкосновения слоев S и градиенту скорости |
|
(уравнение Ньютона) |
||
|
||||
F = |
|
|
(91) |
|
|
||||
Коэффициент пропорциональности η называется коэффициентом вязкости жидкости или ее абсолютной вязкостью.
Практически все мономолекулярные чистые жидкости и ряд истинных растворов подчиняются уравнению Ньютона.
36

В системе СИ коэффициент вязкости имеет размерность Н·с/м2 (103 сантипуаз). Вязкость воды при 20°С и 1 атм. равна одному сантипуазу (точнее 1,0057 спз.).
Вязкость жидкостей уменьшается с повышением температуры. При нагревании ассоциированных жидкостей уменьшается также ассоциация молекул. При понижении температуры вязкость увеличивается; некоторые жидкости (например, смолы) при этом теряют текучесть настолько, что приобретают прочность твердых тел.
Текучестью φ называется величина, обратная вязкости
(92)
Зависимость текучести от температуры выражается уравнением Аррениуса:
= А |
|
|
(93) |
|||
|
|
|||||
|
|
= |
|
|
(94) |
|
|
|
|
||||
где Е - энергия активации вязкостного потока, то есть та минимальная энергия, которой должна обладать молекула, чтобы при колебательном движении вблизи равновесного положения оторваться от ближайших молекул и перейти в соседний слой.
Пользуясь методом измерения вязкости, можно определить молекулярную массу растворенного вещества, дипольный момент молекулы, степень ассоциации молекул и другие величины, характеризующие физикохимические свойства жидкостей.
По формуле Дунстана и Толе молекулярная масса вещества связана с вязкостью
(95)
где Моп - молекулярная масса вещества, выражается в пуазах.
Найденную таким образом молекулярную массу называют
«опытной»- Моп.
Если жидкость ассоциирована, то Моп - средняя «молекулярная масса» ассоциата, состоящего из n молекул. Степень ассоциации 
 определяется по формуле:
определяется по формуле:
(96)
Для ламинарного потока справедлив закон Пуазейля, согласно которому можно вычислить вязкость жидкости, протекающей через капилляр:
(97)
37

где r - радиус капилляра, l –длина капилляра; V - объем вытекающей жидкости; P - давление, под которым вытекает жидкость; t - время истечения данного объема жидкости;  - абсолютная вязкость.
- абсолютная вязкость.
Относительную вязкость жидкостей рассчитывают чаще всего, сравнивая вязкость исследуемой жидкости с вязкостью воды. Вязкость воды известна точно в широком интервале температур
(98)
где - |
вязкость воды, |
и |
- время протекания воды и |
исследуемой жидкости через капилляр.
Приборы для измерения вязкости называются вискозиметрами.
2.4.5. Молекулярные спектры
Молекулярная спектроскопия является современным наиболее информативным методом исследования веществ, и жидкостей в том числе.
В основе молекулярной спектроскопии лежит способность молекул избирательно поглощать и испускать электромагнитное излучение, что отражают измеряемые спектры. Спектральный анализ позволяет определить не только энергетические (энергию образования молекул и ее отдельных связей), диэлектрические (дипольный момент, поляризуемость), но и геометрические параметры (форму, размеры, расстояние между отдельными атомами), а также многие другие параметры молекул.
Молекулы и атомы избирательно поглощают, излучают и рассеивают электромагнитные волны, что выражается в спектральном изображении (рис.
5).
Спектр показывает количественное распределение электромагнитного излучения исследуемого вещества в зависимости от длины волн (рис.5б) или частоты.
Каждая линия спектра отвечает определенному состоянию атомов или молекул и количественно характеризует их энергетическое состояние.
Спектры классифицируются по следующим характеристикам:
-по процессам поглощения, испускания и рассеяния в определенной области внешнего электромагнитного излучения на спектры инфракрасные (ИК), ультрафиолетовые (УФ), видимого света и т.д.;
-по характеру вызываемых переходов на электронные, колебательные
ивращательные спектры;
-по характеру исследуемых веществ и смесей веществ на атомные, молекулярные спектры.
Молекулярные спектры гораздо сложнее атомных, так как молекулы могут испытывать не только колебательные переходы атомов и связей, но и вращательные колебания отдельных частей молекулы и ее самой в пространстве.
При поглощении или испускании кванта энергии (hv) молекула переходит с одного энергетического состояния (Е1) на другое (Е2):
38

(99)
Энергетическое состояние молекулы определяется ее электронным, колебательным- и вращательнымсостоянием.
Е = Еэл + Екол + Евр |
(100) |
при этом Еэл 
 Екол и Евр или приблизительно можно считать, что
Екол и Евр или приблизительно можно считать, что
Екол : Екол: Евр = 104 :102 : 1
1) a) |
б) |
λ
2) а)
Io
Iи |
λ |
3) а)
Io
Io
λ
Рис.5. Типы воздействия электромагнитного излучения и наблюдаемый спектр: 1) спектры поглощения; 2) спектры испускания (эмиссионные); 3) спектры рассеивания.
Молекулярная спектроскопия базируется на сравнительно ограниченном диапазоне длин волн и энергий излучения (рис.6.).
39

γ-лучи |
Рентгеновские УФ |
ИФ |
Микроволновые |
В
и
д
и
м
Электронный ы Колебательный
й
Спектр спектр
с
Вращательный спектр
в
е
т
1 |
λ ,нм |
Рис.6. Области электромагнитного спектра.
Вращательные спектры наблюдаются в микроволновой области, когда энергия внешнего излучения незначительна. При помощи вращательных спектров можно определить размеры молекул и расстояние между их атомами, которое соответствует длине химической связи. Этим методом были определены длины связей С-С, С=С, С≡С, которые соответственно равны 0,154; 0,134; 0,120 нм и установлено, что чем короче связь, тем она прочнее. Кроме того, вращательные спектры дают возможность определить дипольный момент, степень симметричности молекулы и ряд других параметров.
Колебательные спектры обусловлены колебаниями атомов в молекуле и могут приводить к ее диссоциации. Энергию диссоциации
молекул (Д) определяют по следующей формуле: Д = Емакс - Е0 = hνmax, где Емакс и Е0 - энергия молекулы на внешнем и основном колебательных
уровнях.
Электронные спектры обусловлены переходами электронов между различными энергетическими уровнями и позволяют определить строение молекул. С наибольшей интенсивностью проявляются электронные переходы с одной связывающей электронной орбитали на другую. Переходы с несвязывающей орбитали на связывающую характеризуются меньшей интенсивностью.
Электронные спектры позволяют определить основной параметр строения молекулы - расположение ее электронных уровней.
Любой спектр является отражением переходов энергетического состояния атомов в молекуле под действием внешнего излучения.
Под действием внешнего излучения в веществе может протекать:
-частичное поглощение этого излучения веществом (адсорбция);
-полное поглощение кванта внешнего излучения с последующим испусканием собственного кванта излучения;
-рассеяние внешнего излучения.
40
