
УПП Физическая химия 260800.62
.pdfПримером такого процесса может служить реакция разложения ацетальдегида, энергия активации которой равна 190 кДж/моль:
CH3CHO  CH4 + CO
CH4 + CO
В присутствии паров йода этот процесс протекает в две стадии:
I2
CH3CHO  CH3J + HJ + CO
CH3J + HJ + CO
CH3J + HJ CH4 + J2
CH4 + J2
Уменьшение энергии активации этой реакции в присутствии катализатора составляет 54 кДж/моль, константа скорости при этом увеличивается примерно в 105 раз.
Наиболее распространенным видом гомогенного катализа является кислотно – основной катализ, в котором в роли катализатора выступают ионы водорода или гидроксид-ионы
Между гомогенным и другими видами катализа нет принципиальной разницы. Во всех случаях ускоряющее действие катализатора сводится к тому, что из нескольких возможных путей реакции с энергетическими барьерами разной высоты он ведет реакцию по пути с наименьшей высотой потенциального барьера и минимальной энергией активации. Катализатор, взаимодействуя с реагентами и участвуя в образовании активированного комплекса, уменьшает энергию активации и таким образом повышает скорость химической реакции.
8.3. Гетерогенный катализ
Гетерогенный катализ - это катализ, в котором катализатор находится в виде твердого вещества, а реагирующие соединения в виде раствора или газообразной смеси. Это наиболее распространенный вид катализа, осуществляемый на границе раздела двух фаз.
Каталитическое действие твердого катализатора связано с наличием на его поверхности активных центров, представляющих собой отдельные атомы или группу атомов, обладающих повышенной энергией по сравнению с остальными атомами поверхности. Существование активных центров объясняется неоднородностью твердой поверхности, возникающей в результате различных дефектов кристаллической решетки. Так как дефекты кристаллической решетки могут быть самыми различными, активные центры энергетически неравноценны между собой. Поэтому в гетерогенном катализе исключительно большое значение имеют химический состав, строение и состояние поверхностного слоя твердого катализатора. Обычно активные центры составляют лишь небольшую долю твердой поверхности (иногда всего 4–5%) и лишь в исключительно редких случаях каждая молекула поверхности является активным центром. В связи с этим важной характеристикой гетерогенных катализаторов является удельная поверхность – отношение площади поверхности катализатора к его объему или массе. Чем больше удельная поверхность и число активных центров на единице поверхности, тем эффективнее катализатор. Наиболее высокая удельная поверхность характерна для пористых катализаторов, у которых
91
стенки пор, уходящих от внешней поверхности вглубь твердого тела, образуют внутреннюю поверхность, намного превышающую поверхность внешнюю и способную также участвовать в каталитической реакции. Если удельная внешняя поверхность зернистого катализатора не превышает 0,01 – 1,0 м2/г, то его внутренняя удельная поверхность может составить от 5 до 500 м2/г. Для увеличения доли поверхностных атомов катализатора его измельчают или наносят на поверхность пористых веществ – носителей, в качестве которых используют: древесный уголь, пемзу, асбест, силикагель, алюмогель, стекло, фарфор и т.д. В таких системах катализатор располагается на стенках пор носителя в виде частиц размером 2 – 20 нм. Таким образом повышается эффективность использования единицы массы катализатора и его экономия, что имеет большое значение при использовании таких дорогостоящих катализаторов, как платина, палладий, осмий, иридий, рений, золото и серебро.
По своей сути гетерогенный катализ аналогичен гомогенному: катализатор, вступая во временное химическое взаимодействие с реагирующими веществами с образованием активированного комплекса или неустойчивого промежуточного соединения, ведет реакцию по новому пути с минимальным энергетическим барьером. Обычно снижение энергии активации в гетерогенном катализе приводит к росту скорости реакций в 106–1016 раз. На эффективность твердых катализаторов большое влияние оказывают промоторы и каталитические яды. Промоторы способствуют сохранению активных центров, их устойчивости к изменению внешних условий, препятствуют сокращению удельной поверхности, а также повышают активность и селективность катализатора путем изменения строения и химического состава активных центров. Каталитические яды, напротив, дезактивируют поверхность катализатора в результате их осаждения на активных центрах и выключения их из каталитического процесса, а также за счет изменения их химического состава и строения, что может привести даже к изменению направления реакции. Гетерогенная каталитическая реакция представляет собой сложный процесс, протекающий через несколько основных стадий, заключающихся в:
1)поступлении исходных веществ к поверхности катализатора;
2)адсорбции исходных веществ на поверхности катализатора;
3)химической реакции с образованием продуктов, адсорбированных на поверхности катализатора;
4)десорбции продуктов реакции с поверхности катализатора;
5)удалении продуктов реакции от поверхности катализатора.
Общая скорость такого многостадийного процесса определяется самой медленной (лимитирующей) стадией и может подчиняться закономерностям диффузии, адсорбции или химической кинетики.
Уменьшение энергии активации – основная, но не единственная причина ускорения гетерогенной каталитической реакции. Катализатор не только снижает энергетический барьер, но и создает новые, энергетически более выгодные пути протекания реакции. При этом эффективность
92
гетерогенного катализатора определяется структурой и химическим составом его поверхностного слоя, а также соответствием между химическими свойствами катализатора и реагирующих веществ.
Причины, вызывающие каталитическое действие, многообразны и не поддаются точному объяснению. Поэтому в настоящее время не существует точки зрения на современную теорию гетерогенного катализа. Этим обстоятельством объясняется отсутствие единой современной теории гетерогенного катализа. Существующие теоретические положения могут дать лишь некоторые рекомендации при выборе катализатора для той или иной реакции:
1.Катализатором может быть вещество, способное образовывать промежуточное поверхностное соединение с реагирующими веществами.
2.Промежуточное поверхностное соединение должно быть менее устойчивым, чем конечные продукты реакции.
3.Катализатор должен быть активным (т.е. значительно снижать энергию активации), селективным, стабильным и способным к регенерации.
4.Катализатор должен иметь максимально развитую поверхность, наибольшее число активных центров на поверхности, оптимальную энергию связи с молекулами реагирующих веществ, достаточную механическую прочность и т.д.
Многие современные промышленные катализаторы представляют собой многокомпонентные и многофазные системы, в которых поверхность катализатора состоит из кристаллов нескольких различных веществ, что позволяет ускорять различные стадии сложного каталитического процесса на различных участках поверхности.
Особое место среди гетерогенных катализаторов занимают природные и синтетические цеолиты (алюмосиликаты), обладающие настолько большими параметрами кристаллической решетки, что молекулы реагентов могут проникать внутрь кристалла, каталитическая реакция в этом случае осуществляется при участии практически всех внешних и внутренних атомов катализатора. Цеолиты нашли широкое применение в процессах нефтепереработки и органического синтеза.
8.4. Ферментативный катализ
Ферментативный катализ - это катализ, в котором катализатором служат сложные белковые образования, ускоряющие протекающие биологически важных реакций в организмах растительного и животного мира. Он может быть как гомогенным, так и гетерогенным.
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира. Многие жизненно важные химические реакции, протекающие в клетке, ускоряются особыми органическими катализаторами, именуемыми ферментами или энзимами.
По сравнению с неорганическими катализаторами ферменты имеют более сложное строение: каждый фермент содержит белок, которым и
93
обусловлена высокая специфичность биологических катализаторов. Согласно структурной модели Полинга - Кори, она свернута в спираль, которая в обычном состоянии стабилизирована водородными связями между кислотными и основными центрами.
Особая избирательность и высокая скорость - два основных признака ферментативного катализа. Ни один из созданных руками человека катализаторов (за исключением, пожалуй, 2-оксипиридина) не может сравниться с ферментами по силе и избирательности воздействия на органические молекулы. Активность фермента, как и любого другого катализатора, тоже зависит от температуры: с повышением температуры возрастает и скорость ферментативной реакции. При этом обращает на себя внимание резкое снижение энергии активации Е по сравнению с некаталитической реакцией. Правда, это происходит не всегда. Известно много случаев, когда скорость возрастает благодаря увеличению независящего от температуры предэкспоненциального множителя в уравнении Аррениуса.
Трудно высказать какие-либо предложение по поводу выбора фермента и пути активации субстрата. Во всяком случае, изучение кинетики ферментативной реакции и термодинамики образования промежуточных комплексов, хотя и дает ценную количественную информацию, не позволяет полностью раскрыть молекулярный и электронный механизм воздействия фермента. Здесь, как и при изучении обычных химических реакций, приходится идти по пути моделирования молекулярных механизмов, которые по крайней мере не противоречили бы данным эксперимента и элементарной логике химических реакций. Ниже мы рассмотрим некоторые из таких модельных представлений, позволяющих установить природу активных центров ферментов.
Увеличение кислотности среды будет благоприятно для одних элементарных стадий и неблагоприятно для других. При наличии таких конкурирующих фактов, как нетрудно догадаться, должна существовать некоторая оптимальная кислотность среды, при которой фермент может воздействовать с максимальной эффективностью.
Анализ зависимостей скорости от рН является весьма эффективным средством идентификации функциональных групп белковой молекулы фермента, участвующих в процессе активации молекул субстрата. Зная природу активных центров, можно представить себе, как они функционируют. Конечно, при этом приходится проводить аналогично с механизмом элементарных актов реакций органических соединений.
В общественном питании ферменты имеют большое значение. Они влияют на качество сырья (плодов, овощей, муки, мяса) и готовых продуктов. Ферменты используются для созревания мяса, улучшения консистенции, вкуса, аромата, для приготовления мясных паштетов, облегчения отделения мяса от костей, увеличения сроков хранения мясных продуктов, в хлебопекарном и кондитерском производствах.
94
Контрольные вопросы
1.Катализ, виды катализа. Активность, специфичность и селективность катализатора. Промоторы и ингибиторы.
2.Механизмы катализа. Влияние на энергию активации, на скорость прямой и обратной реакции, на константу равновесия.
3.Роль поверхности катализатора при гетерогенном катализе.
4.Специфичность гомогенного и гетерогенного катализа.
5.Автокаталитические реакции. Их примеры
6.Кинетическое уравнение реакции кислотно-основного катализа.
7.Ферментативный катализ, энзим и субстрат. Активные центры энзима.
8.Кинетическое уравнение ферментативного катализа в стационарном режиме.
9.Какова роль катализаторов в технологических процесса?
10.Каким образом можно повысить активность катализатора?
11.Какие вещества снижают каталитическую активность? Приведите примеры каталитических ядов.
12.Перечислите основные стадии гетерогенного каталитического процесса.
95

Примеры решения задач Тема 1. Химическая термодинамика
Пример 1. Вычислите ∆Н°, ∆U°, ∆G° и ∆А° для реакции
2СО2(г) = 2СО(г) + О2(г).
Определите, возможно ли самопроизвольное протекание реакции при стандартных условиях.
Решение: Воспользовавшись справочными данными, рассчитаем тепловой эффект реакции при постоянном давлении:
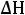
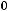 =
=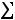
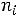
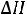

2−−110,70+ 0− 2−393,51= 565,62 кДж/моль.
Изменение внутренней энергии связано с изменением энтальпии зависимостью:
∆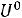
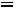
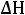
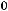


где: 
 изменение числа молей газообразных веществ в ходе реакции, следовательно
изменение числа молей газообразных веществ в ходе реакции, следовательно 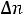



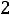
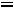
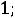
R – универсальная газовая постоянная (8,314·10-3 кДж/моль·К);
Отсюда: ∆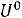
 565,62 – 8,314·10-3·298 = 563,14 кДж/моль.
565,62 – 8,314·10-3·298 = 563,14 кДж/моль.
Для расчета 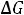
 найдем предварительно изменение энтропии:
найдем предварительно изменение энтропии:
 (2·197,48 + 205,03) - 2·213,66 = 172,67
(2·197,48 + 205,03) - 2·213,66 = 172,67
Дж/моль·К.
Тогда изменение энергии Гиббса будет равно:
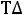
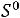 = 565,62 - 298·172,67·10-3 = 514,16кДж/моль.
= 565,62 - 298·172,67·10-3 = 514,16кДж/моль.
Теперь определим изменение Гельмгольца:
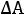
 = ∆
= ∆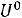

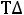
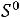 = 563,14 - 298·172,67·10-3 = 511,68 кДж/моль.
= 563,14 - 298·172,67·10-3 = 511,68 кДж/моль.
Положительные значения величин 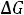
 и
и 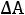
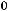 указывают на то, что при стандартных условиях реакция не будет самопроизвольно идти в прямом направлении.
указывают на то, что при стандартных условиях реакция не будет самопроизвольно идти в прямом направлении.
Пример 2. Определите, возможно ли при 95oС самопроизвольное протекание процесса Na2O(т) + H2O(ж) → 2NaOH(т). Ответ обоснуйте, рассчитав величину изменения энергии Гиббса при данной температуре.
Решение: |
Переведем |
температуру |
в |
шкалу |
Кельвина: Т=273+95=368К. Для расчета ΔGo368 воспользуемся |
уравнением: |
|||
ΔGo368 =ΔHo – TΔSo |
|
|
|
|
Воспользуемся изменениями энтальпии и энтропии, рассчитанными для данного процесса в предыдущих задачах. При этом величину изменения
96
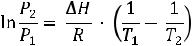
энтропии |
необходимо |
перевести |
|
из Дж/К в кДж/К, поскольку |
значения ΔH и ΔG обычно измеряют в кДж. |
|
|||
–17,18 Дж/К = –0,01718 кДж/К |
|
|
|
|
ΔGo368 = –153,6 – 368·(–0,01718) = –147,3 кДж. |
|
|||
Таким |
образом, ΔGo368 < |
0, |
поэтому самопроизвольное |
|
протекание данного процесса при 95oС возможно.
Пример 3. Теплоты образования жидкой воды и газообразного диоксида углерода соответственно равны –285,8 и –393,5 кДж/моль. Теплота сгорания метана при тех же условиях равна –890,3 кДж/моль. Рассчитайте теплоту образования метана из элементов при условиях:
1) р=const; 2) V=const, Т=298 К.
Решение: Запишем термохимическое уравнение образования метана из элементов при (р=const):
1) С(тв) + 2Н2(г) = СН4 (г) + ∆Н1.
Запишем термохимические уравнения образования воды и диоксида углерода и термохимическое уравнение сгорания метана:
2)Н2(г) + 1/2О2(г) = Н2О(ж) + ∆Н2;
3)С(тв) + О2(г) = СО2(г) + ∆Н3;
4) СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж) + Н4.
Для вычисления ∆Н1 проведем следующие алгебраические действия с термохимическими уравнениями: Уравнение 2 умножим на 2, прибавим уравнение 3 и вычтем уравнение 4, получим уравнение 1.
Проверим это:
2Н2(г) + О2(г) - Н2О(ж) + С(тв) + О2(г) - СО2(г) - СН4(г) - 2О2(г) + СО2(г) + 2Н2О(ж) = 2Н2(г) + С(тв) - СН4(г) = 0
Аналогичные алгебраические действия проведем и с тепловыми эффектами:
∆Н1 = ∆Н2 + ∆Н3 - ∆Н4 = 2(-285,8) + (-393,5)-(-890,3)=-74,8кДж При V=const: Qv = Qp - ΔνRT
Для реакции изменение числа моль газообразных продуктов составит:
= 1-2 -1/
Qv = -74800-(-1)·8,31·298=-72410 Дж=-72,41 кДж.
Пример 4. Давление пара этилового спита при 293 К равно 12529 Па, а при 313 К - 34575 Па. Определите среднее значение теплоты испарения спирта в указанном интервале температур.
Решение: Воспользуемся уравнением Клапейрона-Клаузиуса:
где Н - средняя молярная теплота испарения спирта.
97
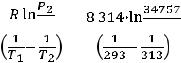
Н =  =
=  = 38699 Дж/моль.
= 38699 Дж/моль.
Пример 5. Рассчитать ΔS после смешивания двух порций спирта (m1 = 2,3 г, t1 = 70оC; m2 = 5,8 г, t2 = 10оC) и выравнивания их температур (до tср). Молярная теплоѐмкость спирта – С = 111,4 Дж/(моль·К). Изменением объѐма системы пренебречь.
Решение: а) Количество теплоты, отданной первой (более горячей) порцией, равно по абсолютной величине количеству теплоты, полученной второй порцией спирта:
–Q1 = Q2 , или m1С (t1 – tср) = m2С (tср – t2) .
Отсюда
tср = (m1 t1 + m2 t2 ) /(m1 + m2) = 27oC; Тср = 300 K .
б) Изменение энтропии каждой порции таково:
ΔS1 = n1 ·С· ln(Tср /T1) = (m1/M) ·C·ln(Tср /T1) = –0,73 Дж/К ,
ΔS2 = n2 ·С· ln(Tср /T2) = (m2/M) ·C· ln(Tср /T2) = +0,97 Дж/К
где М = 46 г/моль – молярная масса этанола, Т1 = 343 К, Т2 = 283 К. Энтропия остывающей порции уменьшается, а нагревающейся порции – возрастает.
в) Результирующее изменение энтропии системы – положительная величина:
ΔS = ΔS1 + ΔS2 = +0,24 Дж/K .
Это иллюстрирует второе начало термодинамики в отношении процессов теплопередачи. – Итогом таких процессов является не только переход теплоты от более тѐплого объекта к более холодному (что выравнивает температуры), но и возрастание энтропии системы в целом.
Пример 6. Рассчитать равновесный выход продуктов и состав реакционной смеси при равновесии для реакции этерификации, протекающей в газовой фазе.
CH3COOH + C2H5OH CH3COOC2H5 + H2O
при P= 1,013.105 Па и Т = 298 К, если исходные концентрации CH3COOH и C2H5OH равны соответственно 1 и 2 моль/л. Константа равновесия реакции
Кр = Кс = 4.
Решение: Составим таблицу значений числа молей всех веществ, участвующих в реакции (в 1 литре реакционной смеси):
98

|
CH3COOH |
C2H5OH |
CH3COOC2H5 |
H2O |
в начальный момент |
1 моль |
2 моль |
0 моль |
0 моль |
при равновесии |
1 х моль |
2 х моль |
х моль |
х моль |
Так как данная реакция идѐт без изменения объѐма реакционной смеси, концентрации в уравнении закона действующих масс могут быть заменены числом молей соответствующих веществ. Согласно общему выражению для константы равновесия:
Преобразуем полученное выражение в уравнение:
x2 = 4(1 x)(2 x); x2 = 4(2 x 2x + x2); x2 4x2 + 12x 8 = 0; 3x2 12x + 8 = 0.
Решая его относительно х, получим:
|
x1,2 = |
|
|
|
|
|
|||
х1 = 3,155 моль; |
х2 = 0,845 моль. |
|||
Поскольку из 1 моль CH3COOH и 2 моль C2H5OH нельзя получить более 1 моль этилацетата, x1 отбрасывается, как не удовлетворяющий условию. Значит, теоретический равновесный выход этилацетата будет равен 0,845 моль или 84,5%. Состав реакционной смеси при равновесии будет таким:
Этилацетата - |
0,845 моль; |
|
Уксусной кислоты - |
1 0,845 = 0,155 |
моль; |
Этилового спирта - |
2 0,845 = 1,155 |
моль |
Воды - |
0,845 моль. |
|
Пример 7. Как изменится температура плавления льда при повышении давления на 1 атм, если известно, что при 0°С теплота плавления льда равна 333,5 Дж/г, а удельные объемы воды и льда соответственно равны
1,0001·10-6 м3/г и 1,0908·10-6 м3/г?
Решение: Плавление льда представляет собой фазовый переход:
твердое вещество →жидкость.
Запишем уравнение Клапейрона – Клаузиуса для процесса плавления в следующем виде
Т = 273 К, ΔV = Vж - Vтв = 1,0001·10-6 - 1,0908·10-6 = - 9,07·10-8 м3/г. 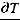
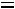



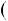




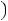 = -7,43·10-8 м2·К/Н
= -7,43·10-8 м2·К/Н
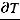 = -7,43·10-8 ·1,013·105 = -7,5·10-3К
= -7,43·10-8 ·1,013·105 = -7,5·10-3К
При повышении давления на 1 атм температура плавления льда снизится на 0,0075 градуса.
99

Тема 2. Строение вещества
Пример 1. Вычислить мольную рефракцию хлорбензола при Т=283 К, если показатель преломления n= 1,5248, а плотность d = 1,118 · 103кг/м3.
Сравнить значение мольной рефракции с рассчитанной по правилу аддитивности.
Решение: Вычисляем мольную рефракциию по формуле ЛорентцаЛоренца:
Rm = |
M |
|
n2 1 |
||
d |
n |
2 |
2 |
||
|
|
|
|||
где М – молекулярная масса вещества; d – плотность раствора, г/см3; n – показатель преломления раствора.
Подставляя приведенные в задаче величины, получаем:
RM = |
|
112,563 |
|
|
1,5248 1 |
30.845 10 |
3 |
м3 |
|||
1,118 |
10 |
3 |
1,5248 |
2 |
кмоль |
||||||
|
|
|
|
|
|||||||
Определяем мольную рефракцию по атомным рефракциям и инкрементам связей, зная, что по правилу аддитивности рефракция всей молекулы (мольная рефракция) равна сумме рефракций, входящих в молекулу атомов и рефракций всех ее химических связей ("инкременты" связей):
R C6 H5C1 = 6 Rc+ 5 RH + RCI+ 3 Rдв.св= 6·2,418+5·1,100+5,967+3·1,733)·10-3= 30,174·10-3 м3/кмоль.
Сравнение обоих результатов показывает достаточное совпадение величин, так как расхождение составляет 2,2%.
Пример 2. Рассчитать парахор этилового спирта (Пэксп, Птеор.), если 
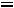
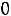
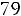 и
и 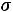
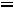

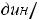
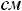 .
.
Решение:
Пэксп. = 
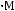 =
=  = 126,1 см3/моль.
= 126,1 см3/моль.
Птеор. = 
 = 2
= 2
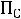

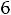

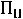 +
+ 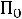
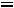 2·4,8 + 6·17,1 + 13,7 = 125,9 см3/моль.
2·4,8 + 6·17,1 + 13,7 = 125,9 см3/моль.
Тема 3. Химическое равновесие
Пример 1. Определить константу равновесия реакции NOCl2(г) + NO(г) 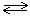 2NOCl(г), если при некоторой температуре равновесные концентрации веществ составляют [NOCl2]=0,05; [NO]=0,55; [NOCl]=0,08 моль/л.
2NOCl(г), если при некоторой температуре равновесные концентрации веществ составляют [NOCl2]=0,05; [NO]=0,55; [NOCl]=0,08 моль/л.
Решение:
Константа равновесия обратимой химической реакции равна отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ. Значение
100
