
УПП Физическая химия 260800.62
.pdf
б) при равновесном состоянии элементы системы характеризуются наименьшей упорядоченностью.
Отсюда следует, что энтропия является как мерой рассеяния энергии, так и, что сейчас для нас главное, мерой неупорядоченности системы.
Применение второго закона термодинамики к живым системам без учета того, что это - открытые системы, приводит к противоречию. Действительно, энтропия должна всегда возрастать, при этом должна расти неупорядоченность живой системы. В то же время мы хорошо знаем, что все живые системы постоянно создают из беспорядка упорядоченность. В них создается и поддерживается физическое и химическое неравновесие, на котором основана работоспособность живых систем. В процессе развития каждого организма (ортогенеза), так же как и в процессе эволюционного развития (филогенеза) все время образуются новые структуры, и достигается состояние характеризующееся высокой упорядоченностью. А это означает, что энтропия (неупорядоченность) живой системы не должна возрастать. Таким образом, второй закон термодинамики, справедливый для изолированных систем, для живых систем, являющихся открытыми, неприменим.
Для открытых термодинамических систем изменение энтропии можно представить как
S = Si + Sе |
(71) |
где 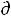 Si – изменение энтропии в ходе процессов, происходящих в самой живой системе,
Si – изменение энтропии в ходе процессов, происходящих в самой живой системе, 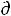 Se – изменение энтропии при обмене веществом и энергией с окружающей средой.
Se – изменение энтропии при обмене веществом и энергией с окружающей средой.
Согласно второму закону термодинамики величина 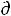 Si может быть только положительной или в предельном случае (обратимые процессы) равна нулю. Величина
Si может быть только положительной или в предельном случае (обратимые процессы) равна нулю. Величина 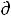 Se может быть положительной (
Se может быть положительной (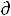 Se > 0), и отрицательной (
Se > 0), и отрицательной ( Se < 0). При этом суммарное изменение энтропии может быть и отрицательным. При
Se < 0). При этом суммарное изменение энтропии может быть и отрицательным. При 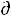 Se < 0 и |
Se < 0 и | 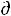 Se| > |
Se| > | 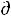 Si | :
Si | :
S = Si + Se < 0, |
(72) |
|
Рассмотрим производную энтропии по времени |
|
, которую называют |
|
||
скоростью изменения энтропии. Из выражения для dS следует, что изменение энтропии открытой системы:
(73)
Для стационарного состояния, когда неравновесность во времени не изменяется, изменение энтропии должно быть равно нулю:
= 0 |
(74) |
Это означает, что
21

= |
|
(75) |
|
Теорема Пригожина. Согласно теореме Пригожина, если открытую термодинамическую систему при неизменных во времени условиях предоставить самой себе, то прирост энтропии будет уменьшаться до тех пор, пока система не достигнет стационарного состояния динамического равновесия; в этом состоянии прирост энтропии будет минимальным:
(76)
Можно сказать, что для открытой системы в стационарном состоянии изменение энтропии минимально.
Для живых систем это означает следующее: в течение времени жизни живой системы ее элементы постоянно подвергаются распаду. Энтропия этих процессов положительна (возникает неупорядоченность).
Для компенсации распада (компенсации неупорядоченности) должна совершаться внутренняя работа в форме процессов синтеза элементов взамен распавшихся. А это означает, что эта внутренняя работа является процессом, который характеризуется отрицательным значением энтропии (такие процессы называют негэнтропийными, а отрицательную энтропию – негэнтропией).
Негэйнтропийный процесс противодействует увеличению энтропии системы, которое связано с процессом распада и создает упорядоченность. Источником энергии для совершения негэнтропийной внутренней работы являются:
для организмов - гетеротрофов (питающихся только органической пищей) – энергия в виде химических связей и низкая энтропия поглощаемых высокоструктурированных органических веществ;
для организмов - автотрофов (самостоятельно синтезирующих для себя питательные вещества из неорганических соединений с участием солнечного излучения) – энергия солнечного света, представляющего электромагнитное излучение с низкой энтропией.
Если рассматривать систему «живой организм - среда», из которой извлекаются питательные вещества и в которую поступают продукты обмена, то второй закон термодинамики справедлив: энтропия этой системы возрастает и никогда не уменьшается.
Итак, живая система является открытой системой, и ее энтропия не возрастает, как это имеет место в изолированной системе. Это означает, что живая система постоянно совершает работу, направленную на поддержание своей упорядоченности, и находится в неравновесном стационарном состоянии. Производство энтропии при этом (как следует из теоремы Пригожина) минимально.
Таким образом, с позиций термодинамики можно утверждать, что живым системам присущи процессы, уменьшающие энтропию систем и, следовательно, поддерживающие их организованность.
22
Контрольные вопросы
1.Термодинамические системы и их классификация.
2.Понятия фазы, компонента и числа компонентов термодинамической системы.
3.Термодинамические параметры состояния. Экстенсивные и интенсивные параметры.
4.Термодинамические состояния и процессы. Виды процессов. Функции состояния и функции процесса.
5.Первый закон термодинамики. Его применение к закрытым изолированным и к закрытым адиабатическим системам.
6.Функции состояния и функции процесса. Внутренняя энергия и энтальпия; связь между ними.
7.Тепловой эффект реакции. При каких условиях измеряют тепловой эффект реакции? Первый закон термодинамики применительно к таким условиям.
8.Стандартное состояние веществ в твѐрдом фазе, в газообразной и в растворе. Стандартные теплоты образования и сгорания.
9.Удельная, молярная, средняя и истинная теплоемкости.
10.Уравнения Кирхгофа, их применение для вычисления тепловых эффектов.
11.Энтропия и термодинамическая вероятность; уравнение Больцмана.
12.Энтропия и теплота в обратимом и необратимом процессах.
13.Формулировки второго закона термодинамики.
14.Изменение энтропии в процессах фазового перехода (испарение, плавление, возгонка).
15.В каком соотношении находятся молярные энтропии трех агрегатных состояний одного и того же вещества: пара, жидкости, твердого тела?
16.При каких условиях изменение внутренней энергии может служить критерием направления самопроизвольного процесса?
17.Функции состояния, определяющие направление процессов при постоянных V и T и при постоянных Р и T .
18.Способы вычисления стандартной энергии Гиббса химических реакций.
19.Третий закон термодинамики. Постулат Планка и тепловая теорема Нернста.
20.Дайте понятие отрицательной энтропии или негэнтропии.
21.Сформулируйте теорему Пригожина.
22.Перечислите специфические особенности термодинамических процессов протекающих в живых организмах.
23

Тема 2. СТРОЕНИЕ ВЕЩЕСТВА
Взависимости от расстояния между частицами и от степени их взаимодействия, вещества могут находиться в твердом, жидком, газообразном, а также плазменном агрегатном состояниях.
Вкурсе физики эти состояния вещества рассматриваются подробно.
Вданном разделе целесообразно более подробно остановиться на рассмотрении жидкого состояния вещества, занимающего промежуточное положениe между газообразными и твердыми телами, как наиболее характерного для существования биосистем, а также на современных физикохимических методах исследования строения вещества.
2.1 Жидкое состояние. Вода
Вещества, находящиеся в жидком состоянии при температуре меньше 298 К, называются жидкостями. Если вещество переходит в жидкое состояние при температурах больше 298 К, то такое состояние называется
расплавом.
В жидкостях силы притяжения соизмеримы с силами, обусловливающими тепловые колебания молекул, при этом сжимаемость жидкостей мала, их плотность близка к плотности твердых тел, но более чувствительна к изменению температуры.
Жидкости характеризуются упорядоченным расположением частиц в малых объѐмах и неупорядоченным - во всем объѐме (рис. 1) то есть имеют ближний порядок.
а) |
б) |
Рис.1. Расположение молекул: а) в твердом теле; б) в жидкости
В таблице 1 приведены основные физические константы некоторых жидкостей.
Таблица 1. Физические константы жидкостей при Т = 293 K и Р = 1атм
|
|
|
Показатель |
|
|
|
|||
Жидкость |
Плотность, |
Вязкость, |
Тзам, |
0С |
|
Ткип, |
0С |
Показатель |
|
, кг/м3 |
Η, Па |
|
|
|
|
|
|
преломления, |
|
|
|
|
|
|
|
|
|
|
n |
Вода |
0,999 |
1,005 |
|
273 |
|
373 |
1,333 |
||
|
|
|
|
|
|
|
|
||
Этанол |
0,79 |
1,200 |
|
159 |
|
352 |
1,361 |
||
|
|
|
|
|
|
|
|
||
Глицерин |
1,26 |
1,490 |
|
291 |
|
563 |
1,474 |
||
|
|
|
|
|
|
|
|
||
Сероуглерод |
1,26 |
0,365 |
|
161 |
|
319 |
1,628 |
||
|
|
|
|
|
|
|
|
|
|
Ртуть |
13,2 |
1,554 |
|
- |
|
|
- |
|
- |
|
|
|
|
|
|
|
|
|
|
24
Наибольший интерес представляет изучение структуры и свойств воды, как основного компонента биосистем и универсального растворителя.
2.2. Структура и свойства воды
Самым распространенным растворителем на Земле является вода. В животных и растительных организмах вода обычно составляет более 50% от их общего веса, а в некоторых случаях достигает 95 – 98% (медузы, водоросли и т.д.)
Вода обеспечивает всасывание (осмос и диффузию) и механическое передвижение питательных веществ и продуктов обмена в пищеварении, биосинтезе, ферментативном катализе, постоянство буферной емкости крови и т.д. Своеобразие структуры воды обусловливают особые свойства всех растворенных в ней веществ, в частности, высокомолекулярных веществ - биополимеров (белков, нуклеиновых кислот, полисахаридов и т.д.), которые могут функционировать только в водной среде. Вода участвует в процессах гидратации, набухания, гелеобразования и старения биоколлоидов. Уменьшение количества воды в биологических системах ниже определенного предела приводит к остановке биологических процессов. Являясь высокополярным соединением, вода вызывает диссоциацию электролитов, принимает непосредственное участие в гидролитическом распаде веществ и во многих других физико-химических процессах.
Таким образом, эволюционно сложилось так, что вода является основным необходимым компонентом всех биологических систем и процессов их жизнедеятельности, а также определяет основные свойства и характеристики биосырья.
Модель строения воды представлена на рис.2.
Свойства кислорода и водорода, входящих в молекулы воды, не обеспечивают симметричное строение молекулы воды (рис. 2а), как в других соединениях (рис. 2б).
а) |
|
б) |
_ _ + |
+ |
_ _ |
|
О |
|
О |
С |
О |
|
|
|
|||
|
|
Н |
+ |
+ |
|
Н |
105° |
|
|
|
Рис 2. Модели строения молекулы: а) воды (несимметричная); б) диоксид углерода (симметричная).
25

При расстоянии между центрами ионов кислорода и водорода равном 0,98 А валентный угол равен 105°, то есть равен тетраэдрическому. Молекула воды может быть представлена в виде тетраэдра, причем каждая его вершина может притягивать диполи воды. Так связь Н - О является высокополярной, то молекула воды может быть представлена в виде диполя. Диполи воды, как и других полярных жидкостей, взаимоориентируются, образую ассоциаты различных размеров и прочности.
а)
- |
+ |
- |
+ |
- |
+ |
б)
- |
+ |
- |
+ |
- |
+ |
в)
+ –
–+
+ |
–– |
+ |
–– |
–+
г) |
–+ |
|
–+ |
|
|
|
|
–+ |
|
|
+ |
–– |
+ |
–– |
|
|
|
Рис. 3. Различные типы ассоциации диполей полярных жидкостей.
Приведенные типы структур диполей воды на рис. 3 свидетельствуют о том, что в воде находятся рыхлые структуры и пустоты, которые позволяют протекать процессам растворения и диффузии веществ, а приведенные расчеты объема, занимаемого одним литром воды свидетельствует о том, что только одна треть объема занята непосредственно молекулами воды.
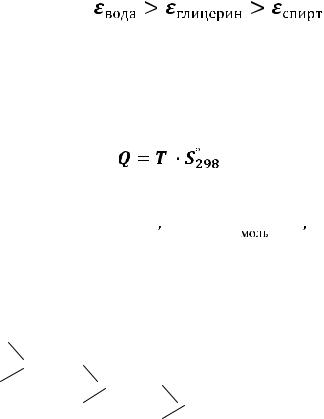
Поляризация молекул характеризуется дипольным моментом µ = q  l и диэлектрической проницаемостью ε. Дипольный момент характеризует отдельные молекулы, а ε - смеси веществ, растворы различных веществ и концентраций, поэтому сравнивать полярность веществ между собой удобнее по значениям ε (табл. 2).
l и диэлектрической проницаемостью ε. Дипольный момент характеризует отдельные молекулы, а ε - смеси веществ, растворы различных веществ и концентраций, поэтому сравнивать полярность веществ между собой удобнее по значениям ε (табл. 2).
26
|
|
|
Таблица 2 |
Диэлектрическая проницаемость веществ |
|
||
|
|
|
|
Вещество |
µ,D |
|
ε |
|
|
|
|
Вакуум |
- |
|
8,8 |
|
|
|
|
Газы и пары |
- |
|
0 - 7,0 |
|
|
|
|
Оливковое масло |
- |
|
3 |
|
|
|
|
Холестерин |
- |
|
5 |
|
|
|
|
Лецитин |
- |
|
13 |
|
|
|
|
Этанол |
1,7 |
|
25,0 |
|
|
|
|
Глицерин |
0,93 |
|
56 |
|
|
|
|
Вода |
1,84 |
|
80 |
|
|
|
|
Ацетон |
9,2 |
|
21,0 |
|
|
|
|
Биологические жидкости |
- |
|
82-85 |
|
|
|
|
Чем выше полярность растворителя, то есть его значение ε, тем лучше он растворяет полярные ионные соединения. Как видно из табл.3, вода является наилучшим полярным растворителем:
Растворимость полярных соединений в воде объясняется тем, что между их молекулами образуются водородные связи.
Энергия водородной связи составляет 5-8 ккал/моль, что значительно превышает энергию Ван-дер-Ваальсовских сил (1 ккал/моль)
Тепловая энергия (Q) воды при 25°С может быть найдена как
(77)
где 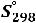 - стандартная энтропия воды равная 16,7 ккал/моль, отсюда
- стандартная энтропия воды равная 16,7 ккал/моль, отсюда
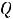
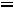 298
298 
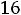
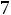
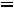
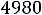

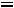
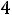

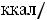
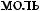
Следовательно, тепловая энергия воды соизмерима с энергией водородной связи, поэтому между молекулами воды происходит образование водородных связей:
Н |
|
О ...Н |
|
Н |
О...Н |
Н |
О... |
|
Н |
27
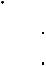
Высокие значения удельной теплоты плавления и теплоты кипения воды объясняются тем, что большая часть сообщаемой энергии идет на разрыв водородных связей. Структурирование воды не только в твердой, но и в жидкой фазе объясняет многие ее специфические свойства по сравнению с другими полярными растворителями, в частности, физические характеристики (табл.3) и высокую подвижность протона.
|
|
Таблица 3. |
|
Физико-химические свойства растворителя. |
|
|
|
|
|
|
|
Свойство |
Вода |
Спирт |
|
|
|
|
|
Температура замерзания, К |
273 |
161 |
|
|
|
|
|
Температура кипения, К |
373 |
352 |
|
|
|
|
|
Молярная теплоемкость, Дж/К моль |
73,5 |
112 |
|
|
|
|
|
Молярная теплота плавления, Дж/К моль |
6,0 |
5,0 |
|
|
|
|
|
Молярная теплота испарения, Дж/К моль |
40,1 |
39,3 |
|
|
|
|
|
Диэлектрическая проницаемость |
75,8 |
25 |
|
|
|
|
|
Дипольный момент |
6,1 |
5,7 |
|
|
|
|
|
Плотность, г/см3 при 293К |
0,999 |
0,79 |
|
|
|
|
|
Вязкость, спз при 293К |
1,0 |
1,2 |
|
|
|
|
|
Поверхностное натяжение, дин/см при 293К |
72,8 |
22,3 |
|
|
|
|
|
Парахор, см3/моль |
58 |
126 |
|
|
|
|
|
Вода является конечным продуктом реакции сгорания, окисления, разложения всех органических веществ. Необходимо отметить, что она является также конечным продуктом биологического окисления веществ, в частности глюкозы. Образование воды в результате этого процесса сопровождается выделением большого количества энергии 25 – 29 кДж/моль, что равно тепловому эффекту сгорания водорода: 2H2 + O2 = 2H2O
Высокие значения теплоемкости и мольной теплоты испарения воды делает ее идеальной жидкостью для поддержания постоянной температуры в организме теплокровных животных и других тепловых равновесий.
2.3. Жидкие кристаллы
Обычно при фазовом переходе твердых веществ в жидкости существует резкий переход от высокоупорядоченного кристаллического состояния к менее упорядоченному. Однако молекулы некоторых веществ, как низкомолекулярных, так и высокомолекулярных, имеют настолько сильную тенденцию к упорядоченности, что при плавлении их кристаллы претерпевают промежуточное мезоморфное, то есть паракристаллическое состояние, характеризующееся помутнением образующегося расплава. При
28

дальнейшем повышении температуры мутный расплав резко переходит в прозрачную жидкость, обладающую уже физико-химическими свойствами обычных жидкостей.
Температура этого фазового перехода, который относится к фазовым переходам первого рода, называется температурой просветления (Тпр).
Вещества, которые могут существовать в мезоморфном состоянии,
называются жидкими кристаллами.
К ним относятся многие природные и синтетические высокомолекулярные соединения, некоторые азосоединения, многие растворы биологически активных соединений, эфиры холестерина, фосфатиды и т.д. Следовательно, жидкокристаллическое состояние специфично для различных технологических процессов переработки биосырья, а также полимеров и других химических соединений в ориентированные пленки или волокна.
Для медицины и биологии большой интерес представляет изучение жидкокристаллического состояния, возникающего в биосистемах, с которым связаны такие важнейшие функции живых организмов, как энергетический обмен, движение, синтез белков, восприятие и т.д.
Молекулы или жесткоцепные макромолекулы, способные образовывать жидкие кристаллы, как правило, имеют вытянутую палочкообразную жесткую форму или способны к параллельной упорядоченности в некоторой области пространства – домене.
Образование жидкокристаллической фазы в гибкоцепных эластичных полимерах возможно только под действием внешнего растягивающего механического или гидродинамического воздействия.
В отличие от обычных жидкостей, являющихся изотропными, в жидкокристаллическом мезоморфном состоянии молекулы располагаются параллельно друг другу, вращаясь только вокруг своих длинных осей, то есть обладают ярко выраженной анизотропией свойств.
Известны два типа жидких кристаллов: термотропные и лиотропные. Термотропные жидкие кристаллы образуются при нагревании веществ
или охлаждении их сплавов и по образующемуся типу структур подразделяется на смектические, нематические и холестерические (см. схему
1).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кристаллическое |
|
|
|
|
|
МезоморфноеТпр |
|
|
|
|
|
||
|
|
|
|
|
|
|
Жидкое состояние |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
состояние |
|
|
|
|
|
состояние |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Термотропные жидкие кристаллы |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||||
|
Смектические |
|
|
|
Нематические |
|
Холестерические |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 1. Классификация и фазовые превращения термотропных жидких кристаллов.
29
В смектических жидких кристаллах длинные оси молекул перпендикулярны плоскости расположения слоев, которые могут свободно перемещаться относительно друг друга. Такие вещества имеют механические свойства двухмерного кристалла, а оптические свойства сравнимы со свойствами трехмерных кристаллов, например, кварца.
Нематические жидкие кристаллы наименее упорядоченные, хотя длинные оси молекул могут ориентироваться параллельно.
Холестерические жидкие кристаллы похожи на смектические тем, что ориентированные молекулы располагаются в виде отдельных слоев, но сами слои ориентируются в пространстве под некоторыми углами друг к другу.
Лиотропные жидкие кристаллы образуются при смешивании двух или нескольких соединений с водой или другим полярным растворителем.
Все жесткоцепные полимеры образуют в концентрированном растворе или сплаве термодинамически стабильную жидкокристаллическую фазу нематического типа, аналогичную лиотропным низкомолекулярным кристаллам. В пределах каждого нематического домена имеет место дальний однослойный ориентационный порядок, в то время как сами домены расположены хаотически.
Термотропные жидкие кристаллы нашли широкое применение в науке и технике. Разработаны методы использования холестерических жидких кристаллов в качестве чувствительных температурных датчиков, основанных на том, что цвет холестерических датчиков изменяется при очень слабом изменении температуры.
Под действием электрического поля нематические жидкие кристаллы проявляют оптические эффекты, называемые динамическим рассеиванием. При этом прозрачная пленка становится мутной. Этот эффект используется в различных индикаторных приборах и устройствах, работающих на жидких кристаллах. Например: дисплеи микрокалькуляторов и т.д.
2.4. Методы исследования строения вещества
Молекулярные константы являются фундаментальными характеристиками веществ. Определение этих констант (показателя преломления, поверхностного натяжения, диэлектрической проницаемости, рефракции, дипольного момента, вязкости, температур замерзания и кипения и т.д.) позволяет идентифицировать вещества и осуществлять контроль состава сырья, полуфабрикатов и готовой продукции; определять наличие и состав примесей и тем самым характеризовать качество исходного сырья и конечных продуктов, то есть осуществлять их сертификацию.
В данном разделе рассматриваются методы определения таких молекулярных констант жидкостей, как парахор, рефракция, поляризуемость, дипольный момент, электронные и молекулярные спектры и спектры комбинационного рассеивания.
30
