
Удельная теплоёмкость (1)
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПИЩЕВЫХ ПРОИЗВОДСТВ (МГУПП)
Кафедра «Энергосбережение и термогидродинамические процессы»
Теплотехника. Термодинамика и тепломассообмен. Теплотехника и энергосбережение. Техническая термодинамика. Тепло- и хладотехника.
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОЁМКОСТИ
Методические указания к лабораторной работе для студентов направлений подготовки уровня бакалавриата: 230100, 220400, 260200, 190600, 141200, 240700, 220700, 261700, 140500, 260800, 151000
МОСКВА 2013
Составители: Н.С. Николаев, проф.
Г.С. Руденко, проф.
П.И. Пляшешник, ст. преп.
В методических указаниях изложены теоретические основы и приведена методика определения одной из важнейших характеристик рабочих тел – удельной теплоѐмкости.
Переиздание утверждено кафедрой «Энергосбережение и термогидродинамические процессы».
© МГУПБ, 2002
© МГУПП, 2013
ВВЕДЕНИЕ
Характерной особенностью предприятий по переработке животноводческой продукции является широкое применение тепловых технологических процессов, к которым относятся варка и обжарка колбасных изделий, пастеризация и стерилизация молока и консервов, выпарка, сушка и многие другие. Поэтому эти предприятия являются одними из самых крупных потребителей топливно-энергетических ресурсов в АПК.
Одной из важнейших задач в перерабатывающих отраслях АПК является выпуск высококачественной продукции при одновременном снижении материально-технических ресурсов и энергии. Эта задача должна решаться при разработке новых технологических процессов, а также при конструировании и эксплуатации оборудования. Большое значение при этом имеет правильное представление о фактических характеристиках сырья и продуктов. В частности, при определении расходов теплоты важную роль играют теплофизические характеристики сырья, продуктов и теплоносителей – теплоѐмкость, теплопроводность и плотность, которые обусловливают скорость протекания процессов, а также затраты энергии в них.
Целью работы является углубление знаний по разделу «Теплоѐмкость» и изучение методов экспериментального определения этой характеристики для различных веществ.
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ РАБОТЫ
Теплотой называется энергия, передаваемая более нагретым телом менее нагретому, не связанная с переносом вещества и совершением работы. Подвод энергии в форме теплоты к какому-либо телу приводит к изменению его температуры. Основной характеристикой, определяющей затраты энергии на изменение температуры вещества в каком-либо процессе, является величина теплоѐмкости.
Истинной теплоѐмкостью тела C называют отношение количества теплоты dQ , получаемой телом при бесконечно малом равновесном изменении его состояния в каком-либо процессе, к изменению температуры dT вещества:
Ñ |
dQ |
. |
(1) |
|
|||
|
dT |
|
|
|
|
||
Индекс показывает, что в процессе один из параметров или функция состояния постоянны ( = const). Истинная теплоѐмкость – значение теплоѐмкости при данной температуре. Полное количество теплоты dQ , и соответственно теплоѐмкость тела, зависит от количества вещества, его физической природы и определяется условиями процесса подвода теплоты. В расчетах используется удельная теплоѐмкость, отнесѐнная к единице количества вещества (1 кг, 1 м3, 1 кмоль). Различают массовые (c, кДж/(кг К))*, объѐмные (c , кДж/(м3 К)) и мольные ( c , кДж/(кмоль К)) удельные теплоѐм-
2
кости, которые с теплоѐмкостью тела и между собой связаны следующими соотношениями:
|
|
C = с m = c' V0 = c N. |
|
(2) |
c = c / |
= c' v0; |
c' = c /22,4 = c 0; |
c = c = c' 22,4. |
(3) |
где m – масса тела, кг;
V0 и v0 – полный и удельный объѐм тела при нормальных условиях, м3 и м3/кг;
0 – плотность вещества при нормальных условиях, кг/м3; N – число киломолей вещества, содержащегося в теле;
– масса киломоля данного вещества, кг/кмоль.
Количество теплоты в процессе при условии = const определяется по выражению:
|
t2 |
|
t dt V |
t2 |
c' |
t dt N |
Q m |
c |
|
||||
|
t |
|
0 |
t |
|
|
|
|
|
|
|
||
|
1 |
|
|
1 |
|
|
t2
c t dt (4) t1
Значение удельной теплоѐмкости (c , c' или c ) в каком-либо процессе можно найти, используя уравнение первого закона термодинамики:
dq du p dv . |
(5) |
Учитывая, что величина du является полным дифференциалом и может быть представлена в виде:
|
|
|
|
|
u |
|
u |
, |
|
(6) |
||
|
|
|
du |
|
|
dt |
dv |
|
||||
|
|
|
|
|
t v |
|
v T |
|
|
|
||
уравнение (5) можно записать следующим образом: |
|
|||||||||||
|
|
|
|
u |
|
|
|
u |
|
|
|
|
|
|
|
dq |
|
dt |
p |
|
|
|
dv . |
(7) |
|
|
|
|
|
t |
v |
|
|
v |
T |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
В процессе, происходящем при неизменном объѐме ( = v = const), |
|||||||||||
|
|
u |
|
|
|
|
|
|
|
|
|
|
dq v |
|
|
dT . Поэтому удельная массовая теплоѐмкость при постоянном |
|||||||||
|
||||||||||||
|
|
T v |
|
|
|
|
|
|
|
|
|
|
_________________________
* Объѐм вещества зависит от давления и температуры, поэтому для получения сопоставимых результатов при определении объѐмной теплоѐмкости объѐм приводят к нормальным условиям (p0= 101325 Па, T0= 273 К).
объѐме определяется из выражения:
3
|
|
dq v |
|
u |
|
|
cv |
|
|
|
|
. |
(8) |
|
|
|||||
|
|
dT |
|
T v |
|
|
Таким образом, теплоѐмкость в произвольном процессе ( = const) равна
|
dq |
|
|
|
u |
|
v |
|
|
|
c |
|
cv |
p |
|
|
|
|
. |
(9) |
|
|
|
|||||||||
|
dT |
|
|
|
v T |
T |
|
|
||
Величина pвн= u v T называется внутренним давлением, р – внеш-
v T называется внутренним давлением, р – внеш-
ним давлением, а их сумма называется полным (или термическим) давлением, которое находится из соотношения
|
|
p |
|
p pâí |
T |
|
. |
|
|||
|
|
T v |
|
Тогда уравнение (9) можно представить следующим образом:
|
|
p |
v |
|
||
c cv |
T |
|
|
|
. |
|
|
|
|||||
|
|
T v |
T |
|
||
(10)
(11)
Из выражения (9) следует также, что в некоторых процессах теплоѐмкость c может быть отрицательной. Это возможно, когда при подводе теплоты (dq>0) совершается настолько большая работа при расширении (dv>0), что температура вещества понижается (dT<0).
Можно также показать, что c определяется выражением:
|
|
|
|
|
|
|
h |
|
|
p |
|
|
||
c |
|
c |
p |
|
|
v |
|
|
|
|
|
|
, |
(12) |
|
|
|||||||||||||
|
|
|
|
p |
|
|
T |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
где h – энтальпия.
Из уравнения (11) при условии = p = const получается связь между теплоѐмкостями cp и cv.
|
|
p |
|
|
v |
|
||
cp cv |
T |
|
|
|
|
|
. |
(13) |
|
|
|
||||||
|
|
T |
v |
|
T |
|
||
|
|
|
|
|
|
|
|
|
Таким образом, для вычисления теплоѐмкости и количества теплоты в каком-либо процессе ( = const) необходимо знать величины теплоѐмкостей в процессах при v = const или p = const, а также уравнение состояния для данного рабочего тела. Экспериментальное определение cv является очень сложной задачей, поэтому обычно в опытах находится cp, а величина cv рассчитывается.
Из соотношения (13) следует, что для всех веществ cp > cv, так как в процессе при постоянном давлении теплота расходуется не только на изменение внутренней энергии, но и на совершение работы расширения, которая в процессе при постоянном объѐме не совершается. Теплоѐмкости cp
4
и cv газообразных веществ значительно отличаются друг от друга, так как давление и объѐм в них сильно зависят от изменения температуры. В частности, для идеального газа из выражения (13), используя уравнение состояния pv = RT, получаем выражение:
cp cv R , |
(14) |
которое называется уравнением Р. Майера.
В реальных газах cp cv R , что объясняется совершением не только
внешней, но и внутренней работы, связанной с изменением внутренней потенциальной энергии в теле, определяющей бóльший расход теплоты в процессе при p = const.
Втвердых телах и жидкостях изменения давления и объѐма при изменении температуры незначительны, поэтому разностью cp и cv пренебрегают.
Втехнических расчетах количество теплоты обычно определяют с по-
мощью средних теплоѐмкостей. Средней теплоѐмкостью c m называют отношение количества теплоты q , полученного единицей количества вещества в каком-либо процессе при = const, к изменению температуры (T2 – T1) вещества:
c m |
|
T2 |
|
|
q |
. |
(15) |
|
|
||||||
|
T |
T2 |
T1 |
||||
1 |
|
|
|
||||
|
|
|
|
|
|||
Средняя теплоѐмкость – постоянное значение теплоѐмкости в данном конечном интервале температур.
Связь истинной и средней теплоѐмкостей устанавливается из условия, что количество теплоты, вычисленное с их помощью, одинаково:
|
|
|
|
|
|
T |
|
c m |
|
T2 |
|
|
1 |
2 c T dT . |
(16) |
|
|
||||||
|
|
|
|
||||
|
|
T1 |
T2 |
T1 T |
|
||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
В литературе (см. библиографический список) приводятся подробные таблицы истинных и средних теплоѐмкостей при постоянном давлении и постоянном объѐме.
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА
Для определения удельной теплоѐмкости используется метод непроточного калориметра, который применяется для определения теплоѐмкости жидкостей. Лабораторная установка см (рисунок) состоит из калориметра 1, куда наливают определенное количество жидкости (G), нагрев которой осуществляется электронагревателем 2. Для равномерного изменения температуры по объѐму установлена мешалка 3. Температура жидкости измеряется термометром 4. Интервал изменения температуры задается контактным термометром 5, который соединяется с блоком управления 6, отклю-
5
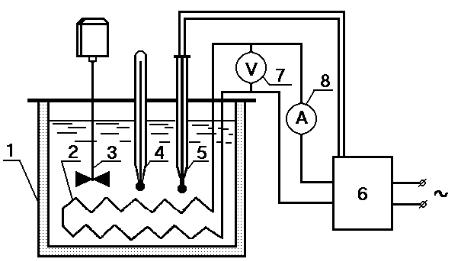
чающим электронагреватель и подающим звуковой сигнал при достижении заданной температуры.
Рис.1. Схема непроточного калориметра
Нагрев жидкости в калориметре происходит при постоянном (атмосферном) давлении. Количество теплоты Q, выделившейся в нагревателе и используемой для подогрева жидкости, определяется по формуле
Q=10-3k I U , кДж, |
17) |
|
где k – коэффициент, учитывающий расход теплоты на нагрев приборов и потери в окружающую среду;
I и U – ток и напряжение в цепи электронагревателя, А и В;– время нагрева, с.
Используя эту зависимость, на основании выражения (15) определяют среднюю массовую теплоѐмкость воды при постоянном давлении:
c |
pm |
|
T2 |
10 3 k I U |
, кДж/(кг К), |
(18) |
|
|
|||||||
|
|
||||||
|
|
T |
G(T2 |
T1) |
|
||
|
1 |
|
|||||
|
|
|
|
|
|||
где T1 и Т2 – начальное и конечное значения температуры в данном интервале, К.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
6
Определение теплоѐмкости жидкости (воды) производится в следующей последовательности:
1.Включить установку и через 2—3 мин измерить температуру воды
вкалориметре.
2.На контактном термометре установить температуру на 5 С выше начальной.
3.Включить одновременно электронагреватель и секундомер.
4.По достижении заданной температуры происходит автоматическое отключение электронагревателя и подается звуковой сигнал. В этот момент необходимо записать показания всех приборов.
5.Проводить опыт, повторяя п.п. 2 4, до достижения температуры, превышающей начальную на 30 40 С.
ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ И ОЦЕНКА ПОГРЕШНОСТИ
Теплоѐмкость воды в каждом интервале температур определяют по уравнению (18). Оценку точности результатов проводят по максимальной относительной погрешности измерений, которую определяют с помощью соотношения:
=
c |
|
|
I |
|
U |
|
|
|
G |
|
2 T |
|
|
(19) |
|
100% |
|
|
|
|
|
|
|
|
|
|
100, |
%, |
|
|
|
|
|
|
|
|
||||||||
c |
|
|
I |
|
U |
|
|
|
G |
|
T2 T1 |
|
|
|
где – абсолютные погрешности измерения соответствующих величин.
Отчѐт о работе должен содержать:
1.Цель работы и еѐ теоретическое обоснование.
2.Схему экспериментальной установки и еѐ описание.
3.Протокол наблюдений (см. ниже).
4.Обработку результатов измерений и оценку погрешности определения теплоѐмкости.
5.Сопоставление опытных и табличных значений теплоѐмкостей.
Протокол наблюдений
№ |
|
|
G= , |
k= |
|
|
п/п |
τ, c |
I, A |
U, B |
|
T1, K |
T2, K |
|
|
|
|
|
|
|
ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ САМОПРОВЕРКИ
7
№ |
|
|
Задания |
|
|
|
Варианты ответов |
||||||||||
п/ п |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Указать теплоѐмкость по- |
1. |
0 |
|
3. R/(k-1) |
||||||||||||
1 |
литропного процесса |
2. k·cv |
|
4. cv |
n k |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
n 1 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Определить |
|
объѐмную |
1. |
1,388 |
|
3. 0,933 |
|
|
||||||||
2 |
теплоѐм- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кость[кДж/(м3·К)] |
|
азота |
2. |
0,653 |
|
4. 1,010 |
|
|
|||||||||
|
при p=const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Массовая |
теплоѐмкость |
1. |
1,308 |
|
3. 0,916 |
|
|
|||||||||
3 |
окиси |
углерода |
|
при |
|
|
|
|
|
|
|
|
|
||||
|
p=const равна |
|
|
|
|
2. |
1,048 |
|
4. 1,010 |
|
|
||||||
|
Показатель |
|
|
адиабаты |
1. |
сp/(cp-cv) |
|
3. |
|
ñn cp |
|
||||||
4 |
можно |
определить |
по |
|
|
|
|
cn cv |
|||||||||
|
|
|
|
|
|||||||||||||
формуле |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
2.(cn-v)/cv |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
4. cµp/cµv |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Указать формулу опреде- |
1. |
сµp-cµv |
|
3. cµv/µ |
||||||||||||
5 |
ления газовой постоянной |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
2. cp-cv |
|
4. cµp/22,4 |
||||||
|
Мольная |
|
теплоѐмкость |
1. |
20,8 |
|
3. 33,6 |
|
|
||||||||
6 |
двухатомных |
газов |
при |
2. |
29,3 |
|
4. 8,314 |
|
|
||||||||
v=const |
|
êÄæ |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
равна |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
кмоль |
Ê |
|
|
|
|
|
|
|
|
|
|
|
||||
|
Указать |
формулу |
массо- |
1. cp/cv |
|
3. cv+R |
|||||||||||
7 |
вой теплоѐмкости |
при |
2. cµp-cµv |
|
4. cµv/22,4 |
||||||||||||
p=const |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||||||||||
|
Дать определение тепло- |
1. |
массовая истинная теплоѐмкость СO2 |
||||||||||||||
|
ѐмкости |
|
|
|
|
|
|
при p=const |
|
|
|
|
|
|
|||
|
ñpmCO |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
2 |
|
|
|
2. |
массовая средняя теплоѐмкость СО2 |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
8 |
|
|
|
|
|
|
|
|
при p=const |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
3. oбъѐмная средняя теплоѐмкость СО2 |
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
при p=const |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
теплоѐмкость CO2 |
при p=const |
|||||||
|
|
|
|
|
|
|
|
|
4. |
мольная средняя |
|
|
|
|
|
||
|
Мольная |
|
теплоѐмкость |
1. |
12,56 |
|
|
4. 20,9 |
|
||||||||
9 |
трѐхатомных |
газов |
при |
|
|
|
|
|
|
|
|
|
|||||
|
p=const равна |
|
|
|
|
2. |
37,7 |
|
|
3. 29,3 |
|
||||||
|
Формула |
|
определения |
1. |
сp-cv |
|
3. cµv/22,4 |
||||||||||
10 |
мольной |
|
теплоѐмкости |
|
|
|
|
|
|
|
|
|
|||||
|
при v=const следующая |
2. cp/cv |
|
4. сµp – 8,314 |
|||||||||||||
№ |
|
|
Задания |
|
|
|
Варианты ответов |
||||||||||
|
|
|
|
|
|
||||||||||||
8
п/ п |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|
Указать величину, на ко- |
1. |
8,314/µ |
|
|
|
|
|
3. |
22,4 |
|
|
|
|
|||||||||||||
|
торую отличаются сp от сv |
2. |
Rµ |
|
|
|
|
|
|
|
|
|
|
|
4. |
сµp/µ |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
Указать, что представляет |
1. |
тангенс угла наклона секущей с осью |
||||||||||||||||||||||||
|
|
собой средняя теплоѐм- |
абсцисс |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
12 |
|
кость с геометрической |
2. |
тангенс угла наклона касательной с |
||||||||||||||||||||||||
|
точки зрения в q-t систе- |
осью абсцисс |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
ме координат |
3. |
прямая, параллельная оси абсцисс |
||||||||||||||||||||||||
|
|
|
4. |
прямая, параллельная оси ординат |
||||||||||||||||||||||||
|
|
Формула определения |
1. |
|
dq |
|
|
|
|
|
|
|
|
|
|
|
3. |
с0+at+dt2 |
|
|
||||||||
13 |
|
средней теплоѐмкости га- |
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
за |
|
|
|
q |
|
|
|
|
|
|
|
|
|
|
|
4. |
сµpm/22,4 |
|
|
||||||||
|
|
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
14 |
|
Показатель адиабаты |
1. |
1,67 |
|
|
|
|
|
|
|
|
|
3. |
1,28 |
|
|
|
|
|||||||||
|
двухатомных газов |
2. |
1,40 |
|
|
|
|
|
|
|
|
|
4. |
1,5 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
Зависимость теплоѐмко- |
|
dq |
|
lim |
q |
|
|
|
|
3. |
с0+at+bt2 |
|
|
|||||||||||||
|
|
сти от температуры, ме- |
|
dt |
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
15 |
|
|
|
|
|
t O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
няющейся по линейному |
2. |
сm(t2-t1) |
|
|
|
|
|
4. c0+a/2(t2+t1) |
|||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
закону |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16 |
|
Показатель адиабаты од- |
1. |
1,67 |
|
|
|
|
|
|
|
|
|
3. |
1,28 |
|
|
|
|
|||||||||
|
ноатомных газов |
2. |
1,40 |
|
|
|
|
|
|
|
|
|
4. |
8,314 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
Формула определения |
1. |
сp/cv |
|
|
|
|
|
|
|
3. |
сµv+8,314 |
|
||||||||||||||
17 |
|
мольной теплоѐмкости |
2. |
сµv/22,4 |
|
|
|
|
|
4. |
сp-cv |
|
|
|
|
|||||||||||||
|
|
при p=const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Определить S в изобар- |
1. |
сvlnp1/p2 |
|
|
|
|
3. |
сplnv2/v1 |
|
|
||||||||||||||||
18 |
|
ном процессе идеального |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.c |
v |
n k |
ln T |
/ T |
|||||
|
|
газа |
2. cplnTн/273 |
|
|
|
|
|
|
|
n |
1 |
|
2 |
1 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
Связь между средней и |
|
|
ñm |
|
T02 T2 |
cm |
|
T01 T1 |
|
3. |
dq |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
истинной теплоѐмкостя- |
1. |
|
|
|
dT |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
T2 T1 |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
ми имеет вид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
19 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
4.с |
|
|
|
T2 (T T ) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
c dT |
|
|
|
|
|
|
|
m |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
2 |
|
1 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
2. |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
2 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Определить сочетание |
1. |
|
R |
|
|
(T T ); |
сv(T2-T1) |
|
|
|
|
|||||||||||||||
|
|
формул определения (ℓ) |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
k |
1 |
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
политропного и (q) изо- |
|
|
|
R |
|
|
(T1 T2 ); |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
барного процессов иде- |
2. |
|
|
|
RTlnv2/v1 |
|
|
|
|
|||||||||||||||||
20 |
|
k |
|
|
|
|
|
|
||||||||||||||||||||
|
альных газов |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
3. |
сP(T2-T1); p1v1lnp1/v1 |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
4. |
|
R |
(T T ); ñ (T T ) |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
n |
1 |
1 |
2 |
|
|
p |
2 |
|
1 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
