
УПП Физическая химия 260800.62
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
"МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПИЩЕВЫХ ПРОИЗВОДСТВ"
Н.Н. РОЕВА, С.Г. ШАРИПОВА, С.С. ВОРОНИЧ
ФИЗИЧЕСКАЯ ХИМИЯ
МОСКВА 2013
1
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
"МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПИЩЕВЫХ ПРОИЗВОДСТВ"
Н.Н. РОЕВА, С.Г. ШАРИПОВА, С.С. ВОРОНИЧ
ФИЗИЧЕСКАЯ ХИМИЯ
Рекомендовано в качестве учебного пособия для студентов обучающихся по направлению подготовки бакалавра 240100.62 «Химическая технология»
МОСКВА 2013
2
УДК 541.1 ББК 24.5 М 15
Рецензенты:
Ю.А. Ершов – доктор химических наук, профессор кафедры биомедицинской техники Московского государственного технического университета им. Н.Э. Баумана.
Ю.А. Устынюк - доктор химических наук, профессор, зав. лабораторией металлоорганических соединений химического факультета Московского государственного университета им. М.В. Ломоносова.
Роева Н.Н., Шарипова С.Г., Воронич С.С.
Физическая химия: Учебное пособие. - М.: МГУПП, 2013. - 118 с.
Учебное пособие разработано в соответствии с государственным стандартом для подготовки бакалавров по специальности 240100.62 - «Химическая технология». В нем рассмотрены теоретические и прикладные основы физической химии: химическая термодинамика, строение вещества, химическое и фазовое равновесие, растворы, химическая кинетика, электрохимия, катализ. Теоретический материал подкреплен примерами задач и тестами.
3
Введение
Физическая химия - это наука, сочетающая в себе базовые основы физики и химии, позволяющие объяснять вероятность и механизмы протекания химических реакций и процессов во всех сферах жизни и живых системах, и осуществлять расчеты их термодинамических, термохимических и каталитических параметров.
На основе расчета этих параметров она позволяет рассмотреть и объяснить такие важные вопросы: термодинамику и энергетику биопроцессов, осмотические явления и мембранные равновесия, окислительно-восстановительные процессы и редокс-потенциалы в физиологических средах, ферментативный катализ и т.д.
Основные положения физической химии является основой для изучения коллоидной химии и таких специальных дисциплин, как биотехнология, биологическая химия, общая химическая технология.
Тема 1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
1.1. Основные понятия термодинамики
Химическая термодинамика является одним из важнейших факторов, определяющих эффективность производства пищевых продуктов, где протекает множество химических, физико-химических и биохимических процессов, знание которого специалисту управлять, регулировать, оптимизировать эти процессы и создавать новые пищевые продукты.
Знание основных положений химической термодинамики позволит решить технологам многие вопросы, возникающие у них в процессе их практической деятельности, например такие, как:
-расчет тепловых эффектов процессов для различных условий;
-определение температур или теплот фазовых переходов;
-определение оптимального технологического режима проведения процесса;
-определение условий подавления побочных (нежелательных) реакций
ипроцессов;
-определение областей устойчивости вещества.
Термодинамика - наука, изучающая взаимные переходы теплоты и работы в равновесных системах и при переходе к равновесию.
Химическая термодинамика - раздел физической химии, изучающий термодинамические процессы и скорость их протекания (химические реакции, фазовые переходы, процессы в растворах и т.д.).
Объект изучения термодинамики - термодинамические системы. Они бывают:
-открытые, в которых существует обмен энергией и веществом с окружающей средой;
-закрытые, в которых существует обмен энергией с окружающей средой, но нет обмена веществом;
4
- изолированные, в которых нет обмена с окружающей средой ни энергией, ни веществом.
Системы подразделяются на гомогенные и гетерогенные.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
Процессы бывают обратимыми и равновесными.
Обратимый процесс – процесс, допускающий возможность возвращения системы в исходное состояние без каких-либо изменений в окружающей среде.
Равновесный процесс – процесс, при котором система проходит через непрерывный ряд равновесных состояний.
Энергия – мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Энергия является неотъемлемым свойством материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве.
Теплота - это форма передачи энергии путем неупорядоченного движения молекул (теплопроводность).
Работа – форма передачи энергии путем упорядоченного движения частиц; различные формы перехода энергии, общей чертой которых является перемещение масс, охватывающих очень большое число молекул (т.е. макроскопических масс), под действием каких-либо сил.
Теплота и работа характеризуются качественно и количественно. Это две различные формы передачи энергии от данной части материального мира к другой. Теплота и работа возникают только тогда, когда происходит процесс, и характеризуют только этот процесс. Термодинамика рассматривает процессы, преимущественно связанные с макроскопическими системами, т.е., системами, состоящими из большого числа молекул. В химической термодинамике изучаются только изолированные и замкнутые системы.
Состояния систем характеризуются параметрами состояния и функциями состояния.
Параметры состояния системы – это свойства, однозначно характеризующие однородные части системы. Например, для идеального газа параметрами являются четыре свойства – давление (P), объем (V), температура (T) и количества молей (μ). Любые три из них – независимы. Задав произвольно любые три из четырех параметров, можно по уравнению состояния (в данном случае это будет уравнение Клапейрона-Менделеева) найти четвертый:
PV= n RT |
(1) |
|
Более сложные системы характеризуются |
дополнительными |
|
параметрами состояния – например, химическим составом.
5
Параметры делятся на интенсивные и экстенсивные. Интенсивные параметры не зависят от количества вещества в системе (например, давление, температура, напряженность электрического поля и др.), а экстенсивные – зависят (например, объем, масса, заряд и др.).
Ктермодинамическим функциям относятся переменные величины, зависящие от параметров состояния, которые не могут быть непосредственно измерены. К ним относятся теплота (Q) и механическая работа (А);
Параметры состояния связаны друг с другом функциональными зависимостями. Функции состояния системы не зависят от происхождения системы.
Кфункциям состояния относятся энтальпия (Н), внутренняя энергия
(U), изобарно-изотермический потенциал (G), изохорно-изотермический потенциал (свободная энергия Гельмгольца F), энтропия (S).
1.2. Термодинамические процессы
Особое значение в термодинамике имеет время, фиксирующее качественные изменения, происходящие в системе. В термодинамике не рассматривается ход процесса, а оценивается только его результат. Результатом в классической термодинамике всегда является равновесное состояние системы и среды. Равновесное состояние характеризуется неизменностью параметров во времени. Одной из основных задач термодинамики является изучение изменения равновесных параметров в ходе термодинамического процесса.
По разным признакам в термодинамике процессы классифицируются следующим образом:
1.По конечному результату – разомкнутые и циклические, в результате которых параметры приобретают исходные значения.
2.По характеру взаимодействия с окружающей средой - обратимые и необратимые. Обратимые процессы не приводят к изменениям в окружающей среде.
3.По характеру протекания - самопроизвольные (происходящие в самой системе) и вынужденные (происходящие в окружающей среде).
4.По условиям проведения процесса - изотермический (при постоянной температуре), изобарический или изобарный (при постоянном давлении), изохорический (при постоянном объеме), адиабатический (без обмена энергией с окружающей средой).
1.3. Первый закон термодинамики
Первый закон термодинамики устанавливает взаимосвязь между теплотой Q, работой А и изменением внутренней энергии системы U.
Формулировки первого закона термодинамики:
-в любой изолированной системе общий запас энергии остается постоянным;
-энергия никуда не исчезает и ниоткуда не появляется; различные виды энергии переходят друг в друга строго эквивалентных количествах;
6
- невозможен вечный двигатель первого рода (Perpetuummobile), то есть невозможно построить машину, которая производила бы работу, не затрачивая на это соответствующее количество энергии.
Существует два понятия, характеризующие механизм передачи энергии от системы к окружающей среде и в обратном направлении. Это - теплота Q и работа А. Ни теплота, ни работа с точки зрения Первого закона термодинамики, не являются функциями состояния системы. Они зависят не только от параметров системы, но и от условий проведения процесса. Их сочетание предопределяет такую функцию системы как внутренняя энергия
U.
Внутренняя энергия системы U – это суммарная энергия всех составных частей системы и их взаимодействий.
Из первого закона термодинамики следует, что полученная системой извне теплота Q расходуется на изменение внутренней энергии U системы и совершение работы А. Математическая запись первого законатермодинамики
в интегральной форме имеет вид: |
|
Q = ΔU + A |
(2) |
В отличие от внутренней энергии, |
теплота и работа являются |
функциями процесса, но не являются функциями состояния системы. Поэтому, математическая запись первого начала термодинамики в дифференциальной форме имеет вид:
δQ = U + δA |
(3) |
где: δQ - бесконечно малое количество теплоты; dU - полный дифференциал внутренней энергии системы; δA - бесконечно малое количество работы.
Под работой, входящей в математическое выражение первого начала термодинамики, понимается общая работа (все виды работ). В связи с тем, что для многих процессов единственным видом работы является работа направленная на изменение внешнего давления, общую работу (δA), принято рассматривать как сумму данного вида работы (РdV) и так называемой
полезной работы (δAʹ): |
|
δA = Р V + δAʹ |
(4) |
Под полезной работой понимают совокупность всех видов работы, за исключением работы направленной на изменение внешнего давления. С учетом этого, математическая запись первого начала термодинамики будет
иметь вид: |
|
δQ = U + δA = U + Р V + δAʹ |
(5) |
В процессах, изучаемых химической термодинамикой, изменяются только кинетическая энергия хаотического теплового движения частиц системы. потенциальная энергия их взаимодействия, обусловленная структурой системы и энергия электронов на атомных и молекулярных орбиталях.
Внутренняя энергия включает потенциальную энергию частей системы. Ее изменение ∆U при изменении состояния системы абсолютно.
7
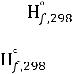
Энтальпия – это функция состояния термодинамической системы, определяющая тепловой эффект изобарического процесса. Она является экстенсивной и аддитивной функцией состояния.
Рассмотрим изобарический процесс (P = const), в котором система переходит из состояния 1 в состояние 2 с тепловым эффектом Qр. Для него:
Q = Qр; ∆ U = U2 – U1; А =P(V2 – V1) |
(6) |
отсюда:
Qр = U2 – U1+ P(V2 – V1) = ( U2 + PV2) – ( U1 + PV1) (7)
Выражения в скобках отражают новую функцию состояния. Такая функция состояния называется энтальпией (H):
H = U + PV |
(8) |
Из проведенного анализа ясно, что: |
|
Qр = ∆Н |
(9) |
Стандартная теплота образования (∆Н0f,298) – величина,
характеризующая тепловой эффект химической реакции образования 1 моля вещества из простых веществ при стандартных условиях.
Индекс f обозначает «formation - образование».
Стандартные условия: Т = 25°С = 298 К, р = 1 атм = 760 мм.рт.ст. =
1,013·105 Па. |
|
Численные значения |
для различных веществ приводятся в |
справочниках. Для простых веществ (N2, O2, H2, Cl2) стандартные теплоты
образования равны нулю ( |
= 0). |
1.4. Закон Гесса
При химических превращениях происходит изменение внутренней энергии системы, обусловленное тем, что внутренняя энергия продуктов реакции отличается от внутренней энергии прореагировавших веществ.
Тепловой эффект реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием исходных веществ и продуктов реакции.
Тепловым эффектом химической реакции называется теплота, выделяемая или поглощаемая в результате реакции при соблюдении следующих условий:
1)объем или давление постоянны (Р=const или V=const);
2)не совершается никакой работы, кроме работы направленной на изменение давления в системе;
3)температура исходных веществ и продуктов одинакова (Т1=Т2).
Тепловой эффект изохорной реакции равен приращению внутренней энергии системы
Qv = ∆U |
(10) |
8
Тепловой эффект изобарной реакции равен приращению энтальпии системы
Qp = ∆H |
(11) |
Положительным будет тепловой эффект эндотермической реакции (протекающей с поглощением теплоты), а отрицательным будет тепловой эффект экзотермической реакции (протекающей с выделение теплоты).
Часто тепловой эффект изохорной реакции обозначают ∆U , а изобарной реакции −∆H. Поскольку при Р=const
∆H = ∆U + Р∆V |
(12) |
то, зная изохорный тепловой эффект ∆U и воспользовавшись уравнением Менделеева-Клапейрона РV=nRT , можно вычислить изобарный тепловой эффект
∆H = ∆U + ∆nRT |
(13) |
где ∆n – приращение числа молей газообразных веществ в результате протекания химической реакции.
Таким образом, если реакция идет без изменения числа молей газообразных веществ, то различием между∆U и ∆H можно пренебречь.
Если реакция протекает в конденсированных фазах (жидкой или твердой), то различием между ∆U и ∆H также можно пренебречь, поскольку изменения объема системы, состоящей из жидких и твердых фаз, в ходе реакции практически не происходит.
Поэтому, при написании термохимических уравнений реакций принято указывать тепловой эффект реакции и агрегатное состояние реагентов: (т) – твердый, (ж) – жидкий, (г) − газообразный.
Значение закона Гесса состоит в том, что он позволяет теоретически, не прибегая к эксперименту, рассчитывать значения тепловых эффектов химических реакций. В термохимических расчетах обычно опираются на ряд следствий из закона Гесса:
1.Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье-Лапласа)
∆Hпр. реакц. = - ∆Hобр. реакц.
2.Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного конечного состояния в другое.
∆H = ∆H2 - ∆H1 |
(14) |
3.Для двух реакций, имеющих одинаковые конечные, но разные исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое.
∆H = ∆H1 - ∆H2 |
(15) |
9
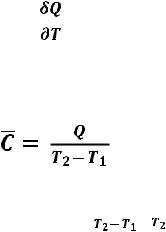
4.Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
∆H = Σ(ni∆Hобр)прод. р. – Σ(ni∆Hобр)исх. в-в |
(16) |
5.Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты.
∆H = Σ(ni∆Hсгор.)исх.в-в – Σ(ni∆Hсгор.)прод.р. |
(17) |
1.5. Теплоемкость
Количество теплоты, подведенное к термодинамической системе, изменение внутренней энергии, энтальпии можно определить по теплоемкости вещества.
Теплоемкость – количество теплоты, необходимое для нагревания 1 кг или 1 моля вещества на 1 К.
Различают удельную и молярную теплоемкость.
Удельной теплоемкостью называется величина равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К.
Молярной теплоемкостью С называется величина, равная количеству теплоты δQ, необходимому для нагревания одного моля вещества на 1 К.
Различают истинную и среднюю теплоемкость.
Истинной молярной теплоемкостью (С) называют отношение бесконечно малого количества теплоты, которое нужно подвести к одному молю вещества, к бесконечно малому приращению температуры, которое при этом наблюдается:
С = |
|
(18) |
|
Средней молярной теплоемкостью  в интервале температур от Т1 до Т2 называют отношение конечного количества теплоты Q, подведенного к одному молю вещества, к разности температур Т2 - Т1:
в интервале температур от Т1 до Т2 называют отношение конечного количества теплоты Q, подведенного к одному молю вещества, к разности температур Т2 - Т1:
(19)
Между истинной молярной и средней молярной теплоемкостью существует связь между: δQ = С Т
Т 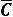 =
= 
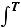
 (20)
(20)
Количество теплоты, подведенное к одному молю вещества в
изохорном и изобарном процессах, соответственно равно: |
|
||
Qv = ΔU |
и |
Qp = Н |
(21) |
В зависимости от условий передачи веществу теплоты различают теплоемкость при постоянном объеме Сv и теплоемкость при постоянном давлении Ср.
10
