
- •Часть 1
- •Набережные Челны
- •Введение
- •Цели и задачи дисциплины
- •Общие методические указания
- •Структура и содержание дисциплины «физика»
- •Раздел 1. Физические основы механики
- •Тема 1.1. Элементы кинематики
- •Тема 1.2. Элементы динамики частиц
- •Тема 1.3. Законы сохранения в механике
- •Тема 1.4. Элементы механики твердого тела
- •Тема 2.3. Ангармонические колебания
- •Тема 3.3. Функциираспределения
- •Тема 3.4. Элементы физической кинетики
- •Тема 3.5. Распределение Гиббса
- •Тема 3.6. Порядок и беспорядок в природе
- •Раздел 4. Электричество и магнетизм
- •Тема 4.1. Электростатика
- •Тема 4.2. Постоянный электрический ток
- •Форма и содержание итогового контроля
- •Методические указания
- •К выполнению контрольной работы № 1
- •Физические основы механики, механические колебания и волны.
- •Основные законы и формулы
- •Примеры решения задач
- •Контрольная работа №1
- •Методические указания
- •К выполнению контрольной работы № 2
- •Статистическая физика и термодинамика
- •Основные законы и формулы
- •Примеры решения задач
- •Контрольная работа № 2
- •Методические указания к выполнению контрольной работы № 3 Электростатика, постоянный ток Основные законы и формулы
- •Примеры решения задач
- •Контрольная работа № 3
- •1. Основные физические постоянные
- •2. Некоторые астрономические величины
- •Часть 1
Методические указания
К выполнению контрольной работы № 2
Статистическая физика и термодинамика
Основные законы и формулы
1. Идеальные газы подчиняются уравнению состояния
Менделеева — Клапейрона
![]()
где P — давление газа; V — его объем; Т— абсолютная температура; m — масса газа; μ, — масса одного моля газа; R = 8,31 Дж/(моль-К); R — газовая постоянная; m/μ — число молей.
2. Количество вещества однородного газа (в молях)
![]() или
или
![]() ,
,
где N —число молекул газа; NA = 6,02• 1023 моль~! — постоянная Авогадро. В смеси нескольких газов количество вещества определится:
ν=ν1+ν2+….+νn=N1/NA+N2/NA+…+ Nn/NA, или ν=m1/μ1+m2/μ2+…+mn/μn
где νi , Ni, mi, μ,I — соответственно количество вещества, число молекул, масса, молярная масса i-й компоненты смеси.
3. Молярная масса смеси газов:
μ=(m1+m2+…+mn)/(ν1+ν2+…+νn),
где
mi
— масса i-го
компонента смеси;
![]() i
—
количество вещества i-го
компонента смеси; n
— число
компонентов смеси,
i
—
количество вещества i-го
компонента смеси; n
— число
компонентов смеси,
4. Массовая доля wi, i-го компонента смеси газа (в долях единицы):
w= mi/m,
где m — масса смеси
5. Концентрация молекул:
n=N/V=NA*ρ/μ,
где N — число молекул, содержащихся в данной системе; ρ — плотность вещества; V — объем системы.
Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
6. Опытные газовые законы, являющиеся частными случаями уравнения Менделеева-Клапейрона для изопроцессов:
а) закон Бойля-Мариотта (T=соnst, m=const — изотермический процесс):
pV=const
или для двух состояний газа:
p1V1=p2V2.
б) закон Гей-Люссака (p = соnst, m=const- изобарический процесс) для двух состояний:
V1/T1=V2/T2;
в) закон Шарля (V=соnst, m=const- изохорический процесс) для двух состояний:
p1/T1=p2/T2;
г) объединенный газовый закон.(m=const):
pV/T=const или p1V1/T1=p2V2/T2,
где p1, V1, T1— давление, объем и температура газа в начальном состоянии: p2, V2, Т2 — те же величины в„ конечном состоянии.
7. По закону Дальтона давление смеси газов равно сумме их парциальных давлений:
p=p1+p2+…+pn,
где n — число компонентов смеси.
Парциальным давлением называется давление газа, которое имел бы каждый газ, входящий в состав смеси, при условии, что при данной температуре он один заполнял бы весь объем.
8. Основное уравнение кинетической теории газов:
![]()
где n —число молекул в единице объема; <εn> —средняя кинетическая энергия поступательного движения одной молекулы; m — масса молекулы; <V2> — среднее значение квадрата скорости.
9. Средняя кинетическая энергия поступательного движения молекулы:
![]()
где k=R/NA=1,38-10-23 Дж/К — постоянная. Больцмана.
10. Средняя полная кинетическая энергия молекулы:
![]()
где i — число степеней свободы молекулы.
Для одноатомного газа i=3; для двухатомного газа i = 5; для многоатомного газа i = 6.
11. Зависимость давления газа от концентрации молекул и температуры:
p=nkT.
12. Скорости молекул:
Средняя квадратичная
![]() .
.
Средняя арифметическая
![]() .
.
Наиболее вероятная
![]() .
.
где m0 — масса одной молекулы.
Относительная скорость молекулы:
u=v/vв,
где v — скорость данной молекулы.
13. Закон распределения молекул по скоростям (закон Максвелла) позволяет найти число молекул ΔN, относительные скорости которых лежат в интервале от u до u + ∆u:
![]()
здесь Δu — величина интервала относительных скоростей, малая по сравнению со скоростью u.
При решении задач на закон распределения молекул по скоростям удобно пользоваться табл. 2:
|
Таблица 2
| |||||
|
и
|
∆N/NΔu |
и
|
∆N/NΔu |
и
|
∆N/NΔu |
|
0
|
0
|
0,9
|
0,81
|
1,8
|
0,29
|
|
0,1
|
0,02
|
1,0
|
0,83
|
1,9
|
0,22
|
|
0,2
|
0,09
|
1,1
|
0,82
|
2,0
|
0,16
|
|
0,3
|
0,18
|
1,2
|
0,78
|
2,1
|
0,12
|
|
0,4
|
0,31
|
1,3
|
0,71
|
2,2
|
0,09
|
|
0,5
|
0.44
|
1,4
|
0,63
|
2,3
|
0,06
|
|
0,6
|
0,57
|
1,5
|
0,54
|
2,4
|
0,04
|
|
0,7
|
0,68
|
1,6
|
0,46
|
2,5
|
0,03
|
|
0,8
|
0,76
|
1,7
|
0,36
|
|
|
Барометрическая формула дает закон убывания давления газа с высотой в поле силы тяжести:
![]() ,
,
где ph— давление газа на высоте h, p0 — давление на высоте h = 0; g — ускорение силы тяжести.
14. Связь между удельной с и молярной Сμ теплоемкостями:
Cμ=c*μ
Удельная теплоемкость газа при постоянном объеме:
![]() .
.
Удельная теплоемкость газа при постоянном давлении:
![]() .
.
15. Внутренняя энергия газа (энергия теплового движения молекул).
![]()
16.Средняя длина свободного пробега молекул газа:
![]() ,
,
где <v> — средняя арифметическая скорость, <z> — среднее число столкновений каждой молекулы с остальными в единицу времени; σ— эффективный диаметр молекулы; n — число молекул в единице объема.
17.Масса, перенесенная за время ∆t при диффузии:
![]()
где ∆ρ/Δх — градиент плотности в направлении, перпендикулярном к площадке ∆S;
D — коэффициент диффузии:
![]() ,
,
где
![]() — средняя скорость;
— средняя скорость;
![]() —
средняя длина свободного пробега
молекулы.
—
средняя длина свободного пробега
молекулы.
18.Количество движения, перенесенное газом за время ∆t, определяет силу внутреннего трения в газе:
![]() ,
,
где Δv/∆x — градиент скорости течения газа в направлении, перпендикулярном к площади ΔS, η — коэффициент внутреннего трения (динамическая вязкость):
![]() .
.
19.Количество теплоты, переносимой за время ∆t в результате теплопроводности:
![]() ,
,
где ΔT/ Δх — градиент температуры в направлении, перпендикулярном к площадке ∆S,
К — коэффициент теплопроводности:
![]() .
.
20.Первое начало термодинамики:
Q=ΔU+A,
Q— теплота, сообщенная системе; ∆U — изменение внутренней энергии системы; A — работа, совершенная системой против внешних сил.
![]() .
.
21.Работа расширения газа:
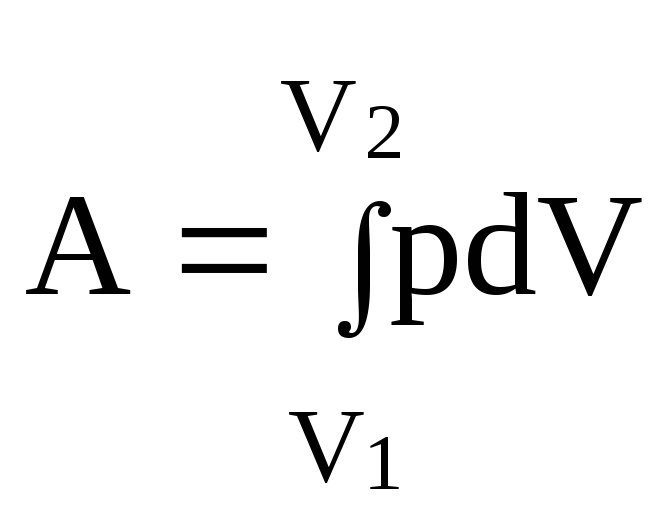 .
.
при изотермическом процессе
![]() ,
,
при изобарическом процессе
A=p(V2-V1),
при адиабатическом процессе
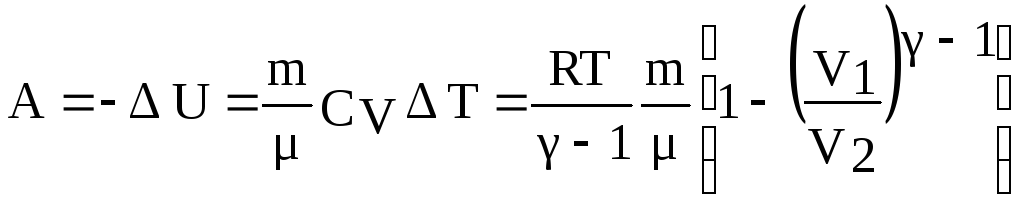 ,
,
где γ=Cp/CV— показатель адиабаты.
22. Уравнение Пуассона, связывающее параметры идеального газа при адиабатическом процессе:
PVγ=const или TVγ-1= const
23.Коэффициент полезного действия тепловой машины:
![]() ,
,
где Q1, — теплота, переданная рабочему телу; Q2 — теплота, отданная теплоприемнику.
Термический КПД цикла Карно
![]()
где T1—температура теплоотдатчика; Т2 — температура теплоприемника.
24. Разность энтропии двух соcтояний В и А:
![]() .
.
25. Коэффициент поверхностного натяжения:
α=F/l или α =ΔE/∆S,
где F — сила поверхностного натяжения, действующая на контур l , ограничивающий поверхность жидкости; ΔE— изменение свободной энергии поверхностной пленки жидкости, связанное с изменением площади ∆S поверхности этой пленки.
26.Формула Лапласа, выражающая давление, создаваемое сферической поверхностью жидкости:
P=2α/R,
где R — радиус сферической поверхности.
27.Высота подъема жидкости в капиллярной трубке:
H=2αcosθ/ρgR,
где θ --краевой угол (θ= 0 при полном смачивании стенок трубки жидкостью; θ=π при полном несмачивании); R — радиус трубки; ρ — плотность жидкости; g— ускорение силы тяжести (g = 9,81 м/с2).
Высота подъема жидкости между двумя близкими и параллельными друг другу плоскостями:
H=2αcosθ/ρgd
d — расстояние между плоскостями.
