
- •I. Ізотермічна кондуктивна калориметрія
- •International thermal instrument company представила серію калориметрів cr-100 для точного вимірювання тепловиділень радіоізотопів [9].
- •I. 1. Ізотермічні (ізопериболічні) титраційні калориметри
- •I. 2. Ізотермічні реакційні калориметри
- •3. Реакційний калориметр теплового балансу [158]
- •4. Калориметри Пельтьє [158]
- •II. Адіабатичні калориметри
- •III. Диференційні скануюча калориметри
- •Програмне забезпечення контролю Pyris
- •IV. Високотемпературна калориметрія
- •VI. Калориметри високого тиску
- •VII. 2. Дуже чутливий калориметр зеебека
- •VIII. Ac калорметрія пельтьє
- •2. Точковий калориметр Пельтьє
- •IX. Методи і результати використання калориметрії зеебека
- •X. Компенсаційні калориметри для визначення ефективності болометрів і вимірювання потужності лазерних діодів
- •Fig. 149 Коефіцієнт s і загальна радіаційна потужність p, у залежності від ld вхідного струму Il [242]
- •Список використаної літератури
IV. Високотемпературна калориметрія
Обговорюються методи високотемпературної калориметрії. представлені два типи ізопериболічних калориметрів змішування. Вони дозволяють прямо визначати ентальпію змішування рідких сплавів як функцію концентрації і температури і вимірювати відхилення значення функції концентрації в температурному діапазоні від 1300 К і 2000 K, відповідно. Розроблений високотемпературний калориметр розчину, в якому рідкий метал використовується як термостат (максимальна температура 1800 K) і може бути використана для визначення тепла утворення твердих сплавів і визначення часткової ентальпії змішування кожної із компонент розчину. Із крапельним калориметром є можливість вимірювати термодинамічні властивості високо реактивних систем сплавів. Термодинамічні вимірювання високотемпературних сплавів і металів до 4000 К можуть бути досягнуті із левітаціною калориметрією [95].
Калориметр змішування [95]. Для визначення інтегральної ентальпії змішування (ΔH) рідких сплавів дуже підходить ізотермічний калориметр. Експериментальне конструювання цього калориметра наведене на рис. 1. дозволяє пряме вимірювання ентальпії змішування ΔH рідких компонент при температурах до 1300 K. Два тиглі (1) і (2) є необхідними, вони містять дві рідинні компоненти при температурі вимірювання. Обидва тиглі розміщені в блоці із нержавіючої сталі, що має декілька масивних сегментів (3). Завдяки масивному калориметричному блоку мінімізовані температурні градієнти, що виникають в центральній частині довгої печі (4). Температурний градієнт всередині печі може бути зменшений трьома нагрівними кільцями (Kanthal). Температурна рівність між верхнім і нижнім тиглями після стабілізації системи вимірюється термопарами (5). Мішалка (6) гарантує повне швидке змішування компонентів. Зміна температури, що виникає протягом процесу змішування визначається термопарою на основі Ni-NiCr прямо (7) [95].
Калібровані зразки протягуються через калібровану трубку (8) в реакційний тигель. Є можливим досягнення стандартної похибки ± 1 % для калібраційного множника. Вибір матеріалу для тиглів залежить від системи сплавів, що досліджується (e.g. глинозем, графіт, нітрид бору, залізо). Калориметричний блок є підвішеним в реакційній трубці (9) що закриті зверху і знизу. Оскільки реакційна трубка зроблена із нержавіючої сталі, є можливим підтримувати калориметр очищеним від кисню методом евакуації, нагрівання і видування аргоном перед початком вимірювання в атмосфері аргону. Три радіаційні екрани розміщені вище калориметричного блоку для зменшення флуктуацій газу аргону і тепловтрат через радіацію. Зразки подані за умови невеликого надлишкового тиску аргону із використанням кварцової клапанної камери у вершині додаткової і калібраційної трубок (11). Переваги конструкції показані на рис. 1 і вони полягають в тому, що, верхній тигель (2) може бути перезавантаженим після довільного вимірювання. Отвір тигля є закритий штопором (10) і друга компонента подається через додаткову трубку. Для декількох концентрацій сплаву ΔH може бути визначена цим шляхом єдиним експериментальним методом моделювання усіх ефектів. Якщо зміна концентрації є малою для кожного вдалого кроку (i.e. < 1 at.%), також dΔH(x)/dx може бути визначене за допомогою апроксимації
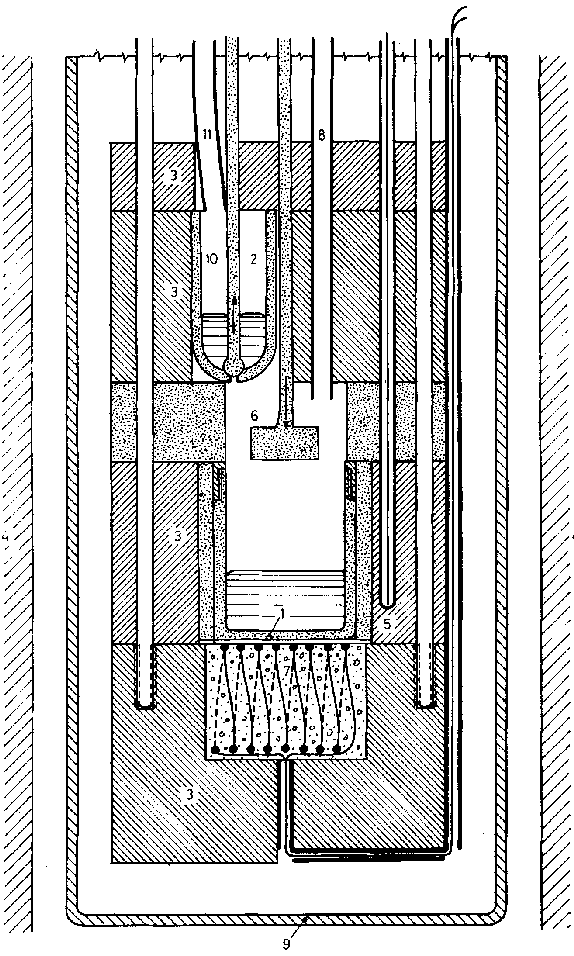
Рис. 93. Високотемпературний калориметр змішування [95]
![]() (1)
(1)
ΔH
(x)
і
dΔH
(x)/dx
криві для рідкого сплаву In-Sb [7] показані
на рис. 2 a, b, наприклад. Із ΔH (x,T) вимірювань
можна також визначити надлишкове молярне
тепло
![]() can be derived via
can be derived via
![]() (2)
(2)
із f = (T2 - Ti) /2. Рис. 2c показує ΔCP криві для того ж самого сплаву [111].


а) b)
Рис. 94. а) Ентальпія змішування рідкого сплаву In-Sb при 953 К [97, 110]; b) Похідна ентальпії змішування рідкого сплаву In-Sb при 953 К [97, 110]
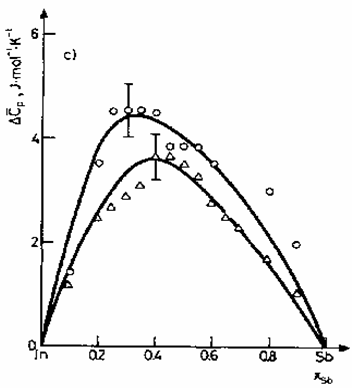
Рис. 94с. Значення надлишкового молярного тепла рідких сплавів In-Sb [111] (○ при 971K, ∆ при 1158K) [97, 111]
Експериментальна інформація для ΔCP і dΔH(x)/dx є особливо корисною для дослідження тенденції хімічного ближнього порядку в рідких сплавах із тенденціями створення компаундів [18]. Навіть в системах із слабкими тенденціями створення компаундів таких, як в Sb—Sn розплавах сплавів, завдяки малим величинам ΔH (< —1.5кДж/моль), може бути отримана інформація про величину ΔCp (Рис. 3). Величини ΔH/xSbxSn показує відхилення від звичайної поведінки розчину.
Якщо компоненти сплаву мають високий тиск парів вище точки плавлення і якщо вони є особливо чутливими до кисню, наприклад Li, Mg, Ca or Sr, може бути використаний спеціальний дизайн тигля [113]. Два опозиційні тиглі із Fe підігнані одна до одної через роботу спеціального гвинта оскільки тигель для реакції відлитий із танталової фольги і окислення, так само як і випаровування компонентів протягом загрузки зразка із жаргонної посудини і процес нагріву калориметрів може бути уникнений. Видаленням танталових фольг із мішалкою починається процес змішування.

Рис. 95 Надлишок молярного тепла сплаву Sb-Sn при 988 К і ∆H(x,T)/xSbxSn ( ○ при 968 К, ∆ при 1108 К) [112]
Високотемпературний калориметр розчину [95]. Ентальпія формування ΔHfAxBy твердих сплавів може бути виміряна розчинним калориметром аналоговим способом подібно до визначення ΔH із використанням того самого калориметра. При кімнатній температурі зразки твердих сплавів і компоненти поміщені в калібраційну трубку в заданому термостаті (наприклад, що містить рідкий алюміній). Експериментальні результати для теплових ефектів розчину ΔHE екстрапольовані до xAl=1 для отримання теплових ефектів незалежного розчину ΔHE,O. Величини ΔHf компаундів при кімнатній температурі обчислені прямо із цих величин ΔHE,O.
![]() (3)
(3)
Часткова
ентальпія змішування при незалежному
розкладі на складові частини
рідинних
компонент
A
і
В
в
рідинному металічному термостаті
![]() може
бути отримана виділенням тепловмісту
елементів
між
кімнатною температурою
і
температурою розчмну експерименту із
може
бути отримана виділенням тепловмісту
елементів
між
кімнатною температурою
і
температурою розчмну експерименту із
![]() .
Таблиця
1 показує
результати для деяких технологічно
важливих інтерметалічних фаз
із
дуже низькою стандартною похибкою.
.
Таблиця
1 показує
результати для деяких технологічно
важливих інтерметалічних фаз
із
дуже низькою стандартною похибкою.
За допомогою калориметра визначене тепло утворення інтерметалічних сплавів Ni-Al і Fe-Al, а також Fe-Si інтерметалічних фаз при кімнатній температурі, а також ентальпії розчинення Ni, Fe і Si в рідкому Al [95 ].
Табл. 1. Теплоформування Ni-Al, Fe-A1, Fe-Si інтерметалічних фаз при кімнатній температурі і частокових ентальпій незалежних розчинень Ni, Fe і Si в рідкому A1 [ 11 ].
|
|
ΔHf кДж×моль-1 |
ΔHO кДж×моль-1 |
|
Fe0,75Al0,25 |
-14,1±1,1 |
ΔHONi= -153,3±1,1T=1023K |
|
Ni75Al25 |
-37,3±2 |
ΔHOFe= -123,3±1,6T=1073K |
|
Ni76Al24 |
-37,6±1,7 |
ΔHOSi= -14,2±0,4T=1073K |
|
Fe3Si |
-25,8±2 |
|
Схематична конструкція калориметру розчину, що працює до температур 1800 К показана на рис. 45. Додаток зразка розміщений всередині калориметра у вакуумі чи аргонній атмосфері. Використаний контейнер, що обертається із 36 отворами для додавання калібрацій них зразків і компонент компаунду, відповідно. Молібденовий калориметричний блок (1) підвішений в алюмінієвій реакційній трубці (7) і (1) а також (7) що підтримується при постійній температурі зони в родієвій печі (8). Термопара на основі PtRh6-PtRh30 (2) і алюмінієвий реакційний тигель доповнюють калориметр (2).

Рис. 96 високотемпературний калориметр розчину: 1) молібденовий блок 2) реакційний тигель 3) PtRh6-PtRh30 термопара 4) мішалка 5) додаткова трубка 6) термопара 7) A12O3 реакційна трубка 8) родієва піч [95].
При високих температурах рідкий сплав може бути використаний як термостат для розчинів тугоплавких компаундів і компонент. Чисті метали не є корисними при високих температурах через високий тиск парів і через малу розчинність компонент і компаундів. Для визначення ΔHf- для Ni2Ta і CrNiTa рідинний сплав Cr50Nis0 при 1700 К використаний як термостат [95, 96].
Калібрування зроблене додаванням почергово зразків Cr і Ni. Зміна ΔH (х) для рідких сплавів CrNi становить дуже малу величину порівняно до тепловмісту каліброваних зразків. Результати отримані із рівняння (3) становлять
ΔHfCrNiTa=-17,9±2кДж×моль-1, ΔHfNi2Ta=17,9±2кДж×моль-1,
Із додатковими результатами ентальпії розплаву ΔHm інтерметалічної фази є можливим розрахувати додатково ΔH рідких сплавів при температурі плавлення компаунда конгруентного плавлення Tm для складу компаунду
![]() (4)
(4)
Де
![]() є екстрапольованими ентальпіями
плавлення при Tm. Величина ΔH отримана
із рівняння (4) дозволяє перевірити
результати, що отримані із прямими
вимірюванням ΔH наприклад, за допомогою
калориметра, даного на рис. 1.
є екстрапольованими ентальпіями
плавлення при Tm. Величина ΔH отримана
із рівняння (4) дозволяє перевірити
результати, що отримані із прямими
вимірюванням ΔH наприклад, за допомогою
калориметра, даного на рис. 1.
Високотемпературний калориметр змішування. Високотемпературний калориметр, основане на принципах чисельного диференційного аналізу для вимірювання ΔH рідинних сплавів, недавно покращене вимірювання до 1900 К [95, 114]. Конструкція калориметра показана схематично на рис. 5. Висока температура отримана за допомогою молібденового коротко замкнутого нагрівача. Компоненти нагрівача і калориметра розміщені в контейнері, що охолоджується водою (7). Принцип роботи співпадає із принципом роботи калориметрів, що описані вище. Два контейнери, що обертаються із 48 отворами для додавання зразків. Три термопари (PtRh6-PtRh30) контролюють температуру тобто, одна в реакційному тиглі, а інша в референтному молібденовому блоці і третя в верхньому тиглі. Вимірювання має проводитись у вакуумі. Дані про ΔH для рідких сплавів Fe-Sn отримані при 1820 К проказані на рис. 6. Позитивні величини для ΔH показують тенденцію сегрегації цих сплавів в рідкому стані. Підбір даних може бути отриманий в залежності від квазіхімічної апроксимації заміщеннями молярних фракцій атомними поверхневими концентраціями [95, 114].
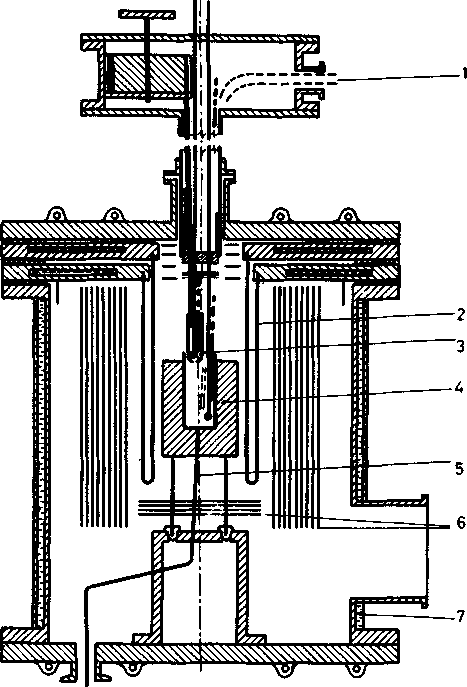
Рис. 97 Високотемпературний калориметр для визначення ентальпії змішування при температурах до 1900 К [13]. 1) канал додавання зразку 2) молібденовий коротко замкнутий нагрівач 3) додатковий тигель із штопором 4) молібденовий блок із реакційним тиглем, мішалка і термопара 5) референтна термопара 6) радіаційний екран 7) охолоджуваний водою вакуумний контейнер.
Крапельна калориметрія. Пряме вимірюваня ΔH (x,T) за допомогою змішування чистих рідинних компонент є часто неможливим оскільки одна із компонент наприклад лужний метал завдяки високому тиску парів і високій реакційності цього металу. Із використанням крапельного калориметра тепловміст і ΔH m. може бути визначеним. Це, між іншим, вимагає, однакового кінцевого стану при досягненні кімнатної температури. Згідно із фазовою діаграмою ці умови застосовані тільки до складу компаундів конгруентного плавлення. Експериментальний апарат в основному складається із печі для нагріву зразків до температури вимірювання і калориметра, що працює при кімнатній температурі для вимірювання тепловмісту. Сплави містяться в близько розташованих молібденових ампулах. Для калібрацій контейнер зразку заповнений оловом і цей олов’яний зразок вимірюється разом із зразком сплаву при кожній температурі [14]. Рис. 7 показує результати для теплових компонент сплаву Li7Pb2. Із використанням даних Cp для Li і Pb надлишкове молярне тепло для рідинного Li7Pb2 сплаву становить ACp = 15.7 ± 2.4 J тоГ1 К-1 (1004 К < T < 1110 К), що підтверджує сильну температурну залежність ΔH для цих систем сплавів. Із величини ΔHm і ΔHfLi,Pb=-31,4±1,7кДж/моль отриманих калориметрією розчину, величина для ΔH обчислена із рівняння Eq. (4) становить —31 ± 2.5 kJ mol-1. Величина ΔH, що виміряна прямим змішуванням компонент становить -29 ± 1.4 kJ mol-1 [15]. Підтверджуючи експериментальну неточність порівняння показує внутрішню постійність ΔHm, ΔHf і ΔH отриманих різними калориметричними методами.
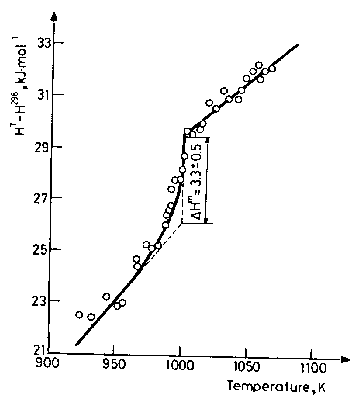
Рис. 98. Тепловміст Li7Pb2
Левітаційна
калориметрія змішування.
Резистивний
підігрів за допомогою рідинних провідників
встановлює верхню температурну границю
до 2000 К для калориметричних пристроїв
конденсованого типу. Використання
терміну "левітаційна калориметрія"
що є левітаційним апаратом плавки із
крапельним калориметром, перейде цю
межу. Металічний зразок
є
левітованим
і в
той же час, нагрітим
без
будь-якого контакту змінним електромагнітним
полем.
Температура
вимірюється із використанням пірометра.
Із
добре відомою технікою
CP-величини
тугоплавких
сплавів можуть бути виміряні в рідкому
і твердому стані.
Frohberg
et
al.
[16] розвинули
метод також вимірювання
ΔH
і
![]() рідких
рефракторних сплавів.
Зразки
для сплавляння є змішаними за допомогою
левітаційної спіралі.
Малі
рідинні компоненти
скапуються
на більші рідинні компоненти
рідинного
зразка. Із
температурної зміни левітації
і
сплавленого зразка
рідких
рефракторних сплавів.
Зразки
для сплавляння є змішаними за допомогою
левітаційної спіралі.
Малі
рідинні компоненти
скапуються
на більші рідинні компоненти
рідинного
зразка. Із
температурної зміни левітації
і
сплавленого зразка
![]() чи
ΔH
(x)
може
бути обчислене із використанням величин
Cp
-
компонент.
Для
змішування двох рідинних компонент
використана
подвійна левітаційна спіраль
(Fig.
8) застосування
якої є дорогим
і
обмеженим вибором системи.
Як
альтернатива
може
бути використана техніка без розплаву,
що
передбачає розплав основного металу і
підтримання його в левітації.
Крапля
компоненту сплаву отримується його
розплавом в циліндричному твердому
зразку із використанням індукційного
нагріву
(Рис.
8). Температурні
вимірювання розплавленої краплі
показують
відсутність
відхилень від відповідної температури
розплаву.
Третій
метод є поєднанням
твердої
другої компоненти
із
краплею в умовах левітації.
Результати
отримані для сплавів
Mo-Si
в
діапазоні температур від
2960 K
до
3224 K
і
показані на
Рис.
9 [115].
Похибки
для ΔH
(x)
і
чи
ΔH
(x)
може
бути обчислене із використанням величин
Cp
-
компонент.
Для
змішування двох рідинних компонент
використана
подвійна левітаційна спіраль
(Fig.
8) застосування
якої є дорогим
і
обмеженим вибором системи.
Як
альтернатива
може
бути використана техніка без розплаву,
що
передбачає розплав основного металу і
підтримання його в левітації.
Крапля
компоненту сплаву отримується його
розплавом в циліндричному твердому
зразку із використанням індукційного
нагріву
(Рис.
8). Температурні
вимірювання розплавленої краплі
показують
відсутність
відхилень від відповідної температури
розплаву.
Третій
метод є поєднанням
твердої
другої компоненти
із
краплею в умовах левітації.
Результати
отримані для сплавів
Mo-Si
в
діапазоні температур від
2960 K
до
3224 K
і
показані на
Рис.
9 [115].
Похибки
для ΔH
(x)
і
![]() -становлять
від 10 до
20%. Ці
методи обмежені системами із металічними
розчинниками
і
показують відповідні екзотермічні і
ендотермічні реакції.
-становлять
від 10 до
20%. Ці
методи обмежені системами із металічними
розчинниками
і
показують відповідні екзотермічні і
ендотермічні реакції.

Рис. 99 Ексепериментальна установка для комбінації твердих і рідких зразків із рідинним розчинником [95, 115]: 1) левітаційна спіраль 2) рідинний розчинник 3) друга компонента 4) тефлоновий ізолятор 5) коротко замкнутий нагрівач 6) циліндричний зразок 7) система охолодження води.
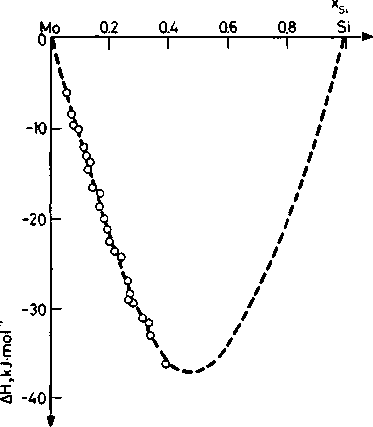
Рис. 100 Ентальпія змішування рідкого сплаву Mo-Si у температурному діапазоні між 2960 К і 3224 К [95, 115].
