
- •I. Ізотермічна кондуктивна калориметрія
- •International thermal instrument company представила серію калориметрів cr-100 для точного вимірювання тепловиділень радіоізотопів [9].
- •I. 1. Ізотермічні (ізопериболічні) титраційні калориметри
- •I. 2. Ізотермічні реакційні калориметри
- •3. Реакційний калориметр теплового балансу [158]
- •4. Калориметри Пельтьє [158]
- •II. Адіабатичні калориметри
- •III. Диференційні скануюча калориметри
- •Програмне забезпечення контролю Pyris
- •IV. Високотемпературна калориметрія
- •VI. Калориметри високого тиску
- •VII. 2. Дуже чутливий калориметр зеебека
- •VIII. Ac калорметрія пельтьє
- •2. Точковий калориметр Пельтьє
- •IX. Методи і результати використання калориметрії зеебека
- •X. Компенсаційні калориметри для визначення ефективності болометрів і вимірювання потужності лазерних діодів
- •Fig. 149 Коефіцієнт s і загальна радіаційна потужність p, у залежності від ld вхідного струму Il [242]
- •Список використаної літератури
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
НАЦІОНАЛЬНА АКАДЕМІЯ НАУК
ТЕРМОЕЛЕКТРИЧНА КАЛОРИМЕТРІЯ
(Огляд статей про стан ТЕ калориметрії за останні 30 р.)
Підготував: Працівник відділу
Науково-технічної інформації,
м. н. с. Шевадзуцький А.О.
Чернівці 2010
ЗМІСТ
-
ВСТУП……………………………………………………..
2
I. ІЗОТЕРМІЧНА КОНДУКТИВНА КАЛОРИМЕТРІЯ…………………………………………….
3
I. 1. Ізотермічні (ізопериболічні) титраційні калориметри……….
27
I. 2. Ізотермічні реакційні калориметри…………..
61
II. АДІАБАТИЧНІ КАЛОРИМЕТРИ ………………..
80
III. ДИФЕРЕНЦІЙНІ СКАНУЮЧІ КАЛОРИМЕТРИ …………………………………………….
99
IV. ВИСОКОТЕМПЕРАТУРНА КАЛОРИМЕТРІЯ
124
VI. КАЛОРИМЕТРИ ВИСОКОГО ТИСКУ……….
132
VII. ВИСОКОТОЧНА МІКРОКАЛОРИМІЕТРІЯ: АПАРАТИ, ПРОЦЕДУРИ (ізопериболічний калориметр)………………………………………………….
139
VII. 2. ДУЖЕ ЧУТЛИВИЙ КАЛОРИМЕТР ЗЕЕБЕКА……………………………………………………….
144
VIII. AC КАЛОРМЕТРІЯ ПЕЛЬТЬЄ………………..
151
IX. МЕТОДИ І РЕЗУЛЬТАТИ ВИКОРИСТАННЯ КАЛОРИМЕТРІЇ ЗЕЕБЕКА…………………………………
154
IX. 1. Опис чутливого калориметра Зеебека для дослідження холодного синтезу…………………………...
164
X. Компенсаційні калориметри для визначення ефективності болометрів і вимірювання потужності лазерних діодів…………………………………………………
171
ВИСНОВКИ………………………………………………
181
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ …………..
182
ВСТУП
В представленому огляді розглянуто конструкції і призначення термоелектричних калориметрів, що були запропоновані авторами статей за останні 30 років.
Складання огляду створює цілісну картину про стан справ в термоелектричній калориметрії і дозволяє шляхом аналізу визначити перспективні напрямки її розвитку.
I. Ізотермічна кондуктивна калориметрія
Автором роботи [1] запропоноване використання ізотермічного калориметра як частини калібрувальної системи для пристрою вимірювання потужності електромагнітних хвиль радіочастотного діапазону 10 МГц до 18 ГГц.
Описаний термопарний калориметр [2], призначений для вивчення теплового ефекту гідрування гіпсу (кальцій сульфат хемігідрат CaSO4×0,5H2O). Часова залежність тепла гідрації β-кальцію сульфату хемігідрату виготовленого із нагрітого газом десульфурізованого гіпсу визначена із використанням двох типів калориметрів, диференціального калориметра DIK 04 і ізотермічного кондуктивного калориметра KC 01, проаналізована відмінність в отриманих даних.
Калориметр KC 01 є ізотермічним кондуктивним калориметром із диференційним вимірюванням теплового потоку детекторами, що виготовлені на основі мідь-константанових термопарних колон, розміщених на пластині діелектрика. Детектори на трубці, де проходить гідраційний процес з’єднані диференційно із детекторами для визначення теплового потоку в референтній посудині, де не проходить гідраційний процес. Калібраційна константа для калориметра становить 14 мВт/мВ. Постійна часу (час роботи) порядка 40 – 60 сек. У випадку гідрування 1 г. кальцію сульфату хемігідрату максимальна вихідна напруга становить 10 мВ. Температура реєструється через інтервали в 15 сек [2].
Новий калориметр [3] сконструйований для вимірювання ізостеричних кількостей тепла від адсорбції газових сумішей для одночасних вимірювань навантаження і складу. Комбіновані вимірювання при одній довідковій температурі забезпечують повну термодинамічну інформацію про поведінку рівноваги в бінарній суміші. Компоненти бінарної суміші дозовані почергово таким чином, що індивідуальні ізостеричні теплоти можуть бути визначені із двох послідовних вимірювань. Необхідність встановлення рівноваги протягом 30 хвилин за допомогою додавання певної порції газу, що накладає певні обмеження на конструювання комірки зразка. Досягнення рівноваги було перевірене зміною порядку контакту компонент суміші. Суміш рівноважної газової фази визначена із протікаючим клапаном до масового спектрометра для мінімізації збурень у системі.
Для представлення експериментальних результатів, було б доцільно якщо одна із змінних, таких як загальний тиск чи летючість однієї із компонент була б утримана у вигляді постійної величини [3]. Проте, необхідність альтернативних кількостей генерує траєкторії, що подібні до замкнутих кругів. Неможливість отримання даних вздовж такої кривої, як ізобари є прикрим, проте не впливає негативно на аналіз експериментальних даних для коефіцієнтів активності і надлишкових функцій. Після покриття всієї фазової діаграми для бінарної суміші зміною надлишку чистої компоненти, модель, яка підбирає експериментальні дані може бути використаною для генерації кривої, такого як ізобара чи постійна навантаження однієї компоненти. З того часу, як перші вимірювання теплоти адсорбції із бінарних сумішей були відзвітованими в 1997 для CH4 і C2H6 в силікаті і для CO2 і C2H6 в NaX, нами завершені експерименти для чотирьох інших бінарних структур, одна з яких розглядається в цій роботі (SF6 і CH4 на NaX) [3]. На сьогоднішній день, нами обчислені надлишкові термодинамічні властивості для цих речовин, особливо коефіцієнти активності фази адсорбції. Це становить інтерес, оскільки всі надлишкові функції є негативними: коефіцієнт активності є меншим за одиницю, і тепло змішування є екзотермічним у кожному випадку [3].
В [3] розглянуті Критерії конструювання. Необхідною рівновагою інформації для адсорбованих сумішей є тиск і склад суміші газу на адсорбенті для даного навантаження, так само як і тепло, що виділяється для диференціального росту навантаження. Оскільки в [3] припускають, що прямі, калориметричні вимірювання диференційного тепла будуть більш надійними, аніж диференціація ізотерм при різних температурах, інструментарій був збудований навколо калориметра Тіана-Кальве. Практичні обмеження на можливість інтегрування теплового потоку в калориметрі, як функції часу вимагають представлення рівноваги протягом 30 хв. або менше. Для того, щоб перешкодити значним збуренням системи протягом вимірювання, ми використали квадрупольну масу спектрометра.
Необхідність представлення рівноваги в інтервалі 30 хв зміни навантаження зразка надає дуже строгі обмеження на дизайн. По-перше, виключається адсорбційна система, для якої дифузія однієї із компонент є надто повільною для представлення швидкої рівноваги. Для більшості системних важливих параметрів в PSA, що вимагає оборотної адсорбції, це не є строгим обмеженням. Для мінімізації концентрації градієнтів в зразковому стенді, тонкий шар адсорбенту (~3мм) розміщений на дні калориметричної комірки. На додачу до мінімізацій часу дифузії всередині стенда, використання тонкого шару адсорбена в bed (комірці) також зменшує час, що необхідний для генерації тепла адсорбцією для збирання термопарами як стінками посудини. Розмір калориметричної комірки, становить 1 куб. дюйм, що відображає компроміс між чутливістю інструмента, що зростає із кількістю адсорбента, і величиною вирівнювання, що зменшується із зменшенням розміру комірки. Вирівнювання в межах адсорбентної комірки є швидким для вказаної конфігурації: основуючись на типовому коефіцієнті дифузії Кнудсена величиною в 0,01см2/сек. для змішування газової фази і основи зразка час змішування становить 9 сек. Коли коефіцієнти дифузії в межах часток визначаються адсорбентами, і можуть бути набагато меншими, аніж коефіцієнти Кнудсена, а саме для цеоліту, розмір кристалу, що утворює типовий цеолітовий зразок є надто малим. Навіть, якщо кристаліти порядку 1мм, коефіцієнти дифузії могли б мати значення надто нижче, аніж 10–8 см2/сек. для змішування, що є обмежуючим фактором рівняння. Основне обмеження для досягнення адсорбційної рівноваги є газова фаза, що змішується в районі над зразком. На основі типової газової фази коефіцієнт дифузії становить 0,1см2/сек., довжина трубки навіть 10 см дасть результат у часі змішування 1000 сек. Це опускає значні зміни в конструюванні інструменту. Якщо припустити, що циркуляція могла б зменшити цю проблему, підсилений потік також доповнює конструювання калориметра, через втрати тепла шляхом конвекції. Максимальна відстань між нашими апаратами (від дна комірки зразка до діафрагми передавача тиску) становила приблизно 10 см. Передавач тиску для його малого мертвого об’єму. Пропускний клапан для композиційних вимірювань був приварений прямо на верху комірки для мінімізації розмірів апарату. Ці критерії дизайну могли тільки бути узгодженими із калориметрами, що зроблені на замовлення. Загальна ціна апарату, основними елементами якого є остаточний газовий аналізатор (residual gas analyzer, RGA), передавач тиску, термопари, і комп’ютер, становить приблизно $20,000.
Теорія, розглянута автором [3]. Ізотеричне тепло адсорбції визначається різницею між частковими (питомими) молярними ентальпіями в газі і адсорбованій фазі є визначене як різниця часткових молярних ентальпій в газі і адсорбованих фазах:
![]() (1)
(1)
Таким чином, Qst є тепло десорбції, навіть якщо це не є тепло, а різниця двох функцій стану, проте така назва добре підходить. Фактична теплота, що вимірюється в даному калориметрі, може бути віднесена до термодинамічного визначення ізотеричного тепла [3].
Ідеалізований калориметр. Ідеалізований калориметр складається із комірки дозування, комірки зразку, і клапана між коміркою дозування і коміркою зразку повністю підтримуваного в ізотермічному калориметрі при температурі T0. На початку, клапан є закритим, обидві комірки знаходяться при температурі T0, тиск в колі дозування становить Pd, тиск в комірці зразку становить Pc, при умові Pd > Pc. Коли клапан є відкритим, зростаюча кількість газу розширюється від комірки дозування в комірку зразка і певна порція цього газу адсорбується. Загальна енергія становить [3]
![]() (2)
(2)
Загальна енергія U включає енергію адсорбенту, стінок комірки зразка і комірки дозування, і клапана. Проте, з моменту, коли температура фіксується при значенні T0, значення цих енергій нехтується в рівнянні 2 тому, що вони є постійними і не вносять влад в зміну енергії. Загальна кількість газу в обох комірках становить ng. Зміна загальної енергії позначена dU
![]() (3)
(3)
dU
відноситься до диференціальної енергії
зміни після досягнення адсорбційної
рівноваги. Через те, що температура
становить T0
перед і після адсорбції,
![]() і
і
![]() (4)
(4)
Баланс маси становить
![]() (5)
(5)
таким
чином:
![]() (6) При підстановці рівняння 6
в
рівняння 4:
(6) При підстановці рівняння 6
в
рівняння 4:
![]() (7)
(7)
Перший закон для складних замкнутих систем що складаються із дозаторної комірки, комірки зразка, і клапана є
![]() (8)
(8)
де dQ є теплом, адсорбованим у складній системі. Для адсорбції, dQ є негативною величиною. Об’єднуючи рівняння 7 і 8
![]() (9)
(9)
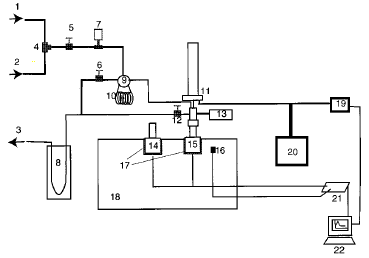
Рис. 1. Схематичне зображення калориметра і допоміжного обладнання [3]
Табл. 1. Позначення на рис. 1.
|
№ |
Опис |
Модель |
|
1 |
Вхідний патрубок газу 1 |
|
|
2 |
Вхідний патрубок газу 2 |
|
|
3 |
До вакуумного насосу |
|
|
4 |
Тритрубчастий клапан |
|
|
5 |
Вхід клапана до кола дозування |
|
|
6 |
Вихід клапана із кола дозування |
|
|
7 |
Перетворювач тиску для кола дозування |
MKS626A |
|
8 |
Контур зрідженого азоту |
|
|
9 |
Шеститрубчастий клапан Valco |
|
|
10 |
Каліброване коло дозування (10 см3) |
|
|
11 |
Клапан керування потоком |
Granville-Philips 203 |
|
12 |
Комірка виходу клапана |
|
|
13 |
Перетворювач тиску для комірки |
Omega PX425 |
|
14 |
Референтна комірка |
|
|
15 |
Калориметрична комірка |
|
|
16 |
Термопара К-типу |
|
|
17 |
Термопари |
International thermal instrument C-783 |
|
18 |
Теплостік (Алюмінієвий блок) |
|
|
19 |
Мас спектрометр (RGA) |
Leybold Inficon TSP C100F |
|
20 |
Турбонасос |
Balzers TSU062 |
|
21 |
Борт збору даних |
|
|
22 |
Комп’ютер |
|
або
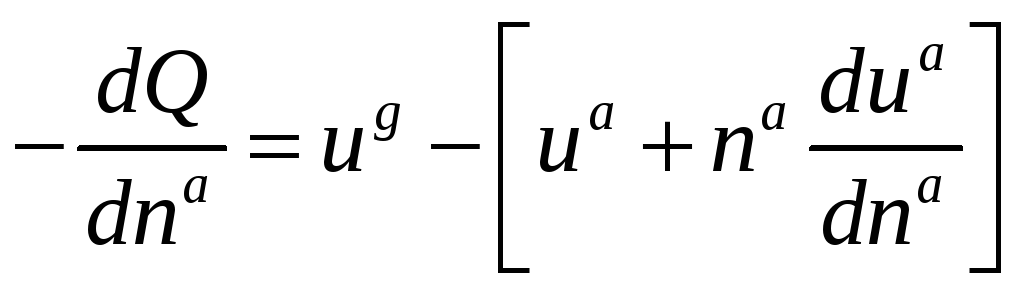 (10)
(10)
оскільки
![]() ,
,
![]() ,
то із порівнянь співвідношень 1 і 10
отримують:
,
то із порівнянь співвідношень 1 і 10
отримують:
![]() (11)
(11)
де
![]() є
диференційним теплом, що вимірюється
ідеалізованим калориметром,
є
диференційним теплом, що вимірюється
ідеалізованим калориметром,
![]() є різницею між ентальпією і внутрішньою
енергією рівноважної газової фази. z
визначається як
є різницею між ентальпією і внутрішньою
енергією рівноважної газової фази. z
визначається як
![]() ,
фактор стиску в газовій фазі є близьким
до одиниці для субатмосферних вимірювань
ізотеричного тепла. RT0
при
температурі 25ºС становить 2,5кДж/моль,
типове ізотеричне тепло адсорбції
становить 10 – 50 кДж/моль.
,
фактор стиску в газовій фазі є близьким
до одиниці для субатмосферних вимірювань
ізотеричного тепла. RT0
при
температурі 25ºС становить 2,5кДж/моль,
типове ізотеричне тепло адсорбції
становить 10 – 50 кДж/моль.
Практичний калориметр [3]. В ідеалізованому калориметрі, температура газу в контурі зразка зменшується при розширенні в той час як температура газу в комірці зразка зростає по мірі стиску газу вхідним газом. При відсутності адсорбції, тепло, приймається контуром дозування і тепло вивільняється в комірці зразка поки вирівнюється тиск і температура не повертається до T0. Для ідеального газу, ці два ефекти взаємо компенсують одне одного тому що ентальпія ідеального газу є функцією тільки температури. Конструюванням [3] є ідеалізований калориметр, в якому тільки комірка зразку розміщена в калориметрі. Через те, що коло дозування і клапан є зовнішніми по відношенню до калориметра, додавання порції газу до комірки зразку генерує екзотермічне тепло стискування в комірці зразку, що не компенсується адсорбцією тепла в контурі дозування. Це надлишкове тепло стиску обчислюється із рівняння 12 і вилучається із повного тепла, що реєструється калориметром, для того, щоб точно визначити тепло адсорбції.
![]() (12)
(12)
Паразитне тепло генерується через стиск газу всередині комірки і було визначене розширенням газу від контуру дозування в комірку зразка при відсутності адсорбенту. Для контуру зорзування об’ємом 10см3 і для «мертвого» простору об’ємом 18 см3 в комірці зразку спостерігається лінійна залежність (див р-ня 12).
Для експериментальних даних a=3,94×10-4 Дж/Торр, ΔP є рушійною силою необоротного розширення: різниця тиску між контуром дозування і коміркою зразку.

Рис. 2. Схема під’єднання скляної комірки до насосу нагнітання, вакуумування, контура дозування, контролюючого клапана RGA. Скляна комірка оточена термопарами (не показані), що знаходяться в алюмінієвому теплостоці [3]
Опис інструменту. Комірка для досліджуваного зразку зроблена із скла (Pyrex) у вигляді скляного куба. Використання цього скла є вирішальним для мінімізації теплообміну через верх і бічні стінки камери. Цей скляний куб оточений із усіх боків (із дна, чотирьох бічних сторін) квадратними тепломірами (на рисунку не зображені). Дані тепломіри розроблені фірмою International Thermal Instrument Company, Del Mar, CA. як набір термопар на поліамідній підкладці площею 1”2 поміщено 100 термопар. Сигнал від термопар поступає до підсилювача і потім на комп’ютер. Теплостік виготовлений у вигляді алюмінієвого блоку (27×18×10 см), вагою 13 кг. Чутливість термопар, якою визначається чутливість всієї калориметричної установки, становить 0.0540 W/mV. Константа калібрування термопар становить K=0.0540 W/mV. Похибка вимірювання становить 2%, і залежить від адсорбату [3].
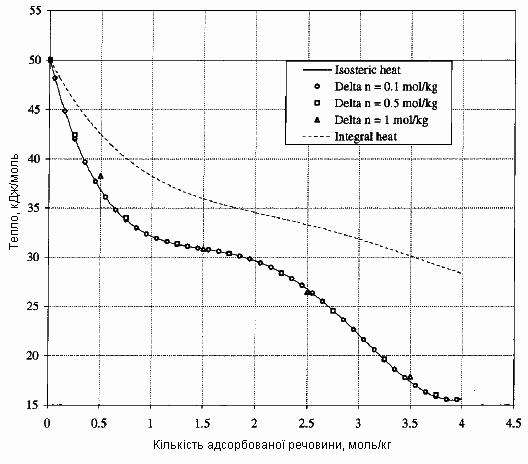
Рис. 3. Порівняння диференційного тепла адсорбції (неперервна крива) із експериментальними кількостями тепла, визначеними за скінченними дозами газу. Пунктирна лінія є інтегральним теплом адсорбції. Тепло, що визначене експериментально за допомогою малих доз 0.1 моль/кг дуже добре узгоджується із експериментальним теплом [3].
Розглянутий ізотермічний теплопровідний калориметр [4] із можливістю використання як ізотермічний титраційний калориметр. Як датчики тепла використані термопари легованого телуриду вісмуту. Постійна часу становить 165сек (камера, наповнена водою), коефіцієнт калібрування 15 Вт/В, чутливість сенсора теплового потоку 0,4Вт/к [4].
Описаний простий, недорогий, кондуктивного типу калориметр [5], що може визначати температуру плавлення і інші температури фазових переходів із точністю до 0,1К на IPTS-68, концентрацію домішок і зміни ентальпії із точністю до 1%, теплоємність із точністю до 5%. Проведені тести відкрили наявність метастабільної фази в n-октадекані, що плавиться при 300,27К і n-ейкозані, що плавиться при 309,34К. Перехід від однієї твердої фази до іншої також зафіксований в n-нонадекані при 295,5К і n-докозані при 317,04 К.
Опис калориметричної установки [5]. Базовими вимогами конструювання були: а) забезпечити точність вимірювання температури на рівні 1/100К; б) здатність визначати розчинні і тверді нерозчинні домішки; в) визначати теплоту плавлення із точністю 1%, г) визначати теплоємність із точністю у декілька відсотків як для нагрівання, так і для охолодження.
О сновна
частина калориметра зображена на рис.
4. Калориметрична посудина А
зроблена із хромованої пластинчатої
міді і має внутрішній об’єм 3см3.
Циліндрична ампула може бути видаленою
із кришки С
для очистки і завантаження нового
зразка, має вагу 10г. Кришка має знімний
стержень (1мм діаметром і 20мм довжиною)
в центрі, що містить робочий термометр,
три пари мідь-константанових термопар,
що з’єднані послідовно (подвійна шовкова
ізоляція, Driver-Harris
Co.).
Петлеподібна мідна лопасть вставлена
в посудину для сприяння в тепловій
дифузій. Ковпачок (кришка) підвішується
над кожухом за допомогою трьох нейлонових
шнурів F.
сновна
частина калориметра зображена на рис.
4. Калориметрична посудина А
зроблена із хромованої пластинчатої
міді і має внутрішній об’єм 3см3.
Циліндрична ампула може бути видаленою
із кришки С
для очистки і завантаження нового
зразка, має вагу 10г. Кришка має знімний
стержень (1мм діаметром і 20мм довжиною)
в центрі, що містить робочий термометр,
три пари мідь-константанових термопар,
що з’єднані послідовно (подвійна шовкова
ізоляція, Driver-Harris
Co.).
Петлеподібна мідна лопасть вставлена
в посудину для сприяння в тепловій
дифузій. Ковпачок (кришка) підвішується
над кожухом за допомогою трьох нейлонових
шнурів F.
К
Рис.
4. Калориметр А – контейнер для
досліджуваного зразка, В – підігрітий
кожух, С – кришка контейнера, D
- нагрівний елемент, Е – диференційна
термопара, F
– нейлоновий шнур, G
– трубка із нержавіючої сталі, H
– скляна колба [5].
Температурна різниця між калориметром і кожухом вимірюється і контролюється із використанням мідь-константанової термопари Е. Термопара вимірює температуру вздовж ковпачка і також вздовж верхньої частини кожуха із спіральною довжиною провідників 30 см між двома кріпленнями. Добрий тепловий контакт ізольованих провідників із оболонкою забезпечений із допомогою гліфталевого клею (GE Adhesive 7031). Провідники відділені від вакууму за допомогою герметичних втулок у верхнім фланці.
Зборка розміщена у посудні Дьюара, що використовується порожньою чи заповненою холодоагентом, водою, льдом, сухим льдом, рідким азотом, у залежності від робочого діапазону температур.
Робота калориметра [5] Рис. 5 демонструє блокову діаграму апарата. Калориметр зазвичай працює із константою (термоЕРС), що отримується із диференціальної термопари (кондуктивний режим). Вихідна ЕРС диференційної термопари подається на підсилювач постійного струму, що може бути приєднаним до даного подавлення напруги. Вихід підсилювача при.єднаний приєднаний до PID контролера і джерела постійного струму (Shinku Riko Co., моделі 5202, 5301 і 5405).

Рис. 5 Блокова схема системи [5]
При роботі в режимі провідності подається мала кількість сухого повітря як зовнішня атмосфера для теплопровідності. Система може також працювати в адіабатичному режимі із нульовим зміщенням до диференційної термопари і вакуумованим скляним кожухом.
Температура калориметричної посудини записується самописцем із визначеними інтервалами часу, що записує криві охолодження чи нагрівання в режимі провідності. Зсув напруги становить приблизно 84 мкВ, що відповідає різниці температури 2К, що досягається при нагріві (охолодженні) із швидкістю 0,2К/хв у випадку n-октадекана. У звичайних випадках, зсув зумовлений значним температурним градієнтом в калориметричній посудині. Проте, температурна різниця між двома точками на калориметричній посудині де встановлені термопари може бути виміряна тимчасовим зсувом нуля протягом замороження (танення) зразка. Так, у випадку n-октадекану, визначена різниця становила 0,11 К. Корекція цієї величини була застосована до визначення точки плавлення [5].
Запропоноване використання калориметрів в клінічних лабораторіях, зокрема розглянутий термопарний калориметр кондуктивного типу [6].
Калориметр в основному складається із реакційної посудини, у якій має місце досліджувана реакція, пристрою для вимірювання тепла. Пристрій для вимірювання тепла може бути окремими термопарними з’єднаннями, цілими термопарами чи термісторами. Термопара зроблена із двох різних металів. Вимірюється різниця температур за величиною термоЕРС. Для більшості термопар чутливість становить декілька мілівольт на градус. При об’єднанні багатьох термопар в одну велику термопару, чутливість зростає до 30 – 60 мВ/°С [6].

Рис. 6. Основна одиниця термопарного кондуктивного калориметра [6].
Описані робочі характеристики кондуктивного калориметра [7]. Теплові сенсори калориметра є основаними на термопарах із чутливістю, що задана замовником 150 мкВ/мкВт. Калориметр має повністю подвійну конструкцію для компенсації зовнішніх температурних флуктуацій. Використовується для дослідження матеріалів ядерної фізики, наприклад, для дослідження зразка потужністю 250 мВт (100 г плутонієвого (6% 240Pu) еквіваленту) із похибкою менш, аніж 0,5% [7].
У роботі [8] представлене моделювання деяких електричних і хімічних процесів у кондуктивному калориметрі потоку маси. Моделювання теплових процесів у відношенні до реакцій окислення Ce3+ із BrO3- в 1M H2SO4 основане на кінетичному механізмі, запропонованому Turanyi, Gyorgy, Field і на оцінених величинах для теплової реакції кожного кроку в механізмі. Подібна робота виконана у ввідношенні IO3- і I- реакції в HClO4 (реакції Душмана Dushman). Узгодження між дослідами і моделюванням підтверджує валідність експериментальних результатів і що оцінені величини для параметрів калориметра і для досліджуваних реакцій є прийнятними [8].
