
- •I. Ізотермічна кондуктивна калориметрія
- •International thermal instrument company представила серію калориметрів cr-100 для точного вимірювання тепловиділень радіоізотопів [9].
- •I. 1. Ізотермічні (ізопериболічні) титраційні калориметри
- •I. 2. Ізотермічні реакційні калориметри
- •3. Реакційний калориметр теплового балансу [158]
- •4. Калориметри Пельтьє [158]
- •II. Адіабатичні калориметри
- •III. Диференційні скануюча калориметри
- •Програмне забезпечення контролю Pyris
- •IV. Високотемпературна калориметрія
- •VI. Калориметри високого тиску
- •VII. 2. Дуже чутливий калориметр зеебека
- •VIII. Ac калорметрія пельтьє
- •2. Точковий калориметр Пельтьє
- •IX. Методи і результати використання калориметрії зеебека
- •X. Компенсаційні калориметри для визначення ефективності болометрів і вимірювання потужності лазерних діодів
- •Fig. 149 Коефіцієнт s і загальна радіаційна потужність p, у залежності від ld вхідного струму Il [242]
- •Список використаної літератури
I. 1. Ізотермічні (ізопериболічні) титраційні калориметри
Сучасний інструментарій для калориметрії дозволяє прямо визначати величини ентальпії для реакцій зв’язування і конфірмаційних перетворень в біомолекулах. Повний термодинамічний профіль складається із вільної енергії, ентальпії, і ентропії. Такі термодинамічні профілі у дуже великій кількості зустрічаються в проектуванні лікарських засобів, тому що вони дають інформацію про рушійні сили, що не може бути отриманим лише за допомогою структурних чи обчислювальних методів [13].
Е
Рис.
20. Репрезентативні дані ізотермічної
титраційної калориметрії (а) і
диференційної скануючої калориметрії
(б). Ізотермічні титраційні дані наведені
для зв’язування 2’CMP
реактивом RNaseA.
Верхній графік показує початкові
титраційні дані. ДСК графік показує
теплову денатурацію protein
ubiquitin.
Діаграми показують температуру плавлення
Tm
і зміну теплоємності ΔCp[13].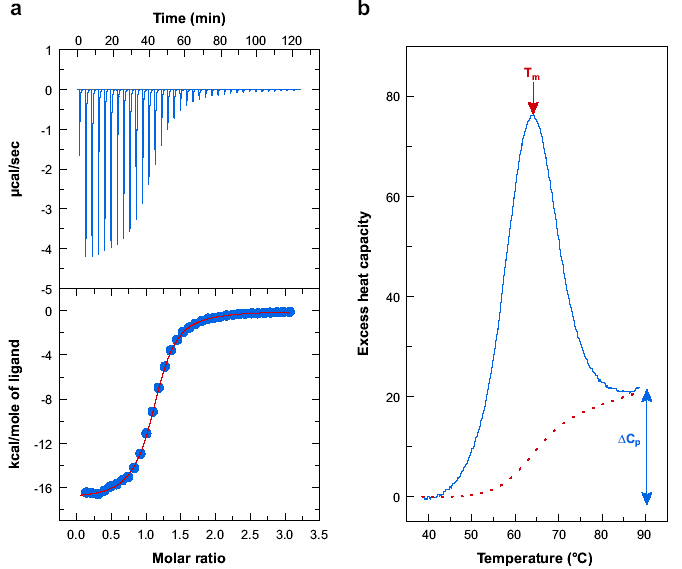
Ступінь перетворення при будь-якій температурі може бути визначений за допомогою інтеграції графіка перетворення. Рекомендації щодо належної презентації даних DSC недавно опубліковані в першоджерелі (16). В ITC також показується різниця температур між коміркою зразку і референтною коміркою. На відміну від DSC, обидві комірки підтримуються при постійній температурі. Титраційна система постачає титрант до комірки зразку. Будь-яке тепло зв’язування в комірці зразку результатом має порушення теплової рівноваги між референтою коміркою і коміркою зразку, що компенсується подачею модульованої потужності. Опис інтрументарію ITC опублікована в першоджерелі (17, 13). Репрезентативні дані ITC показані на рис. 1. Верхній графік показує початкові дані, на якому потужність показана як функція часу. Програмована титрація має результатами піки потужності, що повертаються до базової лінії. Площа кожного піку графіку є теплом реакції від додавання реактанту. Коли зв’язування рецептору (титранту) наближається до насичення, величина піків починає спадати. Нижній графік показує перетворення початкових ITC даних у форму ізотерми зв’язування. Така ізотерма зв’язування може бути підібраною до конкретної моделі зв’язування для отримання константи зв’язку, ентальпії зв’язку і стехіометрії зв’язування. Міркування щодо підбору даних ITC можуть бути знайдені у першоджерелах [18-23].
Калориметрія ITC чи DSC є трудо- і часомісткими процесами. Навіть практичний дослідник може повністю завершити лише декілька дослідів на день. Для того, щоби обійти ці обмеження, були зроблені дослідниками певні розробки. Найбільш розвинутою розробкою є розробка технології ThermoFluorTM [24] компанією 3D Pharmaceuticals, Inc., сьогодні належить Johnson & Johnson. ThermoFluorTM може бути використана для створення щільних масивів досліджень теплових зсувів для дослідження лікарських засобів. 384-коміркова мікроплата може нагріватись у заданому темпі. Спостереження ведеться за зміною кольору флуоресценції флуоресцентна, що відображає розгортання молекули протеїну. Відображаються бібліотеки низькомолекулярних сполук для зв’язування конкретних протеїнових молекул із пояснення для кожної із фірм наріжних термодинамічних принципів. Зв’язування лігандів термодинамічно зв’язано із процесом протеїнової денатурації. Ліганди, що зв’язуються до початкового упакованого стану стабілізують протеїни, збільшуючи їх температуру плавлення. Величина зсуву температури плавлення є функцією близькості зв’язування, хоча інші процеси зв’язування також впливають [25, 13]. Таким чином, технологія ThermoFluorTM дозволяє характеризувати теплову денатурацію запланованих протеїнів, забезпечуючи числовий вичерпний метод, що відображає точну термодинамічну інформацію. За допомогою цієї розробки, зв’язування сотень протеїнів зв’язуючими компаундами, кількість яких в бібліотеці налічує до тисячі, зроблено можливим, вдосконалюючи процес відбору ліків. Додатковою технологією ThermoFluorTM є ідентифікація біологічної функції. Наприклад, зв’язування лігандом білкового продукту дозволило продемонструвати нову біологічну невідому функцію [13, 26]. ThermoFluorTM був використаний для відображення взаємодії протеїну із 3000 компаундами, що були вибрані спеціально для відображення інформації про можливу біологічну функцію, і ідентифікувати зв'язок тільки певних лігандів із набору, що відображає біологічну роль протеїну. ThermoFluorTM технологія, при всіх своїх перевагах, не є справжньою калориметрією і може тільки визначити ентальпію van’t Hoff. Тому і до цих пір є необхідність використовувати калориметри високої пропускної здатності. Найкращою розробкою на сьогоднішній день є DSC інструментарій, сполучений із системою-роботом із можливістю управління зразками [13, 27]. Ця розробка обмежена за кількістю дослідів, проте є система робот завантаження зразків, збору даних, і зміни матеріалу між експериментами. Зразки розміщені у пластині із 96-ячейками що утримується в термостаті до того часу, як вона буде поміщена в калориметр. Система працює в неперервному режимі і дозволяє здійснити від 10 до 50 дослідів на день. В першоджерелі [27] доповідь про створення двох мікро калориметрів із мікро масштабною системою. Ентальпійний масив дозволяє змішування двох крапель об’ємом 250 нанолітрів, дозволяючи вимірювати тепло зв’язування від ензиматичної реакції [28]. Масиви для таких реакцій можуть бути виготовлені, дозволяючи паралельні ентальпійні вимірювання із повною характеристикою. Мікромасштабний термоелектричний проточний калориметр із об’ємом зразка приблизно 5 мікролітрів описаний в першоджерелі [29], дизайн також передбачає проведення системи паралельних вимірювань. Хоча ці два пристрої є багатообіцяючими в плані калориметрії високої пропускної здатності і можуть працювати із дуже малими об’ємами зразків, їхня чутливість і ефективність є досить посередньою у порівнянні із комерційними мікро калориметрами [13].
Приклад дослідження за допомогою диференційного скануючого калориметра (рис. 10) наведений у першоджерелі, дослідження стосуються нового розробленого бісантрацикліну.


а) б)
Рис. 21. Термодинамічні профілі зв’язування DNA початковими мономерами daunorubicin і двох bisanthracyclines, WP631 і WP762, що відрізняються їхньою ланцюговою геометрією. Вільна енергія, ентальпія, і -TΔS наводяться; б) Схематичні термограми DSC отримані для DNA отримані у відсутності і присутності бісантрацикліну WP762 [13].
Розроблений новий апарат для дослідження фазових перетворень в гідрогенних інтерметалічних компаундах, що забезпечує точні характеристики термодинамічних властивостей і динамічні аспекти росту гідридних фаз у широкому діапазоні значень тиску 0–4 MPa і температури 250–800 K. Він складається із кондуктивного калориметра що сполучений із точним пристроєм вимірювання об’єму (волюметром). Зборка складається із замкнутої системи, в яку подається високо чистий водень що поступає в систему між резервуарами гідридів і реакторами із високою теплоємністю. Чудовою є стабільність сигналу калориметра, ±4 nV протягом довгого періоду >10 днів, що дозволяє пряме вимірювання тепла абсорбції H2 ди десорбції протягом сканування гістерезисної петлі із загальною точністю 1%. Для підтримання квазіізотермічних умов протягом перетворення, здійснюється надійний контроль температури і потоку газу. Одночасно дані про тепловий потік, тиск, температури, склад збираються для отримання кінетичних параметрів за допомогою двох різних, повністю завершених технік. Перша основується на аналізі і вимірюванні теплового потоку, що виділяється протягом реакції що дає точні дані про величину швидкості при розгортці сигналу. Цей метод дає тільки поверхневу інформацію. Результатами числової обробки вирішена проблема розміщення нагрівача для калібрування калориметра. Друга техніка враховує об’єми компонент в системі. Вона дає інформацію про тиск водню і об’єм водню, функцію перетворення в експерименті. В загальному плані, форма графіку функції перетворення дає інформацію про механізм реакції. Детально досліджуються системи ZrNi–H2 і LaNi5–H2.
Калориметр. Нова концепція проектування пічки. Новий високочутливий регулятор потужності пічки (EUROTHERM 900HP). Сигнал зчитується двома термопарами, що підключені до цифрового нановольтметру K182 (KEITHLEY). Флуктуації напруги не вищі 4 nV. Зсув базової лінії для сигналу становить 10 nV протягом більше двох годин часу, що пояснюється певними тепловими аномаліями чи поведінкою малих об’єктів. Ці умови збережені протягом десятиденного вимірювання гістерезисного кола [13].
Потужність для калібрування калориметра становить 5мВт. Мінімальна похибка становить 1,5% для загального експерименту і 1%, коли вимірювання проводились від точки, де ще не спостерігався зсув базової лінії.
Використані термопари хромель-алюмель (THERMOCOAX), що вмонтовані всередині реактора. В комірці використовується платиновий резистор PtR.
Реактори сконструйовані для оптимізації теплообміну із оточуючим їх середовищем. Розміри комірки: висота 850 мм, зовнішній діаметр 522 мм, внутрішній діаметр 520.6 мм. Маса зразка становить 100 – 200 мг [13].

Рис. 22. Схематичне зображення комірки для зразка [13]

Рис. 23. Калібраційна термограма для кондуктивного калориметра, відповідь на квадратний тепловий імпульс, що генерувався протягом 1 год, T = 55°C [13].

Рис. 24. Дані, що отримані за допомогою калориметра і стосуються адсорбції водню [13]. Тепловий потік у залежності від часу. Т=210,6°С [13].
Ізотермічна титраційна калориметрія все ширше і ширше встановлюється як інструмент для дослідження з’єднання поверхнево – активних речовин [13]. Це пов’язано із розвитком нового, чутливого і зручного у використанні комерційного обладнання, наближеного до отримання одночасної інформації про основні термодинамічні параметри пов’язані із досліджуваними процесами. Проте, значна частина користувачів до цих пір не ознайомлена із багатьма аспектами використання цієї калориметричної техніки. Огляд [13] присвячений обговоренню конструюванню експериментальної установки для дослідження об’єднання поверхнево-активних речовин у воді і наявності полімерів (заряджених чи незаряджених), а також і в управлінні найбільш споріднених термодинамічних параметрів із цих калориметричних титраційних кривих. Деякі літературні приклади обговорюються для використання цієї техніки для різних систем [13].
Титраційний калориметричний експеримент проводиться при постійній температурі, тому методи в загальному називаються ізотермічною титраційною калориметрією (ІТК). Калориметр має зазвичай високу чутливість, таким чином ефекти із незначним виділенням тепла вимірюються із високою точністю. Об’єм реакційної комірки змінюється зазвичай від 1 до 4 мл, проте більша чи менша посудина не може бути використана. Вимірювання можуть бути виконані із використанням малих кількостей розбавлених розчинів, що означає, що можуть бути використані обмежені кількості речовин. Чутливі калориметри зазвичай є двійними (мають дві камери, twins), і працюють як диференціальні інструменти. В подальшому використовуватимемо слово калориметр для різних чутливих калориметрів розчинів. Одна калориметрична посудина містить реакційну систему, а інша референтна посудина є інактивною моделлю, що має властивості теплоємності і теплопровідності подібні до реакційної системи. Титрантний розчин додається із високоточного шприца ззовні калориметра.
Чутливі калориметри мають дві принципово різні конструкції: адіабатичні калориметри і кондуктивні калориметри.
Автором [30] припускається використання також і адіабатичного калориметра [31]. MicroCal’s (Northhampton, MA, USA) and CSC’s (TA Instruments) титраційні калориметри є за своєю суттю адіабатичними калориметрами. MicroCal інструмент має комірки у формі монет, перманентно закріплені на певній стороні спеціального термоелектричного пристрою, який вимірює температурну різницю між двома комірками. Комірки містять електричні нагрівачі і температура повільно зростає протягом експерименту з допомогою нагрівання зразкової комірки з допомогою малої постійної потужності. Температурна різниця між досліджуваним зразком і зразковою коміркою спостерігається і надається пропорційна потужність зразковій (референтній) комірці для того, щоби підтримувати різницю температур однаковою (компенсаційний калориметр). Тепло, що виділяється, чи поглинається в процесі є пропорційним до інтегралу диференціальної потужності. Цей інструмент характеризується малою постійною часу, тому, що він швидко досягає теплової рівноваги. Повністю заповнені комірки в теперішньому варіанті мають об’єм близько 1,3 мл і є постійно (перманентно) встановленими. Калориметр і його використання є описаними в першоджерелі [31]. Розчин «реактанту» R1 заповнює калориметричну посудину і додавання розчину титранту R2 може спричинити переповнення посудини і витік, що еквівалентний доданому об’єму титранту. Тому протягом титрування об’єм є постійним, проте кількість реактанту R1 зменшується. Має бути застосована корекція для переповнення посудини протягом титрування. Ця калориметрична система володіє високою чутливістю і дозволяє досліджувати процеси із малими тепловими змінами. Оскільки постійна часу є малою, титраційний експеримент може проводитись швидко із інтервалом в декілька хвилин між кожною послідовною титраційною ін’єкцією. Проте, є необхідною перевірка, що досліджувані процеси є швидкими тому реакція є завершеною і сигнал повертається до попереднього рівня після спостережуваного піка. Інструмент не має теплостоку, тому система є перевантаженою, якщо виділення тепла є надто великим (більшим, аніж 0,2 мВт). Це означає, що при зміні кількості ін’єкції до 0,5 мл*сек.-1, коли вивчається процес, що спричиняє ентальпійну зміну 20 кДж*моль-1 ін’єктованого R2, концентрація R2 в шприці не може перевищувати 0,02 моль*л-1. Ізотермічний калориметр CSC має конічну комірку об’ємом 1 мл і малу постійну часу [32].
Прототип калориметра для вимірювання, зазвичай названий кондуктивним калориметром, був розроблений Suurkuusk і Wadsö [33]. В кондуктивному калориметрі, тепло, що поглинається чи виділяється із реакційної камери протікає до теплостоку, зазвичай алюмінієвого блоку. Термопарні пластини розміщені між контейнером, в якому знаходиться зразок і теплостоком та реєструють тепловий потік. Температурна різниця між реакційною камерою і тепло стоком, що спричиняє тепловий потік, генерує електричний потенціал, що реєструється. Напівпровідникові термопари часто використовуються як сенсори. Теплопровідність напівпровідникових термопар є зазвичай високою, тому різниця температур між реакційною камерою і тепло стоком є малою (близько 1 мК). Постійна часу кондуктивних калориметрів є зазвичай великою (від 100 до 1000 с). Це означає, що для швидких процесів, час, що необхідний для досягнення теплової рівноваги є набагато довшим, аніж час, що необхідний для закінчення реакції. Навіть, якщо реакція є швидкою, титраційний калориметричний експеримент із десятьма послідовними ін’єкціями може тривати декілька годин. Проте, час, що є необхідним, може бути зменшеним на порядок з допомогою методу динамічної корекції. Ін’єкції здійснюються в інтервалі від 5 до 7 хв без очікування повернення сигналу до основного рівня [34]. Після реакції, криву розгортають, використовуючи рівняння Тіана із величиною для часової постійної, що визначена із експерименту електричного калібрування.
Кондуктивні калориметричні системи представлені на ринку організаціями TA Instruments (раніш Jäfrä, Швеція і CSC Lindon, Utah, США). Реакційні посудини в калориметрах TAM (Suurkuusk-Wadsö конструкція) мають об’єм від 1 до 4 мл, проте у деяких випадках можуть досягати об’ємом 20 мл. Зазвичай вони є знімними для легкої чистки і заповнення. Відповідна кількість розчину, що має реактант R1 (або чистий R2) додається із зовнішнього шприца через капіляр із нержавіючої сталі. Протягом титрації загальний об’єм зростає і розчин реактанту R1 розбавляється, тоді як загальна кількість R1 залишається без змін. Ентальпійний ефект від цього розчину є зазвичай незначним, проте легко перевіряється окремим розбавленням з допомогою ін’єкції розчину в калориметричну рідину. Ця система має великий діапазон вимірювань від 0.1 µW до 10 mW. В титраційній калориметрії розчин титранту звичайно додається поступово невеликими кількостями для збереження доброго контролю над концентрацією реактантів і досягнути найкращої точності вимірювань. Типово, об’єми ін’єкцій змінюються від 1 to 15 µL, хоча і більші об’єми ін’єкцій є можливими для деякого обладнання. При використанні малих об’ємів концентрованого розчину чи чистих рідин, проблему дифузії розчину титранту в контакті із розчином в калориметричній посудині бажано розглянути [6]. При використанні більших об’ємів ін’єкції, потік ін’єкції має бути досить малим для досягнення теплової рівноваги в титраційному розчині перед його досягненням калориметричної посудини. Особливо при роботі із системами, що дають малий тепловий ефект доцільно робити частий бланковий експеримент титрації води у воді (розчинника в розчиннику) для визначення паразитних ефектів. Більш загальні порушення виникають від тиску в об’ємі через блокування на виході калориметричної комірки. Навіть малі обмеження на виході можуть спричинити значний тепловий ефект, як для вимірювання високочутливим калориметром. Титраційні мікрокалориметри були створені і використовувались спочатку для вивчення біохімічних систем, зрештою, з’єднання протеїнових ліганд і для гід рації малих гідрофобних розчинів. Це означає, що тертя (змішування) в калориметричних посудинах є оптимізованим для розведених водних розчинів. При конструюванні змішувачів і регулюванні швидкості змішування метою є мінімізувати тепло тертя від змішування і механічного руху розбавлених протеїнів шляхом підбирання швидкості змішування настільки малої, наскільки це є можливим. Проте навіть незначна зміна в в’язкості в калориметричних розчинах може мати надзвичайно шкідливий вплив на ефективність змішування. Проблема може виникнути при вивченні, наприклад, полімерного розчину чи при використанні розчинника, відмінного від води. Дископодібна посудина калориметра MicroCal, вершина ін’єкційної голки змінені для роботи у якості змішувача, а шприц обертається для досягнення змішування. Леза для змішування не можуть бути поширені в зразку дальше, ніж ширина комірки, велика кількість рідини може залишитись поза зоною досягання. Експеримент із використанням різних швидкостей змішування може показати чи змішування є достатнім. Ефективна турбінна мішалка є необхідною для досягнення задовільного змішування в циліндричній посудині об’ємом 4 мл, що використовує кондуктивний калориметр ТАМ. Є важливим показ змішувачем вертикального руху в рідині. Горизонтальне змішування в шарах рідини є легко досяжним, проте не дає гомогенного розчину. Дуже цінним є виконання стендового експерименту із використанням прозорих пластикових посудин для перевірки ефективності змішування. Процес змішування може бути вивчений із допомогою ін’єкції кольорового розчину. Також потрібно пам’ятати, що в’язкість може бути змінена протягом титраційного експерименту. Найбільш ймовірною така ситуація є у випадку коли розчин поверхнево-активної речовини додається до розчину полімеру, де зв’язки між полімерними ланцюгами змінюються через вплив доданого ПАР. Зміна в густині приводить до зміни базової лінії як тепла тертя від змішування. Цей зсув базової лінії може бути розглянутим при розрахунку області піку. Зазвичай, мікрокалориметри є каліброваними електрично, що є зручним і дуже точним якщо електричний нагрівач розташований відповідним чином. Проте, для перевірки загальної ефективності системи включаючи допоміжне обладнання автор [30] рекомендує використовувати відповідну тестову реакцію [36]. Розчинення пропан-1-ол в воді є підходящою реакцією для цієї мети. Проте, тепловий ефект є надто великим для більшості інструментів. Розчин 10 мас % пропанола є альтернативою, що дає менший тепловий ефект [36, 37]. Але для багатьох чутливих калориметрів, навіть розчин 10 мас % пропанола може спричинити надто великий ефект і тому використоветься розчин 1 мас % пропанола (чи інша розбавлена концентрація). Ентальпія розбавлення розчину і, відповідно, тепловий ефект (близько 25°С) є розрахованим із використанням коефіцієнтів віріальної взаємодії, наведених у [36].
Високочутливий, адіабатичний титраційний калориметр, контролюється за допомогою ПК [38]. Робота всієї калориметричної титрації є автоматичною, включаючи термоелектричну компенсацію теплоти змішування, електричне калібрування теплоємності, додавання титранта і вимірювання теплоти реакції. Загальна неточність вимірювання теплоти становить ≈ ±0,003 Дж для титрування, що продукує тепло велчиною від 0,025 до 1 Дж в зразку 50 мл. Калібрування калориметра проводиться на тріс-(гідроксиметил) амінометан, що дає прекрасне узгодження із попередньо опублікованими величинами [38].
Схематичне зображення комірки калориметра [38] зображене на рис. 1.
Калориметрична система, описана в [38], складається із калориметричної посудини, що поміщена в водяний термостат, що знаходиться при постійній температурі, автоматичної бюретки для точної подачі титранту, вимірювальна система складається із термістора швидкої відповіді, включеного в місток Уітсона, калібраційного нагрівача, що зроблений із точного резистора і стабільного джерела напруги, термоелектричного модуля Пельтьє для підігріву чи охолодження калориметричної комірки, вимірювача рівня pH і ПК для опрацювання результатів. Хімічна реакція проходить в тонкостінній скляній посудині місткістю 60 мл (рис. 25). Скляна посудина оточена мідною оболонкою, вагою 1 кг. Для усунення теплопередачі між оболонкою і коміркою, між коміркою і оболонкою міститься повітряний проміжок. Для усунення тепла від змішування, і для приведення температури реакційної комірки до температури водяного термостата, використовується модуль Пельтьє, що прикріплений до дна комірки. Для запобігання теплопровідності від модуля Пельтьє до стінок скла, останні покриті тонким шаром алюмінію.

Рис. 25. Схематичне зображення калориметричної реакційної комірки [38]
Автором роботи [52] описаний ізотермічний титраційний калориметр Гілла (Gill titration calorimeter). На рис. 24 наведена схема калориметричного блоку в розрізі. блок є циліндричним і рис. 24 показує розріз в площині, що проходить через дві осі – осі комірки досліджуваного зразку і референтної комірки. Блок має зовнішню оболонку із нержавіючої сталі (i), всередині якої міститься алюмінієвий теплостік ( j ). Зовнішня оболонка виконана у формі циліндра із потовщенням навколо зовнішнього обідка. Теплостік підвішений на нижній поверхні кришки оболонки на шести гвинтах (не показані. Єдиний тепловий контакт між теплостоком і зовнішньою оболонкою здійснюється через ці шість гвинтів і чотири сталеві прокладки (k), із яких показані тільки дві; інші дві знаходяться перпендикулярно до площини перерізу. Цілий блок поміщений в термостат, для зменшення температурних флуктуацій в подальшому, зовнішня оболонка оточена ще однією оболонкою із поліуретану товщиною 1 см. Теплостік має три частини (j’, j” and j’”). Верхня частина (j‘) проходить через чотири отвори. Реакційна і референтна комірки (1) містяться в них, що мають три різні діаметри. Ці два отвори показані на рис. 2., ліворуч отвір із реакційною коміркою; праворуч – із референтною, також показана порожнина для збереження чистоти. Інші два отвори (не показані) розміщені на тій самій відстані від осей блоку, що і згадані, і в площині, що перпендикулярна площині рисунка 2. Ці інші є єдиного діаметру, названі шириною найменшої секції показаних отворів. в них вставлені дві трубки із нержавіючої сталі, що не повністю виступають вниз в частині j”. Вони виступають над поверхнею води в водяному термостаті із зовнішньої оболонки (приблизно 4.5 см від верхньої сторони зовнішньої оболонки). Через одну із трубок підходить провідне сполучення термопари із нановольтметром (a’), з’єднаних назустріч, а через іншу, провідне сполучення нагрівача із джерелом напруги (a”). Провідники розміщені в трубках із легкоплавким сплавом вісмуту (Small Parts, J-LMA-117). Вони підходять від нижніх кінців трубок для термопар чи нагрівача через жолоби у нижній поверхні частини j” теплостоку і малих отворів через них (не показано). Назвемо структури, що містяться в частині j‘ тепло стоку реакційною і референтною комірками (I). Поперечний переріз цих структур показаний праворуч на рис. 2. Реакція має місце в скляній колбі (l’), місткістю приблизно 200 мікролітрів, з’єднаної із кінцем NMR трубки (I”) зовнішім діаметом 4 мм. Цю колбу назвемо реакційною посудиною. Загальна довжина від верхнього кінця скляної трубки до нижньої частини колби становить 7 см. Верхня частина довжиною 5 см сляної колби розміщена в сталевій трубці (I”’), що має контакт із частиною j’ в тепло стоці і відходить вверх від зовнішнього покриття оболонки. Скляна трубка зафіксована в трубці із нержавіючої сталі за допомогою тонкого шару воску. Реакційна комірка поміщена в той самий легкоплавкий сплав вісмуту, що використовується в патрубках для провідників в малій циліндричній мідній чашці (m). Нагрівач (a”), зроблений із манганінового провідника довжиною 15 см і опором 100 Ом, є намотаним на малий жолоб в нижній частині (m’). Нижня поверхня мідної чашки знаходиться в тепловому контакті із верхньою поверхнею термопари (Melcor FCO-6-66-05L); нижня сторона термопари є також в тепловому контакті із частиною j “ теплостоку. Таким чином, тепло від реакційної комірки протікає через мідну чашку і термопару.

Рис. 26. Поперечний переріз калориметра і титраційного шприца, збільшений поперечний переріз реакційної (референтної) комірок: i, зовнішня оболонка; i, теплостік; g’, шприц; і I, реакційна (референтна комірка).
А втором
[52]
також описується титратор. Титратор.
Схема титратора, що забезпечує вприскування
і системи перемішування зображена на
рис. 16. Титратор зроблений із п’яти
колонок (із яких показані тільки дві),
з’єднаних верхнім потовщенням
калориметричної оболонки у формі п’яти
чи шести точок правильного шестикутника,
і трьох круглих, товщиною 0.6 см рівнів
алюмінієвої пластини. На верхньому
рівні знаходиться кроковий двигун (a'")
для фіксованої ін’єкції титранту.
Середній рівень містить мікрометер (0)
і двигун для перемішування (a"'). на
нижньому рівні прикріплена прямокутна
алюмінієва пластина (p) що містить дві
опори Одна із них співпадає із віссю
двигуна для перемішування, що приводить
в рух титраційний шприц (q), що розміщений
на іншій опорі. Обидва двигуни крокування
і перемішування контролюються за
допомогою комп’ютера.
втором
[52]
також описується титратор. Титратор.
Схема титратора, що забезпечує вприскування
і системи перемішування зображена на
рис. 16. Титратор зроблений із п’яти
колонок (із яких показані тільки дві),
з’єднаних верхнім потовщенням
калориметричної оболонки у формі п’яти
чи шести точок правильного шестикутника,
і трьох круглих, товщиною 0.6 см рівнів
алюмінієвої пластини. На верхньому
рівні знаходиться кроковий двигун (a'")
для фіксованої ін’єкції титранту.
Середній рівень містить мікрометер (0)
і двигун для перемішування (a"'). на
нижньому рівні прикріплена прямокутна
алюмінієва пластина (p) що містить дві
опори Одна із них співпадає із віссю
двигуна для перемішування, що приводить
в рух титраційний шприц (q), що розміщений
на іншій опорі. Обидва двигуни крокування
і перемішування контролюються за
допомогою комп’ютера.
К
Рис.
27. Титратор, що передбачає ін’єкцію і
перемішування реагентів [52].
В роботі [39] описується титраційний калориметр Гілла (Gill titration calorimeter) для дослідження біохімічних реакцій. В попередній роботі (El Harrous er ol 1994) авторами першоджерела 10 описана структура мікро калориметра титрування, що характеризується малим об’ємом (близько 200 мікролітрів) і високою чутливістю (приблизно 5 мікроДж), мікро калориметр є двокомірковим, кондуктивним, призначеним для дослідження біохімічних реакцій. В цій роботі детально описується робота цього мікро калориметра [39].
Робота мікро калориметра [39]. Робота пояснюється на прикладі титрації макромолекул лігандами. Спочатку, 0,5 мл розчину макромолекул кладеться в реакційну комірку, дальше чекають, допоки система не досягне рівноваги, тобто, коли базова лінія пристрою не повернеться на вихідну позицію. Час повернення лінії на вихідну позицію залежить від різниці між температурою розчину в реакторі і робочою температурою мікро калориметра. Якщо постаратись впевнитись, що обидві температури є однаковими, тоді час, що необхідний для досягнення рівноваги, становитиме 30-45 хв. Шприц є наповненим розчином ліганду і покладений на місце, для досягнення рівноваги із системою (20 хв). Реакційна комірка що є фізичним простором для проходження титрації, має об’єм 200 піколітрів; проте, для досліду потрібно 0.5 мл розчину макромолекули для реакційної комірки, для того, щоб пересвідчитись, що розчин ліганду, що надходить зі шприца, знаходиться в тепловій рівновазі із розчином в реакційній комірці. Більш того, в такий спосіб уникають шуму для базової лінії, тому що надлишок 0.3 ml покриває скляну трубку над реакційною коміркою, запобігаючи теплообміну із повітрям. Відбувається програмоване додавання розчину ліганду в розчин макромолекули. Кожна ін’єкція займає приблизно 3хв часу при ін’єктуванні 10 мікролітрів за 20 сек. При проходженні ін’єкцій, постійно працює мішалка, перемішуючи суміш із швидкістю (170 об/хв) із легким коливанням кінця скляної трубки, через який ліганд поступає зі шприца. Перемішування займає 45 сек часу, 30 сек за годинниковою стрілкою і 15 сек проти г.с. чи навпаки. Теплове вимірювання здійснюється протягом часу 90 сек. Експеримент закінчується, коли припиняються всі запрограмовані ін’єкції.
Перемішування і тепло ін’єкції вода-вода [39]. Середня величина для 10 перемішувань в реакційній комірці і 10 ін’єкцій розчину вода-вода подається в табл..1. Обидва ці процеси є екзотермічними. Для першого кількість теплоти становить 7 мікроДж, а для другого 12 мікроДж.
В першій і другій колонці таблиці 4 авторами показано величини, що отримані із застосуванням методологій вимірювання, застосованої для базової лінії, коли в реакційній комірці нічого не відбувається. Стандартний шум становить 3 мікроДж для базової лінії, при чутливості пристрою 5 мікроДж.
Табл.. 4.Тепло розчинення розчинника в розчиннику і тепло перемішування (мкДж). Теплота, показана в першій колонці, виміряна для 10 хв без застосування електричного компенсаційного методу. решта тепла виміряна для 90 сек, із застосуванням струму електричної компенсації I0, величиною 0.46 mA для нагрівача. Негативний знак відповідає екзотермічному ефекту. Всі вимірювання зроблені при 25 ºC. Ін’єкція 10 мікролітрів води дял 20 сек. Реакція протягом 30 сек за г.с. і 15 сек. проти г.с. [39]

Основа процесу змішування. Схема процесу змішування, що виникає в мікро калориметрі після ін’єкції, наведена на рис. 28. Ефективний об’єм реакційної комірки, Vс, залишається постійним протягом експерименту, оскільки ін’єкція в об’єм означає, що еквівалентний об’єм має бути вилученим. Основним припущенням у всіх обчисленнях і вимірюваннях, є припущення, що об’єм, вилучений із комірки не відіграє ніякої ролі в процесі, що вивчається. Наприклад, при вивченні реакції макромолекул із лігандом, ін’єктований об’єм розчину ліганду v: об’єм макромолекул, вилучених із розчину не реагує із лігандом. Правильність цього твердження є перевіреною. Як приклад можна навести розчин сахарози у воді. Об’єм, що ін’єктується становить 10 мікролітрів, потік становить 0,5 мкл/сек., взяте для експерименту [39].

Рис. 28. Базовий процес змішування i. Vе є ефективним об’ємом реакційної комірки і v є об’ємом, ін’єктованим зі шприца [39].
Для визначення кількості титранту в об’ємі, корисно визначити фактор дилюції, D:
![]()
Де v, об’єм, ін’єктований в мікро калориметр, Vс, об’єм комірки. Якщо реагенти, ін’єктовані через шприц назвати L, а M реагент, що титрується в реакційній комірці, тоді їх концентрація після ін’єкції становитиме:
![]()
![]()
Де [L]0 є концентрація реагента в шприці і [M]0 є стартовою концентрацією M в реакційній комірці.
Обчислення ефективного об’єму реакційної комірки. Відношення теплоти, після ін’єкції qk, і теплоти, що передувала ін’єкції qk-1, співвідноситься із початковою концентрацією реагента і фактором дилюції наступним співвідношенням:

Це співвідношення дозволяє обчислювати реакційний об’єм за відомим об’ємом ін’єкції v, концентрація титранту в шприці і початкова концентрація реагенту, що титрується точно відома.
Результати титруваня HCI розчином NaOH як показано на рис. 3. відповідно до критеріїв, що наведені вище, ми можемо визначити ефективний об’єм реакційної комірки, Vе, що становить 203 мкл для цього експерименту, Із аналізу багатьох даних, стандартна похибка цього експерименту становить 4 мкл.

Рис. 29 Калориметричне титрування 0,0216 М соляної кислоти НСІ, 0,0312 М NaOH при температурі 15 ºС, величина ін’єкції становила 15 мкл. Для обчислення кількості тепла використане співвідношення між теплом, що вимірюється і теплом, що описане в літературі [39].
Калориметр [39] є термопарним (із термопарним датчиком тепла) кондуктивним титраційним калориметром.
Науковий і технічний розв’язки капілярної калориметричної одиниці описані на методі відділення чутливого об’єму калориметричних комірок із теплопровідним містком в диференційнім титраційнім калориметрі [40]. Дизайн калориметричних комірок як тонких капілярів дозволяє мінімізувати розміри теплопровідних містків і відділити із високою точністю чутливий об’єм калориметричної комірки, що становить 78,5 мкл. Завдяки високій чутливості калориметра (10 наноВт) забезпечений сучасний рівень вимог для вимірювання мінімальної питомої теплоти. Представлений дизайн калориметричних комірок дозволяє розміщувати комірки горизонтально і спростити розв’язок проблеми вирівнювання кількості компонент в об’ємі калориметричних комірок [40].
Установче конструювання. Технічні вимоги для винайдення нового титраційного калориметра із капілярною калориметричною коміркою сформовані на основі розгляду подібних інструментів, розвинутих раніш. Табл. 2 представляє характеристики найбільш успішних титраціних калориметрів, що були розвинутими. Для порівняння цих даних запропонований метод порівняння здатності калориметрів вимірювати мінімальну специфічну теплоту процесів, що виділяється і яку здатний виміряти калориметр. Цей метод подібний до методу порівняння скануючих калориметрів, що запропонований автором [41]. У нашому випадку титраційного калориметра порівнюється відношення об’єму комірки / шуму, що характеризує відношення сигналу від пристрою / шуму. Інструмент, що має найбільше відношення об’єм комірки /шум здатний реєструвати специфічне тепло вимірювальних процесів більш точно. Наприклад, вивчення потужності взаємодії між тими самими компонентами із використанням установки Wiseman і El Harrous при постійних адитивних кількостях/робочих об’ємах, згідно ефективності цих інструментів, відношення сигнал/шум для калориметра Wiseman [41] є в 14 раз краще.
Метод порівняння інструментів в термінах мінімального рівня тепла [35, 36] реєстрованого інструментом, часто використовується для характеристики інструменту. На наш погляд [40], цей метод не дозволяє оцінити калориметр точно через похибки спільних методів для визначення мінімальної енергії, що реєструється калориметром.
Нами [40] представлено в таблиці 2 рівень шуму титраційних калориметрів, що базується на експериментальних даних, наведених у відповідних роботах.
Табл.. 5. Основні технічні характеристики сучасних титраційних калориметрів [40]
|
Першоджерело |
Рівень шуму, наноВт |
Змішування |
Термостатичний контроль |
Об’єм, мікролітри |
Відношення (Мікролітри/ наноВт) |
|
Gonnan Nordmark at al., [42] |
1000 |
Механічне, лопатевий змішувач |
Водяний термостат із вирівнюванням великої маси |
1000 |
1 |
|
Spokane et al., [43] |
1000 |
Механічне, лезо в одній комірці |
Водяний термостат і два внутрішні екрани для автоматичного контролю температури |
1000 |
1 |
|
McKinnon et al., [44] |
50 |
Механічне, лезо в одній комірці |
Водяний термостат із великими екранами і вирівнюванням великої маси |
200 |
4 |
|
Wiseman et al. [45] |
50 |
Механічне, лопатевий змішувач |
Адіабатичний екран, циркуляція холодоагенту для досягнення температури, нижчої за кімнатну |
1400 |
28 |
Продовження табл. 5 .
|
Першоджерело |
Рівень шуму, наноВт |
Змішування |
Термостатичний контроль |
Об’єм, мікролітри |
Відношення (Мікролітри/ наноВт) |
|
Freire at al., [46] |
100 |
Механічне, лопатевий змішувач в обох комірках |
Водяний термостат і вирівнювання великої маси |
1400 |
14 |
|
El Harrous et al, [47] |
100 |
Механічне |
Водяний термостат і вирівнювання великої маси |
200 |
2 |
|
Garcia-Fuentes et al., [48] |
1000 |
Механічне, лопатевий змішувач |
Водяний термостат і вирівнювання великої маси |
2900 |
2,9 |
|
CSC 6200, [49] |
±15 |
Гідравлічне імпульсне перемішування |
Адіабатичний екран, розміщений в термопарному термостаті |
330 |
11 |
|
CSC 6150, [49] |
±15 |
Гідравлічне імпульсне перемішування |
Адіабатичний екран, розміщений в термопарному термостаті |
330 |
11 |
|
Kotelnikov et al., [50] |
10 |
Дифузійне перемішування в поєднанні із осцилюючою голкою |
Ізотермічна оболонка, термопарний термостат |
78,5 |
7,8 |
Рис. 28 представляє технічне конструювання калориметра із титраційним об’ємом і включає основні елементи, що відрізняють інструмент, представлений в [11] від існуючих аналогів. Калориметрична одиниця включає дві калориметричні комірки, сконструйовані як капілярні трубки діаметром 1.2 мм. Загальний об’єм комірок складає 122 і чутливий об’єм складає 78.5 мікролітри. Для відокремлення чутливого об’єму використовується активний і пасивний резистивні містки підігріву. Основними елементами термостатичного контролю є екран і контрольований термопарою термостат. Титраційна одиниця складається із двох титраційних шприців. Пістони шприців з’єднані разом за допомогою містка. Для забезпечення процесу ін’єкції титранту, футляр шприца приєднаний до першого гвинтового кріплення, а перегородка до другого гвинтового кріплення. Гвинтові механізми приводяться в рух кроковими двигунами. Система контролю не має принципової відміни від інших систем контролю [47, 45, 48, 43]. Структура передбачає комп’ютерний контроль калориметра, збір даних, etc [40].
Чутливий об’єм калориметричної комірки представлений об’ємом частини трубки, розміщеної під пасивним теплопровідним містком і є завдовжки 50 мм. Доза титранту подається в об’єм як тонка жилка, рівномірно розподілена вздовж довжини. Це забезпечується однаковою трансляційною довжиною шприців і перегородки, що з’єднує об’єми. Об’єм дози залежить від трансляційної довжини цих шприців. У випадку однакової трансляційної величини об’єм дози складає 0. Коли трансляційні довжини змінюються, об’єм дози міняється від 0 до максимального. Використані 10-µl Hamilton шприци, об’єм дози яких змінюється від 0.1 до 10 µl. Система термостатичного контролю забезпечує точне задання температури із рівнем шуму менш, аніж 10-5°C за допомогою автоматичної системи контролю, що не має лонгітюдної різниці температури. Завдяки використанню системи, налаштованої на нуль-позицію величини похибок, температура комірки зразка і референтної комірки є рівні одне одному за будь-яких умов. Теплопровідний міст 2 сконструйований для превентивації теплообміну між чутливою частиною реакційної комірки і теплопровідного містка 1 із середовищем через зовнішню частину капілярної трубки.

Рис. 30 Калориметрична титраційна одиниця [40]
Калориметр розв’язує проблему відокремлення активного об’єму титраційної комірки, під яким розуміємо об’єм, що розташований нижче теплопровідного містка 1.
Калориметрична комірка має ідеальний тепловий контакт із теплопровідними містками 1 і 2, запровадженими для відділення чутливого об’єму комірки. Тепло, що проводиться містком 1 має ідеальний тепловий контакт із тепловим екраном, чия температура підтримується рівною Tsh. Температура містка 1 на поверхневому контакті із екраном (R=Rbr) рівна Tsh. Контролююча система підтримує температуру містка 2 рівною температурі ізотермічного екрану Tsh [40].
Об’єм
термічної області, де виникає тепловий
ефект при розприскуванні і при русі
вверх розприскуючої голки V=Vc+Vbr
де чутливий об’єм калориметричної
комірки становить
![]() ,
r1
є внутрішнім радіусом калориметричної
комірки, L є висотою чутливого об’єму,
і об’єм калориметричної комірки, що є
сусіднім до чутливого об’єму, де тепло
реакції виникає,
,
r1
є внутрішнім радіусом калориметричної
комірки, L є висотою чутливого об’єму,
і об’єм калориметричної комірки, що є
сусіднім до чутливого об’єму, де тепло
реакції виникає,
![]() ,
b висота області поширення тепла поза
об’ємом комірки.
,
b висота області поширення тепла поза
об’ємом комірки.

Рис. 31. Схематичний рисунок калориметричної однини ці із містками 2 і 1 [40].
Тепловий ефект, що виникає в чутливому об’ємі калориметричної комірки Vc:
![]()
де Qsp специфічним тепловим ефектом реакції, ρliq є густиною рідини.
Тепловий ефект, що виникає в об’ємі Vbr, що є сусіднім до чутливого об’єму Vc:
![]()
Тепловий ефект реакції, що зафіксований калориметром визначається, як наступний:
![]()
де K є коефіцієнтом впливу теплового ефекту в об’ємі Vbr на тепловий ефект, зафіксований в чутливому об’ємі калориметричної комірки Vc.
Точність відділення чутливого об’єму калориметричної комірки в диференційному ізотермічному титраційному калориметрі визначена помилкою вимірювання калориметричного ефекту в чутливому об’ємі калориметричної комірки, що залежить від впливу теплового ефекту в об’ємі Vbr, що граничить із чутливим об’ємом калориметричної комірки [40].
Похибка вимірювання теплового ефекту в чутливому об’ємі калориметричної комірки Vc залежить від впливу теплового ефекту в об’ємі Vbr:
![]() (1)
(1)
де h представляє висоту містка 1 [40].
Для визначення фактору впливу K наступні аргументи можуть бути враховані. припустимо, що постійна потужність P виділяється тільки в обємі Vbr (стаціонарний стан). У цьому випадку:
![]() (2)
(2)
де qbr1 є теплом, що виноситься із об’єму Vbr через місток 1 до екрану, зафіксованого при температурі Tsh; qbr2 є теплом, що виноситься із об’єму Vbr через комірку до містка 2 при зафіксованій температурі Tsh; qconv є тепловий потік, що проходить через об’єм Vbr до чутливого об’єму Vc конвекцією від останнього до екрану при температурі Tsh.
Коефіцієнт (фактор) K впливу може бути визначений як співвідношення теплового потоку qconv що приходить в чутливий об’єм калориметричної комірки і записується мікро калориметром до суми теплових потоків qbr1+qbr2 що не вимірюються інструментом:
 (3)
(3)
Тепловий потік, що проходить методом конвекції від чутливого об’єму калориметричної комірки [51]:
![]() (4)
(4)
де r2 є зовнішнім радіусом клориметричної комірки; α є коефіцієнтом конвективного теплообміну; Tc є середньою температурою чутливого об’єму калориметричної комірки.
Тепло, що виходить із об’єму Vbr через циліндричний місток 1 до екрану [51]:
 (5)
(5)
де br є тепловою дифузією матеріалу містка; Tbr є середньою температурою об’єму комірки, що містить зразок Vbr.
Тепло, що виноситься із об’єму Vbr за допомогою теплопровідного містка 2:
![]() (6)
(6)
де qcw1 є тепловим потоком до стінки калориметричної комірки Vbr через місток 2; qliq1 є тепловим потоком в зразку від об’єму Vbr до теплопровідного зразка 2.
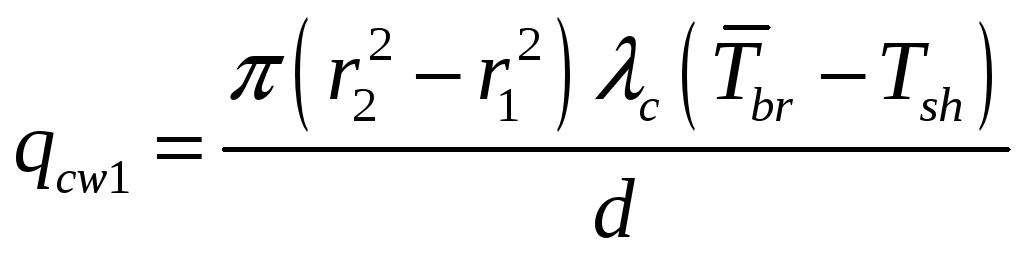 (7)
(7)
де c є тепловою дифузією матеріалу комірки; d є відстанню між об’ємом Vvr і міском;
 (8)
(8)
де liq є тепловою дифузією рідини.
Оскільки радіус r1 капіляру є малим, теплопередача в рідині конвекцією не береться до уваги.
Підставляючи (7) і (8) в (6) ми отримуємо:
 (9)
(9)
Підставляючи (4), (5) і (9) в (3) ми отримуємо:
 (10)
(10)
Причому,
відношення температур
 є оціненим із наступними міркуваннями.
Припустимо, що температура розподілена
лінійно вздовж чутливого об’єму
калориметричної комірки. В стаціонарному
режимі, тепловий потік, що виноситься
конвекцією із робочої поверхні
калориметричної комірки є рівним, в
кожен момент часу тепловому потоку, що
поступає із об’єму Vbr в чутливий об’єм
калориметричної комірки через стінки
комірки і рідкий зразок, i.e.:
є оціненим із наступними міркуваннями.
Припустимо, що температура розподілена
лінійно вздовж чутливого об’єму
калориметричної комірки. В стаціонарному
режимі, тепловий потік, що виноситься
конвекцією із робочої поверхні
калориметричної комірки є рівним, в
кожен момент часу тепловому потоку, що
поступає із об’єму Vbr в чутливий об’єм
калориметричної комірки через стінки
комірки і рідкий зразок, i.e.:
![]() (11)
(11)
де qcw2 представляє тепловий потік, шо приходить із об’єму Vbr до стінки калориметричної комірки через чутливий об’єм Vc; qliq2 що складаються із тепла, принесеного ззовні об’єму Vbr через рідкий зразок і чутливу комірку Vc.
 (12)
(12)
 (13)
(13)
Підставляючи співвідношення (12) і (13) в (11) отримуємо:
 (14)
(14)
Співвідношення (4) і (14) є тотожними :
![]()
або перетворюючи можна отримати:
 (15)
(15)
Підставляючи співвідношення (15) в (10) отримаємо кінцеву формулу для оцінки (апроксимації) коефіцієнта K:
 (16)
(16)
Підставляючи чисельні значення в рівняння (16): α≈2×10-5Вт мм-2К-1 [22]; L=50mm; h=8mm; Rbr=20mm; r2=0.6 mm; r1=0.5 mm; λс= 0,07 Вт мм-1К-1 (платина); λbr= 0,39 Вт мм-1К-1 (мідь); λliq= 0,65 Вт мм-1К-1 (вода), можна отримати чисельне значення для К, K≈1,4×10-4 [40].
Якщо оцінити фактор K беручи до уваги втрату тепла від комірки через термопари до другої комірки і підсумовуючи взяти температури рівні температурі екрану, Tsh (максимальна дисипація тепла).
В цім випадку
 (17)
(17)
де n означає кількість віток мідь-константанової термопари, що знаходиться між комірками; rwire означає радіус провідника віток термопари; lwire довжину кожної вітки термопари; λconst є тепловою дифузією константану; λcop є тепловою дифузією міді.
Прирівнюючи Eqs (14) і (17) отримаємо:
 (18)
(18)
Підставляючи Eqs (5), (9), (17), (18) в (3), отримаємо:
 (19)
(19)
Підставляючи чисельні значення (19) такі як n=100; lwire=6 мм; rwire=0.025 мм; λconst= 0,021 Вт мм-1К-1; λcop= 0,396 Вт мм-1К-1, отримуємо величину К, K≈1,7×10-4≈2×10-4 [40].
Таким чином, за умови L=50 mm, b=h=8 mm, використовуючи (1) можна оцінити похибку теплового ефекту впливу на Vc теплового ефекту в об’ємі Vbr [40]:
![]()
Експериментальні результати роботи [40].
Рис. 32 показує експериментальні дані, отримані після ін’єкції 2 µl дози 5% C2H5OH водного розчину в робочу комірку. Розприскування здійснюється розприскуючою голкою в комірці, її верхнім кінцем [40]. При передачі порції вприску голкою вздовж комірки, що оточена теплопровідними містками, енергія, що виділяється під час взаємодії між титрантом і зразком не реєструється.

Рис. 32. Вимірювана теплота взаємодії C2H5OH‑вода (вища крива представляє деривації кривої теплової потужності; нижче показана геометрія комірки) [40].
Коли голка досягає чутливого об’єму, калориметр починає реєструвати тепло, що виділяється, величина якого зростає по мірі проникнення голки в чутливий об’єм. Розприскування зупиняється, коли голка досягає дна чутливого об’єму (калориметричної комірки), після чого тепло стає рівним нулю. Верхня крива виникає за допомогою диференціювання нижньої кривої, що дозволяє реєструвати із більшою точністю момент початку реєстрації теплового ефекту в калориметрі. Цей момент відповідає входженню голки в чутливий об’єм. Факт входження голки в об’єм підтверджується трансляційною величиною розприскувача [40].

Рис. 33. Крива потужності, що виникає через вібрацію розприскуючої голки в калориметричній комірці (геометрія комірки показана нижче) [40]
Р ис.
33
показує
експериментальні дані, отримані після
вводу перемішувача в комірки.
Цей
перемішував і є самою голкою із
розприскувачем.
Голка
здійснює коливання із частотою, що задає
експериментатор.
10 Hz
частота
використана в цім експерименті.
Цей
експеримент повторює дослід із
C2H5OH.
Дані
підтверджують факт відділення чутливого
об’єму комірки від границі містка
теплопровідного
1 комірки
[40].
ис.
33
показує
експериментальні дані, отримані після
вводу перемішувача в комірки.
Цей
перемішував і є самою голкою із
розприскувачем.
Голка
здійснює коливання із частотою, що задає
експериментатор.
10 Hz
частота
використана в цім експерименті.
Цей
експеримент повторює дослід із
C2H5OH.
Дані
підтверджують факт відділення чутливого
об’єму комірки від границі містка
теплопровідного
1 комірки
[40].
О
Рис.
34 Схематичне зображення титраційного
калориметра VP-ITC MicroCal [25]
Сконструйований чутливий ізотермічний титраційний калориметр [53], що використовує полівініліден дифлуорид (PVDF) як детектор. Теплові імпульси можуть бути поміченими із розрізнювальною здатністю 0,4 мкДж, при рівні шуму не більше 40наноВт. Ефективність пристрою вимірюється із використанням Tris із соляною кислотою. Ентальпія реакції становить -49±1 кДж моль-1, що є в добрім узгоджені із величиною 47,5 кДж моль-1 [53].
Описується ізотермічний титраційний мікрокалориметр VP-ITC MicroCal. Він має об’єм для макромолекулярного розчину 2.5 мл (протеїни, ліпіди etc.) [54]. Робочий об’єм комірки становить 1.4 мл. Об’єм ін’єкції (мкл) за допомогою авто піпетки, об’єм розчину ліганду 3 і 15 мкл [54]. Вимірює констант зв’язку із точністю 109 моль-1 [54].
Протягом останніх 15 років ізотермічна титраційна калориметрія (ITC) знайшла широке застосування. Сьогодні існує 2000 інструментів, розміщених в 40 країнах світу [55]. Дослідження ведуться в таких галузях як біофізика, клітинна біологія, дослідження фармацевтичних препаратів, і дослідження харчових продуктів. Чому ж все-таки ця методологія користується таким інтересом ? [55]
Значний розвиток в області структурної біології потребує від біофізиків визначити молекулярну функцію і механізм її виникнення із все більшою точністю. Опис біохімічних процесів, проте, не може здійснюватись лише за допомогою структури. Повне розуміння приходить лише за умови кількісного опису зміни стану системи. В рівноважному процесі, такому, як біомолекулярна взаємодія, термодинамічні вимірювання супроводжуються кількісним описом зміни стану енергії [55].
ITC вимірювання [56–60] використовують надзвичайно точні вимірювання тепла як проби для взаємодії. Знання концентрації взаємодіючих частин дозволяє обчислити зміни в молярній ентальпії взаємодії ∆Hobs. Величини, що спостерігаються (позначені індексом obs, observed) означає, що кількість не є єдиною із ізольованих подій, асоційованих із формуванням бімолекулярного інтерфейсу (тобто, прямих нековалентних зв’язків між атомами не взаємодіючих частин), проте також включає тепло від повороту молекул розчинника навколо місць зв’язку, потенціальну конфірмаційну зміну, що виникає будь-де у взаємодіючих біомолекулах [61], і пряме формування не ковалентних зв’язків між іншими розчинами, такими як іони чи аполярні компаунди що можуть бути включеними як інгредієнти складного розчину. Оскільки майже кожна бімолекулярна взаємодія супроводжується процесом поглинання чи виділення тепла, ITC є універсальним детектором виникнення зв’язків (при відповідній температурі). Пряме визначення ∆Hobs заперечує непрямі обчислення даного параметру із використанням методу Ван-Гоффа, що може бути проблематичним в розширеному температурному діапазоні через вплив зміни теплоємності (тобто, зміна ∆H із температурою; співвідношення 3). Більш того, оскільки дві компоненти взаємодії можуть бути титрованими, вимірювана теплота дає пряму відповідь при довільному режимі концентрації (див рис. 1 і прешоджерело [62] для експериментального інструктажу). Як результат, концентрація вільних і зв’язаних молекул і таким чином визначена константа зв’язування і дисоціації, (KB,obs чи KD,obs, відповідно; KB = 1/KD) може бути визначена. Володіючи інформацією про ∆Hobs і KB,obs, може бути пояснений повний термодинамічний опис взаємодії при заданій температурі (T) на основі наступних співвідношень:
![]() (1)
(1)
звідки визначаються зміни в енергії Гіббса (∆Gobs) (де R є газовою постійною), і
![]() (2)
(2)
звідки визначається зміна в ентропії ΔSobs.
Подальшою термодинамічною характеристикою взаємодії є зміна в константі ізобарної теплоємності (∆Cp), що може бути визначена із вимірювання ∆H у температурному діапазоні
![]()
![]() (3)
(3)
Таким чином, ITC стає інструментом вибору для термодинамічного аналізу біомолекулярних взаємодій, оскільки може забезпечити визначення ∆H, ∆G, і ∆S в одному експерименті. Більш того, експеримент є швидким, типово займає менш, аніж година, намає необхідності маркування і вилучення реактантів, немає обмежень в розмірі для досліджуваних молекул, експеримент може проходити в густому чи зафарбованому середовищі, чи при наявності суспензії [55].

Рис. 35 [1]. Схематичне зображення ізотермічної кондуктивної калориметрії (ITC). (A) ITC інструмент до виконання титрації. Комірка зразку і референтна комірка підтримуються при одинаковій температурі, що типово на 5°–10°C вища температури ззовні оболонки, в якій міститься пристрій. Референтна комірка завжди підтримується при експериментальній температурі. Один із компонентів взаємодії розміщений в шприці, а інший находиться в комірці. (B) ITC інструмент виконує титрацію. Коли робиться ін’єкція, зміна кількості тепла, асоційована із зв’язком (ендотермічна чи екзотермічна) дає в результаті зміну температури в комірці досліджуваного зразка. Зміна в потужності (Вт/сек) необхідна для повернення комірки до температури (T) (тобто, ∆T = 0). Ця зміна фіксується для серії дослідів. В початкових даних кожна ін’єкція асоціюється із виділенням тепла (екзотермічна реакція). Коли курс ін’єкцій закінчується, кількість зв’язаних молекул в зразку насичується, і екзотермічний ефект зменшується. Деталі в першоджерелах [56-60] і [62].
Приклад вимірювань за допомогою ізотермічної титраційної калориметрії наводиться в таблиці 1.
Основуючись на емпіричному визначенні кореляції ∆Cp величини із зміною площі поверхні, що визначає взаємодію молекул, термодинамічні параметри можуть бути прямо віднесені до високо роздільної струкутри, і можна визначати зміну одних параметрів за іншими [65,66]. ITC виконуються при різних температурах, тим самим забезпечуючи точне пряме визначення ∆Cp величини (Див. співвідношення 3). Виникає попередження про загрозу, що ця кореляція дає оманливі результати (неправдиві), наприклад, там де молекули води існують у взаємодії (10,13,14) чи де прості конфірмаційні зміни однієї чи кількох молекул доповнюють зв’язки (15) [55].
Можна визначити, наприклад, концентрацію моновалентної солі, знаючи [MX] величину KB,obs із використанням співвідношення:
![]()
де A є чистою кількістю зменшення числа іонів (негативне число) чи збільшення (позитивне число) при формуванні комплекса, B є загальним числом зменшення кількості водяних молекул (позитивним числом) при формуванні комплексу, і Kref є гіпотетичною константою зв’язку при кількості солі 1 моль, при відсутності інших домішок (i.e., B = 0). Вивчення взаємодій PwTBP DNA, виконане при високій концентрації солі із використанням ізотермічної титраційної калориметрії (ITC), відкриває, що взаємодія виникає при чистім збільшенні кількості двох іонів і вилучення приблизно 40 молекул води (для деталей, див першоджерело 10).
Табл.. 6. ITC виміри взаємодії Src SH2 домена із серією пептидів [55]
-
Послідовність пептидів
KB×106M-1
ΔG
(kJ/mol)
ΔH
(kJ/mol)
TΔS
(kJ/mol)
He
10.80
-40.1
-38.7
1.4
Val
6.24
-38.8
-28.6
10.2
Glu
4.87
-38.1
-32.7
5.4
Trp
3.18
-37.1
-32.2
4.9
Asp
2.64
-36.6
-27.5
9.1
Дані взяті із першоджерела [55]. Всі пептиди мають послідовність Hie sequence Ac-GluProGln(pTyr)GluGluXxxProlleTyrl_eu-NH2, де Xxx є остатком визначення в першій колонці таблиці. ITC. ізотермічна титраційна калориметрія: Кв. константа зв’язку; ΔG. є зміною енергії Гіббса; ΔН, є спостережуваної зменою ентальпії; T. є температурою досліду: ΔS, є зміною ентропії.

Рис. 36. Log KB, obs у залежності від логарифму концентрації солі для взаємодії archaeal Pyrococcus woesei TATA зв’язуючого протеїн (PwTBP) із DNA [55].
Автором роботи [70] описаний ізотермічний титраційний мікрокалориметр. Точне підбирання досліджуваного зразка і референтної комірки у точно відомому об’ємі (близько 1.5 cм3) здійснюється в адіабатичній оболонці, рис. 3. Мікрошприц, контрольований комп’ютером через визначені інтервали часу здійснює ін’єкції малих об’ємів, таких як 5×10-6 дм3 розчину, що містить dnj0 молів хімічної речовини -j в розчин відомого складу, що міститься в комірці зразка. Зміни в площі хімічної реакції (чи просто впорядкування молекул) спонтанно виникає в комірці зразка. Калориметр реєструє супроводжуюче тепло q що може бути як екзотермічне, так і ендотермічне. калориметр працює в диференціальному режимі. Референтна комірка містить розчин, що відповідає розчину в комірці для досліду на початку досліду (такими параметрами як pH, буферна система, концентрація солі) за винятком реагуючої субстанції. Референтна комірка нагрівається в дуже повільному темпі із використанням малого електричного нагрівача. Контрольна система (рис. 27) відображає температури як комірки зразку так і референтної комірки, що нагрівається резистивними нагрівачами, для підтримання двох комірок при одинаковій температурі (або при дуже малій постійній різниці температур). Якщо ін’єкція малої кратності розчину із перемішуючого шприца є екзотермічною, контрольна система припиняє нагрів температурної комірки поки температура референтної комірки не вирівняється із температурою комірки зразку. Детектованою величиною є швидкість нагріву комірки зразка протягом часу, за який комірка зразка і референтна комірка не прийдуть до значення однакової температури. Сигнал від контролюючої одиниці інтегрується для одержання кількості тепла q, що асоціюється із даною кратною ін’єкцією із шприца в комірку зразку. Це тепло порядку мілікалорій і температура комірок змінюється всього на декілька мілі-Кельвін. Це все передбачає роботу калориметра в ізотермічних і ізобаричних (близьких до зовнішнього тиску) умовах. Калориметр калібрується малим електричним нагрівом в комірці зразка. Інформація, записана протягом проведення експерименту представляє тепло q на один моль ін’єктоване субстанцією серіями, наприклад 25 ін’єкцій. Калориметр працює в діапазоні температур від 0 до 80ºС, що означає, що стандартні теплоємності реакції можуть бути обчисленими у залежності стандартних ентальпій реакції від температури [70].

Рис. 37. Титраційний макрокалориметр, що має референтну комірку і комірку зразку; остання оснащена змішуючим шприцом для ін’єкції кратного розчину в розчин досліджуваної комірки [70].
Є цінність у використанні водних розчинів, тому що теплоємність води (і водних розчинів) на одиницю об’єму є більшою, аніж у інших рідин. Отже, ця велика теплоємність згладжує вклад інструментального шуму. Ключовою точкою для оператора ITC є те, що тепло q що є результатом хімічної реакції виникає в комірці зразку. Молекулярні взаємодії чи реорганізації що не є термічними є непомітними для спостерігача. Кожна ін’єкція кратно містить хімічну речовину-j і характеризується двома величинами, q і кількістю речовини dnj0. Для того, щоб інтерпретувати набір калориметричних результатів, модель вимагає наявності послідовного набору кратних ін’єкцій для дослідів. Зразок сформований для залежності відношення кількості тепла від кількості речовини (q/dnj0).

Рис. 38. Енергія Гіббса (за умов ізобарності і ізотермічності) розчину в комірці зразка що показує спонтанні зміни і досягнення мінімуму енергією Гіббса G при послідовності кратних ін’єкцій із шприца [70].

Рис. 39. Прямо зафіксовані графіки титраційного калориметра для ін’єкції води (l) графік (a) в урину (0.828 mol kg-1 в шприці) і (b) моноетилурини (aq) (0.796 mol kg-1 в шприці). Обидва графіки показують швидкість нагріву комірок зразку як функцій часу [70].
Аналіз калориметричних даних є оснований на умові, що кожна ін’єкція певної кількості молів речовини-j що позначена dnj0 шприцом, спричиняє в комірці зразка початок спонтанної хімічної реакції що проходить через серію термодинамічних рівноважних станів. Іншими словами, тепло q асоціюється із зміною в складі чи організації комірки зразка від одного рівноважного стану до ін’єкції до іншого рівноважного стану після ін’єкції. Оскільки ці спонтанні зміни виникають при постійній температурі і постійному тиску, ключовою термодинамічною потенційною функцією є енергія Гіббса. Зміни мають місце протягом серії ін’єкцій (рис. 38) зниження енергії Гіббса в розчині. Тому, часовий крок між кожною ін’єкцією повинен бути довгим порівняно із половиною часу перебігу всіх процесів в розчині для того, щоб мати можливість досягнення рівноважного стану. Ця умова підтверджується малою довжиною базової лінії між імпульсами тепла, записаними, як функція ін’єкцій. Графік генерує залежність (q/dnj0), кількість ін’єкцій ще називають енталопрограмою; див., наприклад, рис. 39.
Автором роботи [71] описаний термостатований мікрокалориметр титрування, що є контрольований комп’ютером і оснащений системою титрування.

Рис. 40 Блокова діаграма термостатованого мікрокалориметра із титраційним апаратом і контрольованого мікрокомп’ютером. 1, мікро шприц для ін’єкцій Ca2+ (чи Mg2+) розчину; 2, мікро шприц для вилучення розчину із комірки для підтримання тиску постійного; 3, реакційна комірка; 4, термопара; і 5, калориметричний блок [71].
За допомогою мікро калориметра [71] досліджується мозкова субстанція із калмодуліну під впливом іонів кальцію і магнію. За допомогою іонів кальцію перевіряється наявність іонів магнію при температурах 5, 15 і 25ºС. Титрування калмодуліну за допомогою іонів кальцію при відсутності іонів магнію показує, що реакція зв’язування іонів кальцію є ендотермічною, тому може регулюватись лише за допомогою зміни ентропії [71].
CSC Модель 4300 Макро об’ємного калориметра розчину [72]
Спеціально сконструйоване скло Dewars що зробило можливою високоточну мікро калориметрію, а також тривалу титраційну калориметрію було спочатку зроблене в університеті Brigham Young University [73]. Ця реакційна комірка має дуже малу термічну масу, добре сконструйовану границю, постійну часу, що вимірюється долями секунди, і дуже малі тепловтрати. Калориметр, що використовує це скло Dewars із об’ємом від 3 до 200см3 був розроблений за декаду часу від 1965 до 1975 [74]. Дуже малі тепловтрати підвищили чутливість і полегшили коректування кількості теплоти що становить тепловтрати. Строгі вимоги щодо постійної часу відносно тривалої (неперервної) титрації також вимагають дуже стабільного, вбудованого в скло термісторного містка (чи термісторних мостиків) для вимірювання температури і калібрації тепла із високою швидкістю. Через те, що титрант має бути ін’єктованим при температурі навколишнього середовища, дуже стабільний термостат контролює температуру навколишнього середовища і титранту [75]. Високоефективна, легка мішалка розроблена для мінімізації вхідного тепла від перемішування і теплового шуму від перемішування. Зміни ентальпії не можуть бути відомими краще, аніж зняті із бюретки, тому вимагаються бюретки із точними і постійними характеристиками. Розроблені нові методи для аналізу даних неперервного тривалого титрування [76,77]. Неперервне тривале титрування основане на розвитку в Brigham Young University із середини-1960-х, спочатку Tronac (Model 450, Ізопериболічний Калориметр) а пізніше розвитку Calorimetry Sciences Corp. (CSC Model 4300, Ізопериболічний титраційний калориметр). Ці калориметри є єдиними калориметрами на ринку, що здатні із високою точністю здійснювати вимірювання в області тривалого неперервного титрування. Цей калориметр може працювати в режимі збільшення титрацій. Можна вимірювати зміни ентальпії (рис. 7). Цей неперервний титраційний калориметр здатний демонструвати точні дані із точністю порядку десятитисячних [78]. Цей калориметр використовується для вивчення хімічних систем із мультиплетними, одночасними реакціями, наприклад, протонна іонізація полі протонної кислоти, іонна комплектація металів, і мультиплетне зв’язування протеїнів [79].
Калориметр працює в температурному діапазоні від 5 до 80 ºС проте цей діапазон може бути розширеним у двох напрямках за допомогою спеціального устаткування. У випадку Tronac Model 450 Isoperibol Calorimeter, додавання температурного контролера реакційної комірки і зміна реакційної посудини із посудини Дьюара на ізотермічну реакційну посудину із охолоджувачем Пельтьє перетворює теплоакумулюючий калориметр на тепло компенсаційний титраційний калориметр, такий як Tronac Model 550 Ізотермічний Калориметр. Це також робота проведена в Brigham Young University [80, 81]. Особливо корисним для вивчення повільних реакцій що продукують відносно великі кількості тепла, такі як електроліз чи ріст культур мікроорганізмів. Базова лінія цього калориметра залежить від оточуючого середовища, проте не відходить від оптимальних умов більш ніж на 100 мкВт. Схематична діаграма як теплоакумулюючого, так і тепло компенсаційного калориметра, зображена на рис. 31.
CSC Model 4200 ITC Мікрооб’ємний калориметр для розчинів [72]
Модель 4200 Ізотермічного Титраційного Калориметра (Рис. 41) є диференційним, ізопериболічним, теплокондуктивний калориметром для все збільшуючихся об’ємів титрування, таких як об’єми від 0.5 до 1.0 см3 титранту до 0.25 см3 загального титранту, доданого за декілька ін’єкцій. Час відповіді калориметра знаходиться на рівні 60 сек із використанням легкого температурного блоку і максимального числа термоелектричних сенсорів на кожній комірці. Спостережувана постійна часу становить 5 сек із використанням патентованого, алгоритму розгортки із використанням Kalman цифролво-фільтраційної техніки. Чисті результати кратного додавання титранту (типово від 0.5 до 2.5 мкл) можуть бути отримуваними кожні 120 сек дозволяючи неперервне титрування із 30 точками даних протягом 1 год. Ампула зразку легко вилучається для заповнення чи очищення чи може бути заповненою на місті. Шум базової лінії становить ±0.04 мкВт а із застосуванням розгортки може зменшеним до ±0.003 мкВт. Абсолютна стабільність базової лінії є кращою аніж 0.08 мкВт*год-1 а мінімально детектований тепловий ефект становить менше, аніж 1 мкДж. Стандартна модель 4200 calorimeter має реакційні комірки із сплаву Hastelloy C проте може бути сконструйована із інших металів. Титрація може бути здійснена із фіксованим об’ємом титранту. Реакційна комірка містить мішалку із постійною швидкістю обертання мішалки. Титрант ін’єктується через шприц, що приводиться за допомогою двигуна. Бюретка контролюється IBM-комплектованим комп’ютером що використовується для збору даних від сенсорів телуриду вісмуту. Цей калориметр створений для вивчення взаємодії протеїну із лігандами, швидкості метаболізу і т. д.
Рис. 41. Блокова діаграма ізопериболічного калориметра CSC model 4300 Isoperibol Solution Calorimeter. Скляна посудина Дьюара в деталях показана на рис 31 A. Модель Tronac model 550 теплокомпенсованої реакційної комірки в деталях показана на рис 31 B [72].
Калориметр титраційний MicroCal [82]
Калориметр розроблено в лабораторії Brandt's laboratory [82] і виготовляється фірмою MicroCal Inc., 22 Industrial Drive, Northampton, MD01060, USA, і є калориметром простого типу. Цей калориметр є адіабатичним титраційним калориметром (Omega) із дуже швидким часом відповіді. Найшвидша відповідь становить від 6 до 7 сек часу половини відповіді. Як видно із рис. 9, дві комірки розміщені по різні боки термопари, що містить 264 орієнтованих кристалів із телуриду вісмуту. Термопара працює як диференційний термометр, а не як теплопровідний інструмент, як може здатись спочатку. Фіксована комірка має форму диску і вперше сконструйована Gill et al. [83], вона є повністю заповненою (1.4 см3) із довгими і вузькими трубками, через які подається зразок за допомогою тонких голок. Голки працюють як змішувачі (Рис. 40). Кожна комірка має по 20- з’єднань провідникової термопари на зовнішній плоскій поверхні. Цей двійний калориметр розміщується в адіабатичнім екрані. Діапазон робочих температур становить від 2 до 80 ºС. У випадку експерименту постійна потужність (≤1мкВт) розсіюється нагрівачем у референтній комірці. Проте включене обернене коло (коло зворотного зв’язку), для постійного встановлення нульової різниці температури між комірками. При відсутності реактанту як комірки, так і потужність зворотного зв’язку находяться на рівні базової лінії. При екзотермічній реакції потужність зворотного зв’язку зменшується, а при ендотермічній ‑ збільшується. Таким чином, Omega є тепло компенсаційним калориметр. Авторами [30] що найкраща ефективність калориметра досягається при інтервалі часу між ін’єкціями 90 сек.10 прямих точок даних записуються за 30 хв, інтервал між ін’єкціями 2хв. Границя детектованої потужності становить 1.3 мкДж.
Табл. 7. Підсумкова таблиця розглянутих моделей CSC 4200 і Tronac 550 [72]
|
Виробник & номер моделі |
Метод вимірювання тепла |
Діапазон робочих температур |
Реакційна комірка |
Об’єм робочої комірки, см3 |
Постійна часу, сек |
24-годинна стабільність базової лінії, мкВт |
|
Tronac 550 |
Компенсація тепла |
0 – 80 |
Знімна, відкрита, металічна |
4 – 100 |
40 |
50 |
|
CSC 4200 |
Компенсація тепла |
0 – 110 |
Знімна, відкрита, ампула |
1 |
5 або 50 |
0,005 |
Ці риси спільні із титраційним калориметром Gill [83], що є також титраційним [85]. Калориметр MicroCal's є також дуже чутливим, маючи приведену до об’єму чутливість 0.8 Дж/см3. Він також подібний за характеристиками до калориметра CSC Model 4200 ізотермічного титраційного (див Табл 7), маючи постійну часу 13 сек і стабільність базової лінії протягом 24 год на рівні 0.02 мкВт [72].
Титраційні комірки [72]
Приклад титраційної комірки показаний на рис 30A. Кришечка контейнера зразка сполучена із двигуном мішалки (a) за допомогою 40 см завдовжки тонкої сталевої трубки (e). Двигун, що приводить в рух поршень шприца використовується для ін’єкції титранту (чи реагенту) через довгу ін’єкційну голку, внутрішній діаметр 0.15 мм, нерухомо сполучена із шприцом. Ін’єкційна голка, що проходить в ін’єкційну комірку через трохи ширшу сталеву трубку (b) є в тепловім контакті із гвинтами теплообмінника (d) розміщеного на сталевій трубці (e). Таким чином ін’єктована рідина знаходиться в тепловому контакті із термостатом і верхнім теплообмінним циліндром. Конструкція цієї комірки (і розприскуючої посудини, рис 10B) дозволяє використовувати різні види мішалок, див першоджерело [86]. Типово мішалки обертаються із швидкістю 100 об/хв, у більшості випадків із нев’язким середовищами, що зумовлює низьку потужність для змішування (порядку 1 мкВт) із малими привнесеннями тепла [72].

Рис. 42. Блокова діаграма CSC Model 4200 ізотермічного титраційного калориметра [72]

Рис. 43. Зовнішнє креслення калориметричної посудини, адіабатичний екран і ін’єкторна/змішувальна зборка для MicroCal ізотермічного титраційного калориметра. Для роботи при температурі нижче кімнатної, передбачене коло охолоджувача (Також див. першоджерело [82]) [72].
Швидкість змішування може бути зменшеною, коли така швидкість наприклад може зруйнувати досліджувані молекули протеїну, або збільшеною, коли це необхідно для експерименту. Типово, ін’єкція, наприклад для калориметра Гілла становить від 1 до 5мкл титранту за кожним роком. Рекомендована ін’єкційна техніка використовує привід шприца Thermometric syringe drive (Model 6120) і шприц Hamilton перманентно сполучена із тонкою голкою, що розміщена в контейнері (b) і зроблена із кислотно стійкої сталі. Точність ін’єкції може бути досягнута до 10 нано-літрів [72].

Рис. 44. Титраційно-розприскуючі комірки (14 чи 20 мм в діаметрі). A, титраційна комірка; a, привід мішалки; b, сталева трубка (трубка, що містить ін’єкційну голку); c, "контролер потоку"; d, теплообмінний алюмінієвий гвинт; e, сталева трубка; f, контейнер зразка (2, 4 чи 20 см3); і g, "турбінна" мішалка. B, розприскуюча посудина. C, парова розприскуюча посудина ("RH комірка"), h, газовий потік від клапана свіча; i, паро насичуюча чашка. (виробництво Thermometric AB) [72].
