- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
3.3 Термодинаміка реакцій горіння твердого вуглецю
На реакції взаємодії твердого вуглецю з киснем і окислювальними газами ґрунтується горіння будь-якого твердого палива. Перш ніж розглядати взаємодію вуглецю з киснем, необхідно обговорити процеси окислення вуглецю діоксидом вуглецю СО2 і водяною парою Н2О, так звані реакції газифікації вуглецю. Таку назву ці реакції одержали тому, що в результаті їх протікання твердий вуглець перетворюється на газоподібні оксиди.
Газифікація вуглецю діоксидом вуглецю СО2 (реакція 4)
Рівняння реакції газифікації:
С + СО2= 2CO – Q; ΔG0 = 172130 - 177,46·Т.
Реакція ендотермічна, її рівновага при підвищенні температури зміщується вправо. Протікання процесу залежить від загального тиску в системі. При пониженні тиску рівновага зміщується у бік утворення оксиду вуглецю (II) СО, тобто вправо.
За правилом фаз число ступенів свободи С = 2 + 2 – 2 = 2, тобто рівновага визначається двома змінними – температурою і тиском.
Вираз
константи
рівноваги
входять тільки газоподібні
компоненти,
оскільки активність вуглецю приймається
рівною 1
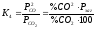 .
Залежність константи рівноваги реакції
(4) від температури описується рівнянням
.
Залежність константи рівноваги реакції
(4) від температури описується рівнянням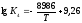 .
.
У
простому випадку (за наявності в газі
тільки СО і СО2)
умови
рівноваги
визначаються
рівнянням
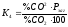 і оскільки газ полягає тільки із СО і
СО2,
то
%СО2
=
100 – %CO, тоді
і оскільки газ полягає тільки із СО і
СО2,
то
%СО2
=
100 – %CO, тоді
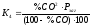 ,
у якому
містяться
три змінні величини Т,
Рзаг
і
%СО. Проаналізуємо графік залежності
рівноважного змісту СО від температури,
побудований
для
тиску Рзаг
=1
(рис. 3.5).
,
у якому
містяться
три змінні величини Т,
Рзаг
і
%СО. Проаналізуємо графік залежності
рівноважного змісту СО від температури,
побудований
для
тиску Рзаг
=1
(рис. 3.5).
|
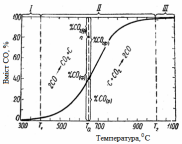
|
|
Рис. 3.5 – Ізобара при Рзаг = 1 атм рівноважного складу газу залежно від температури для реакції С + СО2 = 2СО |
Рівняння ізотерми Вант-Гоффа для даної реакції має наступний вигляд:
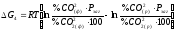 .
Якщо Рзаг
=
const, той цей вираз перетвориться в
.
Якщо Рзаг
=
const, той цей вираз перетвориться в
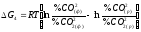 .
Кожна крапка в площині креслення
відповідає якійсь газовій суміші (із
СО і СО2)
у
присутності твердого вуглецю, узятій
при певній температурі. Але лише ті їх,
які розташовані на кривій, характеризують
рівноважні стани. Розглянемо крапку а
вище
кривій, належній нерівноважній системі.
Тут, як видно з графіка, %СО(ф)
>
%CO(р)
і %СО2(ф)
<
%CO2(р),
звідки
.
Кожна крапка в площині креслення
відповідає якійсь газовій суміші (із
СО і СО2)
у
присутності твердого вуглецю, узятій
при певній температурі. Але лише ті їх,
які розташовані на кривій, характеризують
рівноважні стани. Розглянемо крапку а
вище
кривій, належній нерівноважній системі.
Тут, як видно з графіка, %СО(ф)
>
%CO(р)
і %СО2(ф)
<
%CO2(р),
звідки
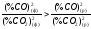 .
Оскільки мимовільно процеси йдуть у
бік меншого значення зміни вільної
енергії Гіббса, то реакція
повинна
за вказаних умов
протікати
лише вліво С + СО2
→ 2СО. Таким чином, крапки вище кривій
характеризують нерівноважні системи,
в яких можливий односторонній процес
розпаду СО. Так само з'ясовуємо,
що крапки нижче за криву відповідають
нерівноважним
системам,
в яких можлива одностороння взаємодія
С
+ СО2
→
2СО.
.
Оскільки мимовільно процеси йдуть у
бік меншого значення зміни вільної
енергії Гіббса, то реакція
повинна
за вказаних умов
протікати
лише вліво С + СО2
→ 2СО. Таким чином, крапки вище кривій
характеризують нерівноважні системи,
в яких можливий односторонній процес
розпаду СО. Так само з'ясовуємо,
що крапки нижче за криву відповідають
нерівноважним
системам,
в яких можлива одностороння взаємодія
С
+ СО2
→
2СО.
Газифікація вуглецю водяною парою
Взаємодію водяної пари з вуглецем можна представити у вигляді наступних співвідношень
реакція 6 С + Н2О = СО + Н2 – Q ΔG0 = 135550 - 143,99·Т.
реакція 7 С + 2Н2О = СО2 + 2Н2- Q ΔG0 = 98970 - 110,53·Т.
Реакції (6) і (7) ендотермічні і за принципом Ле-Шателье з підвищенням температури їх рівновага зміщується управо, у бік зменшення рівноважного вмісту водяної пари. Процеси (6) і (7) супроводжуються збільшенням об'єму та із зменшенням тиску рівноважна концентрація Н2О падатиме. Величини констант рівноваги записуються таким чином:
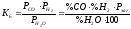 ;
;
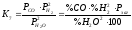 .
.
Термодинамічні параметри процесів взаємодії водяної пари з вуглецем доцільно одержувати за даними супутніх їм перетворень (4) і (8), користуючись непрямим методом розрахунку:
(4) С + СО2 = 2СО (4) С + СО2 = 2СО
- -
(8) СО2 + Н2 = СО + Н2О (8) 2×(СО2 + Н2 = СО + Н2О)
(6) С + Н2О = СО + Н2 (7) С + 2Н2О = СО2 + 2Н2
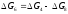 ;
;
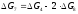 ;
;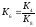 ;
;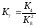 .
.
Залежності
констант рівноваги реакцій (6) і (7) від
температури мають
вигляд
 ;
;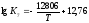 .
У системі, що складається з вуглецю і
водяної пари, обидві реакції (6) і (7)
протікають паралельно, причому переважний
розвиток однієї з них залежить
від
температури. При підвищенні температури
стійкість СО в газовій
фазі
стає вище, ніж СО2
і тому вихід реакції (6) збільшується,
вона одержує більший розвиток, ніж
реакція (7).
.
У системі, що складається з вуглецю і
водяної пари, обидві реакції (6) і (7)
протікають паралельно, причому переважний
розвиток однієї з них залежить
від
температури. При підвищенні температури
стійкість СО в газовій
фазі
стає вище, ніж СО2
і тому вихід реакції (6) збільшується,
вона одержує більший розвиток, ніж
реакція (7).
Взаємодія вуглецю з киснем
Відомо дві реакції взаємодії вуглецю з киснем
реакція повного горіння (реакція 1) С + О2 = СО2 + Q ΔG0 = -393260 -2,29·Т.
і реакція неповного горіння (реакція 2) С + 1/2О2 = СО + Q. ΔG0= -110560 - 89,875·Т.
Обидві
реакції екзотермічні, з підвищенням
температури рівновага зміщується вліво,
величина константи рівноваги повинна
убувати. Рівновага реакції (1) не залежить
від тиску, а реакції (2) – залежить. При
підвищенні тиску рівновага реакції (1)
зміщується вліво. Величини константи
рівноваги записуються
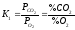 ;
;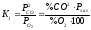 .
.
За правилом фаз Гіббса число ступенів свободи для першої та другої реакції С = 2 – 2 + 2 = 2; для визначення стану системи необхідно задатися двома змінними.
Для отримання термодинамічних функцій реакцій (1) і (2) можна скористатися законом Гесса і провести складання вже відомих реакцій
(3) С + О2 = СО2
+
(4) СО2 + С = 2СО
(1) С + О2 = СО2
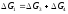 ;
;
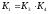 .
.
Залежність
константи рівноваги реакції (1) від
температури
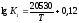
і для реакції (2)
(3) 2× (С + 1/2О2 = СО2)
+
(4) СО2 + С = 2СО
(2) С + О2 = СО2
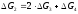 ;
;
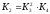 .
.
Залежність
константи реакції (2) від температури
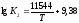 .
.