- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
4.1 Відновлення оксидів газами
Термодинаміка
відновлення оксидів металу СО:
МеО + СО = Ме + СО2,
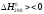 .
Реакція може бути
як екзотермічною, так і ендотермічною.
Число ступенів свободи рівне С = 3 + 2 –
3 = 2. Прийнявши активності чистого металу
і оксиду рівними одиниці, одержимо вираз
константи рівноваги реакції
Кp
=
.
Реакція може бути
як екзотермічною, так і ендотермічною.
Число ступенів свободи рівне С = 3 + 2 –
3 = 2. Прийнявши активності чистого металу
і оксиду рівними одиниці, одержимо вираз
константи рівноваги реакції
Кp
=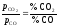 ,
оскільки %СО + %СО2
= 100, то
,
оскільки %СО + %СО2
= 100, то
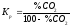 ,
отже,
,
отже,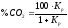 ,
тобто рівноважні концентрації СО і СО2
залежать тільки від температури. Якщо
відновлення протікає
з виділенням тепла,
то Кр
убуває, а %СОр
збільшується з
підвищенням температури
(рис. 4.1). Для ендотермічного процесу
виходить протилежна
залежність.
,
тобто рівноважні концентрації СО і СО2
залежать тільки від температури. Якщо
відновлення протікає
з виділенням тепла,
то Кр
убуває, а %СОр
збільшується з
підвищенням температури
(рис. 4.1). Для ендотермічного процесу
виходить протилежна
залежність.
|
|
|
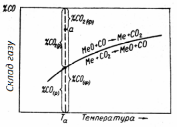
Рис. 4.1 - Залежність рівноважного складу газу від температури в екзотермічній реакції відновлення СО |
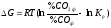 ,
з якого виходить, що при даній
температурі напрям
процесу і спорідненість МеО до СО
залежать від співвідношення
фактичних і рівноважних
концентрацій СО і СО2.
Якщо
,
з якого виходить, що при даній
температурі напрям
процесу і спорідненість МеО до СО
залежать від співвідношення
фактичних і рівноважних
концентрацій СО і СО2.
Якщо
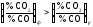 ,
то
,
то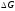 < 0, і суміш даного складу відновлюватиме
оксид, в протилежному
випадку – окислятиме метал. Проілюструємо
сказане графіком (рис.
4.1). Крапки на кривій
відповідають рівноважним
умовам. Крапки вище за
криву (наприклад, а)
відповідає надлишку СО і недоліку СО2
порівняно з рівноважними концентраціями,
тобто відновним газовим
сумішам, оскільки
< 0, і суміш даного складу відновлюватиме
оксид, в протилежному
випадку – окислятиме метал. Проілюструємо
сказане графіком (рис.
4.1). Крапки на кривій
відповідають рівноважним
умовам. Крапки вище за
криву (наприклад, а)
відповідає надлишку СО і недоліку СО2
порівняно з рівноважними концентраціями,
тобто відновним газовим
сумішам, оскільки
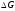 < 0. Нижче за криву розташовується
крапки, що належать
окислювальним по
відношенню до даного металу сумішам,
< 0. Нижче за криву розташовується
крапки, що належать
окислювальним по
відношенню до даного металу сумішам,
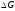 > 0.
> 0.
Рівновага
реакції МеО + СО = Ме + СО2 визначається
рівністю
![]() =
=![]() ,
де
,
де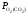 =
=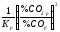 –
рівноважний парціальний тиск О2
в реакції 2СО+О2
= 2СО2,
який характеризує окислювальну здатність
газової суміші.
–
рівноважний парціальний тиск О2
в реакції 2СО+О2
= 2СО2,
який характеризує окислювальну здатність
газової суміші.
Підвищення
міцності оксиду (зменшення його пружності
дисоціації (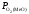 )
вимагає відповідного зниження
)
вимагає відповідного зниження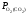 (окислювальної здатності), тобто зміни
рівноважного складу
газу у напрямі зменшення концентрації
окислювача (СО2)
і збільшення концентрації відновника
(СО). Чим міцніше оксид, тим багатше
відновником (СО) повинен бути газ і тим
вище розташовуються
рівноважні криві в
координатах %СО = (Т)
(рис. 4.2).
(окислювальної здатності), тобто зміни
рівноважного складу
газу у напрямі зменшення концентрації
окислювача (СО2)
і збільшення концентрації відновника
(СО). Чим міцніше оксид, тим багатше
відновником (СО) повинен бути газ і тим
вище розташовуються
рівноважні криві в
координатах %СО = (Т)
(рис. 4.2).
|
|
|
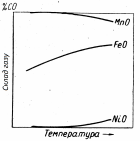
Рис. 4.2 - Схема залежності рівноважного складу газу від температури в реакціях відновлення різних оксидів газом СО |
І – легковідновні оксиди Cu2O, NiO, CoO, Fe2O3, Mn2O3, MnO2 легко віддають О2, в газовій фазі %СО 0, а %СО2 100%, відновлення протікає практично необоротно. Реакції відновлення протікають з виділенням тепла +Q, К >> 1.
ІІ – оксиди важковідновні, великої хімічної міцності MnO, SiO2, Al2O3, CaO. Рівноважна газова фаза містить близько 100% СО, протікають з поглинанням тепла (–Q), К << 1.
ІІІ – оксиди проміжної хімічної міцності Fe3O4, FeO, Mn3O4, WO2і т.п. Рівноважний склад газу містить сумірні кількості СО і СО2.Реакції або слабкоендотермічні або слабкоекзотермічні.
Термодинаміка
відновлення воднем:МеО + Н2= Ме + Н2О,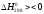 .
.
Реакція
може бути як екзотермічною, так і
ендотермічною. Число ступенів свободи
рівне С = 3 + 2 – 3 = 2. Прийнявши активності
чистого металу і оксиду рівними одиниці,
одержимо вираз константи рівноваги
реакції Кp
=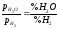 ,
оскільки %Н2
+ %Н2О
= 100, то
,
оскільки %Н2
+ %Н2О
= 100, то
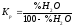 ,
отже,
,
отже,
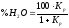 ,
тобто рівноважні концентрації Н2
і Н2О
залежать тільки від
температури. За хімічною
міцністю оксиди також діляться, як і
при відновленні СО, на три групи.
,
тобто рівноважні концентрації Н2
і Н2О
залежать тільки від
температури. За хімічною
міцністю оксиди також діляться, як і
при відновленні СО, на три групи.