- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
3.5 Кінетичні закономірності горіння твердого вуглецю
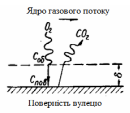
Схема процесу горіння вуглецю зображена на рис.3.8.
Шматок коксу омивається потоком повітря. В об'ємі потоку завдяки турбулентному перемішуванню концентрація кисню скрізь однакова, біля поверхні коксу є тонкий шар газу, швидкість якого рівна нулю. Цей тонкий шар називається дифузійним шаром і має товщину . У шарі відбувається зміна концентрації кисню від соб до спов, де соб – концентрація в об'ємі газу, тобто на зовнішній поверхні шару ; спов – концентрація на поверхні коксу.
|
|
|
Рис. 3.8 – Схема горіння коксу в потоку повітря |
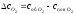 забезпечує дифузію кисню
до поверхні
коксу. Це зовнішня дифузія. Оскільки
кокс є пористою речовиною, то відбувається
дифузія кисню в порах – це внутрішня
дифузія. Підведений до поверхні коксу
кисень адсорбується на поверхні
і утворює
поверхневі комплекси. Відбувається
хімічна реакція
взаємодії,
сумарно об'єднуюча процес адсорбції
кисню і утворення
хімічних
з'єднань СО і СО2.
Молекули оксидів
вуглецю, що
утворилися, десорбіруються з поверхні
коксу, діффундують через дифузійний
шар і
відводяться в ядро газового потоку, в
якому їх концентрація
усереднюється.
забезпечує дифузію кисню
до поверхні
коксу. Це зовнішня дифузія. Оскільки
кокс є пористою речовиною, то відбувається
дифузія кисню в порах – це внутрішня
дифузія. Підведений до поверхні коксу
кисень адсорбується на поверхні
і утворює
поверхневі комплекси. Відбувається
хімічна реакція
взаємодії,
сумарно об'єднуюча процес адсорбції
кисню і утворення
хімічних
з'єднань СО і СО2.
Молекули оксидів
вуглецю, що
утворилися, десорбіруються з поверхні
коксу, діффундують через дифузійний
шар і
відводяться в ядро газового потоку, в
якому їх концентрація
усереднюється.
Потік кисню до одиниці поверхні (швидкість підведення Д) коксу: Д = ·(соб – спов), де – коефіцієнт масопереносу, рівний D/. Коефіцієнт називають константою швидкості дифузії, вимірюється в см/с. Швидкість хімічної реакції взаємодії вуглецю з киснем рівна К = ККспов, де КК – константа швидкості адсорбційно-хімічної стадії. Цю стадію називають кінетичною. Швидкість к теж відноситься до одиниці поверхні.
Коли процес стає стаціонарним, то швидкості послідовних ланок рівні один одному, а також і загальній швидкості процесу. Цю загальну швидкість назвемо спостережуваною
спос = Д = К.
Концентрація
на поверхні встановлюється на такому
рівні, щоб забезпечувалася ця рівність
спос
= Д
= К.
Тогда ·(соб
–
спов)
= КК·спов.
Невизначену поверхневу концентрацію
спов
можна
замінити її об'ємною
концентрацією
соб:
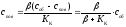 .
Спостережувана швидкість буде рівна
.
Спостережувана швидкість буде рівна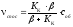 .
Концентрація в об'ємі доступна для
безпосереднього вимірювання.
.
Концентрація в об'ємі доступна для
безпосереднього вимірювання.
Значення
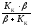 є
постійною величиною, вона може бути
позначенаКН
–
константа
швидкості процесу, спостережувана в
ході досвіду. Таким чином,
є
постійною величиною, вона може бути
позначенаКН
–
константа
швидкості процесу, спостережувана в
ході досвіду. Таким чином,
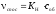 ,
де
,
де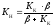 або
або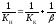 .
.
Зворотна величина спостережуваної константи рівна сумі зворотних значень констант швидкостей послідовних становлючих ланок. Це відповідає процесам, що складаються з будь-якого числа послідовно стадій, які протікають. Величина, зворотна константі швидкості, називається опором ланки. Загальний опір процесу рівний сумі опорів окремих ланок.
Типи процесів
У процесі, що протікає через послідовні ланки, швидкість найповільнішої ланки визначає швидкість всього процесу. Така ланка називається лімітуючою, воно має якнайменшу константу швидкості. Залежно від співвідношень констант швидкостей різних ланок розрізняють наступні режими протікання процесу.
I. Внешнедіфузійний режим. Процес лімітується зовнішньою дифузією, в нашому випадку – доставкою кисню до поверхні коксу, тобто << КК. Тому в рівнянні перший доданок невимірний більше другого, яким можна знехтувати і одержимо КН . Таким чином, весь кисень, який поступає до поверхні витрачається на реакцію горіння. Швидкість горіння визначається доставкою кисню до поверхні коксу. Кисень інтенсивно витрачається на зовнішній поверхні коксу, і його майже не залишається для проникнення в пори.
2. Внутредіфузійний режим. Усередині коксу кисень поволі проникає в пори і нагромаджується на зовнішній поверхні шматків. В стаціонарному режимі концентрація на поверхні спов стає рівної соб. Дифузійний потік через дифузійний шар сповільнюється і швидкість його наближається до швидкості витрачання кисню. Реакційна зона розповсюджується на невелику частину шматка коксу. В порах кисень діфундірує набагато повільніший, ніж використовується по хімічній реакції, і усередині шматка коксу його концентрація швидко убуває.
3. Внутрекінетичний режим. Реакційна зона розповсюджується на весь об'єм шматка коксу, усередині якого концентрація кисню падає трохи. Цей режим виникає при горінні дрібних шматків коксу, що має порівняльно крупні пори. Реакція горіння здійснюється з майже однаковою швидкістю на всій внутрішній поверхні, яка стає як би рівнодоступною. Спостережувана константа швидкості співпадає з константою швидкості хімічної реакції.
4. Внешнекінетічний режим. Лімітуючою ланкою є хімічна реакція на поверхні, >> КК. Цей випадок виникає тоді, коли в шматку речовини майже відсутні пори, тут маємо КН КК реакція йде виключно на зовнішній поверхні.
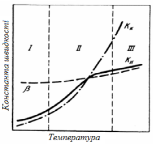
На практиці часто реалізуються змішані режими, в які включаються перехідні області, а вказані вище режими реалізуються рідко. Частіше спостережувана швидкість процесу характеризується як дифузійними, так і кінетичними характеристиками. На рис. 3.9 показана теоретична залежність констант швидкостей окремих ланок процесу від температури.
|
|
Рис. 3.9 - Залежність констант швидкостей реакції від температури: КК – константа швидкості хімічної взаємодії; – константа швидкості дифузії; КН – спостережувана константа швидкості
|
У області I КК << процес лімітується кінетичною стадією – хімічною взаємодією. В області III при високих температурах процес обмежується дифузією, оскільки КК >> . Область II – режим змішаного контролю. Лінія КН відповідає зміні спостережуваної константи швидкості. При низьких температурах вона майже співпадає з константою швидкості хімічної реакції, при високих температурах – з дифузійними.
Можна зробити загальні рекомендації по інтенсифікації металургійних процесів з участю газової, твердої або рідкої фаз. Спочатку визначають лімітуючу ланку процесу. Якщо процес лімітується кінетичною стадією, то для прискорення процесу потрібно підвищувати температуру, використовувати каталізатори, збільшити питому поверхню матеріалу шляхом подрібнення, продуванням газу через рідкий розплав, продуванням порошкоподібних матеріалів або вдуванням розпиляного палива і використовувати речовини з підвищеною пористістю. При контролі дифузійної області рекомендується подрібнювати матеріал, використовувати речовини з розвиненими порами, підвищувати швидкість газових потоків і ступінь їх тербулентності.
1 Основні поняття та цілі теорії металургійних процесів 1
2 Теоретичні основи утворення і дисоціації складних хімічних сполук 4
2.1 Термодинаміка утворення і дисоціації карбонатів 4
2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів 7
2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза 8
2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань 12
2.5 Процеси окислення твердих металів 14
2.6 Будова структури окалини 16
3 Основи теорії горіння 17
3.1 Термодинаміка гомогенного горіння 17
3.2 Механізми горіння гомогенних реакцій 20
3.3 Термодинаміка реакцій горіння твердого вуглецю 22
3.4 Механізми горіння гетерогенних реакцій 25
3.5 Кінетичні закономірності горіння твердого вуглецю 26
4.1 Відновлення оксидів газами 30
4.2 Термодинаміка відновлення оксидів твердим вуглецем 32
4.3 Відновлення з участю розчинів 34
4.4 Відновлення оксидів заліза 36
4.5 Механізм відновлення оксидів металів газами 38
4.6 Механізм відновлення оксидів твердим вуглецем 40
5. Основы окислительных процессов 41
5.1. Состав, свойства и роль шлака в процессе производства стали 41
5.2. Металлический расплав 42
5.3. Важнейшие реакции сталеплавильных процессов 42
5.3.1 Окисление углерода 42
5.3.2 Окисление кремния 43
5.3.3 Поведение марганца 44
5.3.4 Поведение фосфора 44
5.3.5 Поведение серы 45
5.3.6 Газы в стали 45
5.4 Раскисление стали 48
5.4.1 Способы раскисления 48
5.4.2 Продукты раскисления и их удаление 49
У чорній металургії більшість металів в природному стані знаходиться у вигляді оксидів – це оксиди заліза, марганцю, хрому, кремнію та інші. Для витягання металу з руди у виробництві здійснюють процес відновлення. Процес відновлення можна розглядати і як окислювальний відносно відновника, оскільки віднімаючи кисень з молекули оксиду металу, він сам відновник – окислюється. Тому загалом ці процеси відносять до окислювально-відновних.
Реакція окислювально-відновного типу записуються у вигляді МеО + В = Ме + В; Н 0 .
Підсумовуванням двох реакцій, утворення оксиду відновника і утворення оксиду металу, одержуємо реакцію відновлення
1. В + 1/2О2 = ВО
-
2. Ме + 1/2О2 = МеО
3. МеО + В = ВО + Ме
По
другому закону термодинаміки G3
= G1
–
G2,
G
= – RTlnKP
= RTln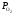 ,
,
К3
= К1/К2
=
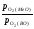 .
.
Для
здійснення відновлення G3
повинно
бути менше 0, це можливо коли G1
G2,
тобто спорідненість відновника до кисню
більш ніж спорідненість металу до кисню.
Відновником по відношенню до оксиду
металу може бути будь-який елемент із
спорідненістю до кисню більшим, ніж у
відновлюваного металу, тобто GВО
GМеО
або
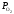 (BO)
(BO)
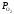 (MeO).
(MeO).
Таким чином, окислювально-відновні реакції знаходяться в рівновазі, якщо за даних умов (температурі, складі розчинів, ступені дисперсності фаз і т.п.) речовини Ме і В володіють однаковою спорідненістю до О2, тобто пружності дисоціації їх оксидів рівні між собою. За відсутності рівноваги ці реакції завжди протікають у напрямі утворення міцнішого оксиду або оксиду з меншою в даних умовах пружністю дисоціації. Як відновники використовують лише ті речовини, які в даних умовах володіють великою спорідненістю до О2, ніж відновлювані.
Керуючись цим і використовуючи розташування елементів за збільшенням спорідненість до кисню можна підібрати відновник для речовини, що цікавить нас. Залізо легко відновлюється Mn, Si, Al і т.д., навпаки, мідь і нікель не придатні для цієї мети. Вживання вказаних відновників виправдано при розкислюванні стали і в, так званих, металотермічних процесах. Відновниками звичайно служать кремній (силікотермія) і алюміній (алюмінотермія). Ці процеси використовується для отримання безвуглецевих феросплавів. Реакції відновлення при металотермічном відновленні протікають з виділенням тепла. Згідно правила Жемчужного процес може йти без зовнішнього підігріву, якщо на 1 г шихти виділяється не менше 2300 Дж теплоти.
Для масового виробництва різних сортів чавуну і звичних феросплавів використовують порівняно дешевий і широко поширений в природі відновник – вуглець. Процес називається вуглетермічним, який супроводжується неминучим навуглецьовуванням відновлених елементів