
- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
5.2.Металлический расплав
Получаемый сплав содержит различные примеси (С, Si,Mn,Ni,Cr,O,P,Sи др.), которые по форме существования в железе можно разбить:
- Mn, Ni, Crи др. Размеры их атомов и железа отличаются не значительно (до 10-15%), такие примеси обладают неограниченной растворимостью в жидком железе и высокой в твердом. Они образуют с железомтвердые растворы типа замещения;
- С, N, H. Радиусы их атомов меньше, чем у железа (в 2-4 раза) и они образуюттвердые растворы типа внедрения. Углерод с железом, а также с другими металлами дают химические соединения -карбиды, азот –нитриды, водород –гидриды.
- Si, P. В жидком железе их растворимость неограниченна, а в твердом – значительна. С железом образуют довольно прочные соединения: кремний –силициды, фосфор -фосфиды.
- О, S. Оба элемента обладают малой растворимостью в твердом железе (~0,01 % О, ~0,015 %S). В жидком железе кислород растворяется ограниченно (~0,23 % при 16000С), аS- значительно. С железом образуют прочные соединения: кислород –оксиды, сера –сульфиды.
5.3. Важнейшие реакции сталеплавильных процессов
Сталь получают из чугуна и лома методом окислительного рафинирования (т. е. очищения). Кислород для окисления содержащихся в них примесей (углерода, кремния, марганца, фосфора и др.) поступает или из атмосферы, или из железной руды и других окислителей, либо при продувке ванны газообразным кислородом. Стадии окислительного рафинирования:
передача кислорода металлу из окисляющей фазы;
окислительные реакции;
удаление из металла продуктов реакции в отдельную фазу.
5.3.1 Окисление углерода
В современных сталеплавильных процессах главной частью металлической шихты является твердый или жидкий чугун, содержание углерода в котором всегда значительно выше, чем должно быть в готовой стали. В связи с этим сталеплавильные процессы сопровождаются процессом удаления избыточного углерода из металла. Удаление 1 % С из металла связано с образованием газовой фазы, объем которой значительно больше объема жидкой ванны. Выделение из ванны пузырей газа, представляющего продукт окисления углерода, сопровождается интенсивным перемешиванием ее, ускорением процессов тепло- и массообмена, дегазации металла и удаления из него неметаллических включений.
Растворенный углерод в железе условно обозначают [С]. Продуктом реакции окисления углерода в расплаве является преимущественно монооксид углерода СО, хотя при низких концентрациях углерода в металле возможно образование незначительных количеств диоксида углерода СО2. Схематически можно представить реакцию окисления углерода в виде
[С] + [О] = {СО}
(фигурные скобки означают, что продукт реакции входит в самостоятельную газовую фазу). Константу равновесия реакции можно определить из следующего выражения
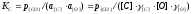 .
.
Для низких
концентраций исходных компонентов
приближенно считают значения
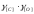 ,
равными единице. Тогда при
,
равными единице. Тогда при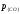 = 1 имеемКC= 1/[С].[О], а так как 1/КC=const, то произведение
[С].[О] при данной температуре
постоянно, его обозначают символомm,
т.е. [С].[О] =m.
Следовательно, от концентрации углерода
зависит концентрация кислорода в
металле. Чем выше содержание углерода
в металле, тем ниже содержание кислорода
в нем и наоборот. Однако в реальных
условиях реакция равновесие не достигает
и фактическое содержание кислорода в
металле выше, чем равновесное.
= 1 имеемКC= 1/[С].[О], а так как 1/КC=const, то произведение
[С].[О] при данной температуре
постоянно, его обозначают символомm,
т.е. [С].[О] =m.
Следовательно, от концентрации углерода
зависит концентрация кислорода в
металле. Чем выше содержание углерода
в металле, тем ниже содержание кислорода
в нем и наоборот. Однако в реальных
условиях реакция равновесие не достигает
и фактическое содержание кислорода в
металле выше, чем равновесное.
Выделение оксида
углерода возможно, если присутствуют
условия, облегчающие зарождение пузырей
СО. Такими условиями могут быть продувка
металла кислородом или воздухом и
наличие шероховатости на поверхности
огнеупорной футеровки, контактирующей
с жидким металлом. В этих случаях имеются
готовые газообразные полости в металле
с развитой поверхностью раздела
газ-металл, в которые беспрепятственно
выделяется монооксид углерода СО, как
продукт взаимодействия углерода и
кислорода вблизи этой поверхности.
Выделяющийся пузырь должен преодолеть
давление, представляющее собой сумму
давлений - атмосферы, столба шлака,
столба металла и силы поверхностного
натяжения σрасплава, т.е.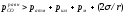 ,
гдеr -радиус
пузыря монооксида углерода.
,
гдеr -радиус
пузыря монооксида углерода.
Повышение температуры способствует не только повышению скорости окисления углерода, но и повышает химическое сродство углерода к кислороду.
Снижение внешнего давления (создание разрежения над металлом) в соответствии с принципом Ле-Шателье приводит к смещению равновесия реакции [С] + [О] = {СО} в сторону образования продукта реакции. В равновесных условиях при этом окажется более низкая концентрация кислорода в металле, а углерод становится хорошим раскислителем.
