
- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
Зміст
1 Основні поняття та цілі теорії металургійних процесів 1
2 Теоретичні основи утворення і дисоціації складних хімічних сполук 4
2.1 Термодинаміка утворення і дисоціації карбонатів 4
2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів 7
2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза 8
2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань 12
2.5 Процеси окислення твердих металів 14
2.6 Будова структури окалини 16
3 Основи теорії горіння 17
3.1 Термодинаміка гомогенного горіння 17
3.2 Механізми горіння гомогенних реакцій 20
3.3 Термодинаміка реакцій горіння твердого вуглецю 22
3.4 Механізми горіння гетерогенних реакцій 25
3.5 Кінетичні закономірності горіння твердого вуглецю 26
4. Теорія відновних процесів 29
4.1 Відновлення оксидів газами 30
4.2 Термодинаміка відновлення оксидів твердим вуглецем 32
4.3 Відновлення з участю розчинів 33
4.4 Відновлення оксидів заліза 35
4.5 Механізм відновлення оксидів металів газами 37
4.6 Механізм відновлення оксидів твердим вуглецем 39
5. Основы окислительных процессов 40
5.1. Состав, свойства и роль шлака в процессе производства стали 40
5.2. Металлический расплав 41
5.3. Важнейшие реакции сталеплавильных процессов 42
5.3.1 Окисление углерода 42
5.3.2 Окисление кремния 43
5.3.3 Поведение марганца 43
5.3.4 Поведение фосфора 43
5.3.5 Поведение серы 44
5.3.6 Газы в стали 45
5.4 Раскисление стали 47
5.4.1 Способы раскисления 47
5.4.2 Продукты раскисления и их удаление 48
1 Основні поняття та цілі теорії металургійних процесів
Сучасна теорія металургійних процесів включає хімічну термодинаміку оборотних і необоротних процесів, газогідродинаміку, хімічну кінетику, теплообмін, масообмін. Це забезпечує рішення ряду найважливіших для металургії задач:
- аналіз і визначення принципових можливостей вибраного напряму процесів шляхом аналізу відомих физико-хімічних закономірностей,
- визначення оптимальних физико-хімічних умов процесу (температура, тиск, концентрації) для отримання якнайкращого результату,
- визначення лімітуючих ланок процесу і пошуків шляхів їх подолання.
Теорія металургійних процесів - це фізична хімія, що описує поведінку хімічно реагуючих систем при високих температурах, в межах від 800 до 2500 К і більш.
У даний час металургія одержує близько 70 металів, які прийнято підрозділяти на кольорові і чорні. До останніх відносять всього чотири метали - залізо, марганець, ванадій і хром. Група кольорових металів більш багаточисельна, тому підрозділяється на наступні підгрупи:
Важкі - мідь, свинець, цинк, нікель, олово, ртуть, всього 18 елементів.
Легкі метали - алюміній, магній, титан, кремній, лужні і лужноземельні метали, всього 12 елементів.
Благородні - золото, срібло, платина і ін. всього 8 елементів, свою назву вони одержали через відсутність спорідненості до кисню, тому в природі знаходяться у вільному (неокисленому) стані.
Рідкісні метали - тугоплавкі - 5 елементів, рідкоземельні - 16 елементів і радіоактивні - 16 елементів.
За способом виробництва процеси отримання металів підрозділяються на три групи: пірометалургійні, гідрометалургійні і електрометалургійні процеси.
Перші з них протікають при високих температурах порядка 1000 - 2500 К при цьому компоненти знаходяться в розплавленому і розчиненому станах.
Другі протікають у водних, рідше в органічних, розчинниках, при температурах 300 - 600 К. Многие гідрометалургійні процеси протікають також і при підвищеному тиску, тобто в автоклавах.
Електрометалургійні процеси протікають на електродах як у водних розчинах, так і в сольових розплавах при різних температурах.
Сировиною для виробництва багатьох металів є, перш за все, окислені руди, з них одержують алюміній, залізо, хром, марганець, титан, частково мідь, нікель, свинець. З менш поширених сульфідних руд одержують мідь, свинець, нікель, кобальт, і благородні метали. З хлорідних руд (з вод морів і озер) одержують магній, кальцій і лужні метали.
При отриманні чавуну та сталі в металургійних печах можливо існування трьох фаз:
газової фази, що складається з газів СО, СО2, Н2, Н2О,парів металів і оксидів;
шлакової фази, що складається з розплавлених оксидів CaO, SiO2, Al2O3, FeO, MnO та ін.
металевої фази, що складається з рідкого заліза і розчинених в ньому домішок, таких як вуглець, марганець, кремній, фосфор, сірка і ін.
Всі три фази взаємодіють між собою хімічно і фізично. Оксид заліза відновлюється в шлаковій фазі і переходить в металеву фазу. Кисень, розчинений в шлаковій фазі, переходить в металеву фазу і окисляє в ній домішки. Краплі оксидів спливають в металевій фазі, а краплі металу осідають в шлаковій фазі. Перехід компонентів з однієї фази в іншу пов'язаний з перенесенням їх через межі розділу фаз, отже інженер-металург працює з багатокомпонентними, гетерогенними, хімічно реагуючими системами.
При вивченні основ виробництва металів і сплавів використовують основні поняття і закони.
Об'єктом будь-якого дослідження є система. Системою називається сукупність (група) тіл, що знаходяться у взаємодії. Система може бути однорідною (гомогенної) і неоднорідною (гетерогенної). В однорідній системі немає поверхонь розділу. Газова атмосфера робочого простору будь-якого металургійного агрегату складається з декількох компонентів (N2, О2, СО, СО2, Н2О та ін.). Проте вона може служити прикладом однорідної системи, оскільки є газовою сумішшю з однаковим складом і властивостями в будь-якій точці системи і не має поверхонь розділу.
Неоднорідна система характеризується наявністю окремих складових - фаз. В умовах сталеплавильного процесу метал, шлак, гази, що відходять, та футеровка печі складають фази неоднорідної системи. Характеристикою системи служать параметри стану. Параметри стану - величини, що визначають стан системи (об'їм, концентрація, тиск, температура). Всяка зміна в системі, пов'язана із зміною параметрів стану, називається процесом. Прикладом процесу може служити будь-яка хімічна реакція в сталеплавильному агрегаті.
Хімічні реакції при виплавці чавуну і стали проходять переважно в розчинах. У металургії процеси звичайно протікають в трьох фазах - металевої, шлакової і газової. Щоб показати, в якій фазі знаходяться речовини, прийнято їх позначення брати в дужки: [ ], ( ) або { }, що відповідає металевій, шлаковій і газовій фазам, відповідно. Наприклад, [Мп] + [О] = (МпО) означає, що реакція відбувається між марганцем і киснем, розчиненими в металі, з утворенням оксиду марганцю, розчиненого в шлаку.
Всі хімічні реакції проходять з виділенням (екзотермічні) або поглинанням (ендотермічні) теплоти. Теплота, що виділяється або поглинається при хімічних реакціях, називають тепловим ефектом (Q). Тепловий ефект екзотермічних реакцій має знак плюс, ендотермічних - мінус.
Всі хімічні реакції ділять на оборотні і необоротні. Необоротною реакцією називають реакцію, при якій початкові речовини практично повністю перетворюються на продукти реакції. Оборотної називають реакцію, яка залежно від умов може протікати одночасно як в прямому, так і у зворотному напрямі. Оборотні реакції не допускають повного витрачення будь-якої з реагуючих речовин. Вони протікають до встановлення хімічної рівноваги. В оборотній реакції швидкість прямого і зворотного процесів рівні між собою. Під швидкістю хімічної реакції мається на увазі зміна концентрації речовини (збільшення або зменшення) в одиницю часу.
Зупинимося на деяких фізико-хімічних законах, якими необхідно керуватися при аналізі явищ, що протікають в металургійній ванні.
Закон
діючих мас. Швидкість
реакції пропорційна концентрації
реагуючих речовин. Так, для оборотної
реакції аА + вВ ↔ сС + dDвирази для
швидкостей прямої і зворотної реакції
мають вигляд
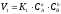 ,
,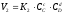 ,де К1
і К2
- константи швидкостей прямої і зворотної
реакцій;
,де К1
і К2
- константи швидкостей прямої і зворотної
реакцій;
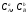 ,
,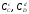 ,
- концентрації реагуючих речовин.
,
- концентрації реагуючих речовин.
Рівновага
даної реакції наступає у тому випадку,
коли
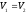 або
або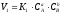 =
=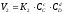 .
Звідси
.
Звідси
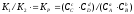 ,
деКP
- константа рівноваги реакції, яка
залежит тільки від температури і природи
речовин.
,
деКP
- константа рівноваги реакції, яка
залежит тільки від температури і природи
речовин.
Концентрації газоподібних речовин можуть замінюватися відповідними парціальними тисками. Наприклад, для реакції [С] + [О] = {СО} константа рівноваги повинна бути записана K = рCO/[С]·[О, де рCO - парціальний тиск газу СО; [С], [О] - концентрації вуглецю і кисню, розчинені в металі.
Принцип зсуву рівноваги (принцип Ле-Шателье). Якщо на систему, що знаходиться в стійкій рівновазі, проведена зовнішня дія (змінена одна з умов, що визначають рівновагу: температура, тиск, концентрація), то в системі виникають такі процеси, які зменшують ефект даної дії і приводять систему до нового стану стійкої рівноваги.
При підвищенні температури рівноважна реакція, що протікає з поглинанням тепла, зсовується у бік збільшення продуктів реакції. Пониження температури зсовує реакцію у бік збільшення реагуючих речовин. Для реакції, що протікає з виділенням тепла, закономірності будуть протилежними. Вплив тиску на зсув рівноваги хімічної реакції залежить від кількості газоподібних молекул в лівій і правій частинах рівняння реакції. Підвищення тиску викликає зсув рівноваги хімічної реакції у бік зменшення числа газоподібних молей. Якщо реагуючі речовини і продукти реакції займають однаковий об'єм (реакція йде без зміни числа газоподібних молей), то зміна тиску не викликає зсуву рівноваги.
Закон розподілу. Для металургії закон розподілу має велике практичне значення. Суть його полягає в наступному. Якщо в систему, що складається з двох рідин, що не змішуються, тобто що є двома рідкими шарами, ввести невелику кількість третього компоненту, здатного розчинятися в обох рідинах, то він розподіляється між ними відповідно до закону розподілу. Відношення концентрацій третього компоненту в двох рідких фазах, що знаходяться в рівновазі, для даної температури є величиною постійною. Прикладом такої системи може служити метал, шлак і розчинені в них елементи (Si; Мn; S; Р; О2 та ін.). Стосовно цієї металургійної системи закон розподілу можна представити L=(М)/[M],де L - коефіцієнт розподілу; (М) і [М] - концентрації елементу в шлаку і металі. Закон розподілу лежить в основі процесів видалення кисню, сірки, фосфору з рідкого металу в шлак при виробництві сталі. В цьому випадку метал і шлак є двома рідинами, що не змішуються, між якими і розподіляються ці елементи. Будь-які способи зниження їх концентрації в шлаку (викачування шлаку, скріплення в міцні хімічні з'єднання і т. п.) повинні привести до зменшення їх вмісту в сталі.
