- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
У загальному вигляді реакція утворення оксиду для двовалентного металу має вигляд:
2Ме + О2 = 2МеО + Q, а реакція дисоціації 2МеО = 2Ме + О2, константа рівноваги якої
Кp=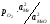 .
.
Коли тверді або
рідкі фази не утворюють між собою
розчинів і не розчинені в інших речовинах,
наприклад в шлаку або в металі, тобто
знаходяться в чистому вигляді, то їх
активності аМеіаМеОрівні 1, аКp
= .
Величина
.
Величина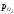 – рівноважний парціальний тиск кисню
при даній температурі для даного оксиду
називається пружністю дисоціації даного
оксиду. Чим менше величина пружності
дисоціації і менше величина ΔG0реакції утворення оксиду, тим міцніше
даний оксид. Пружність дисоціації і
величина ΔG0служать мірою
спорідненості металу до кисню. Зменшення
пружності дисоціації, так само як і
зменшення ΔG0, сприяє підвищенню
спорідненості металу до кисню.
– рівноважний парціальний тиск кисню
при даній температурі для даного оксиду
називається пружністю дисоціації даного
оксиду. Чим менше величина пружності
дисоціації і менше величина ΔG0реакції утворення оксиду, тим міцніше
даний оксид. Пружність дисоціації і
величина ΔG0служать мірою
спорідненості металу до кисню. Зменшення
пружності дисоціації, так само як і
зменшення ΔG0, сприяє підвищенню
спорідненості металу до кисню.
Напрям процесу,
тобто здійснення реакції дисоціації
або утворення оксиду залежить від
співвідношення рівноважного значення
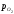 і фактичного парціального тиску кисню
в газовій фазі, відповідно до рівняння
Вант-Гоффа для реакції дисоціації
і фактичного парціального тиску кисню
в газовій фазі, відповідно до рівняння
Вант-Гоффа для реакції дисоціації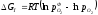 .
.
|
|
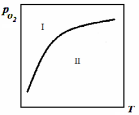
|
Рис. 2.2 – Дисоціація оксидів залежно від температури |
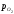 =f(T). В області I над кривою завжди
=f(T). В області I над кривою завжди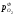 >
>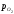 ,
внаслідок чого ΔG0> 0 і в цій
області відбуватиметься утворення
оксиду. В області II нижче за криву
,
внаслідок чого ΔG0> 0 і в цій
області відбуватиметься утворення
оксиду. В області II нижче за криву <
<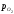 то ΔG0 < 0 і
відбуватиметься дисоціація оксиду.
то ΔG0 < 0 і
відбуватиметься дисоціація оксиду.Дана двокомпонентна (Me– О) система складається з трьох фаз – двох твердих і однієї газоподібної. Тому за правилом фаз Гіббса С = К – Ф + 2 = 2 – 3 + 2 = 1.
Таким чином, кожній температурі відповідає певний тиск кисню, оскільки система має тільки один ступінь свободи.
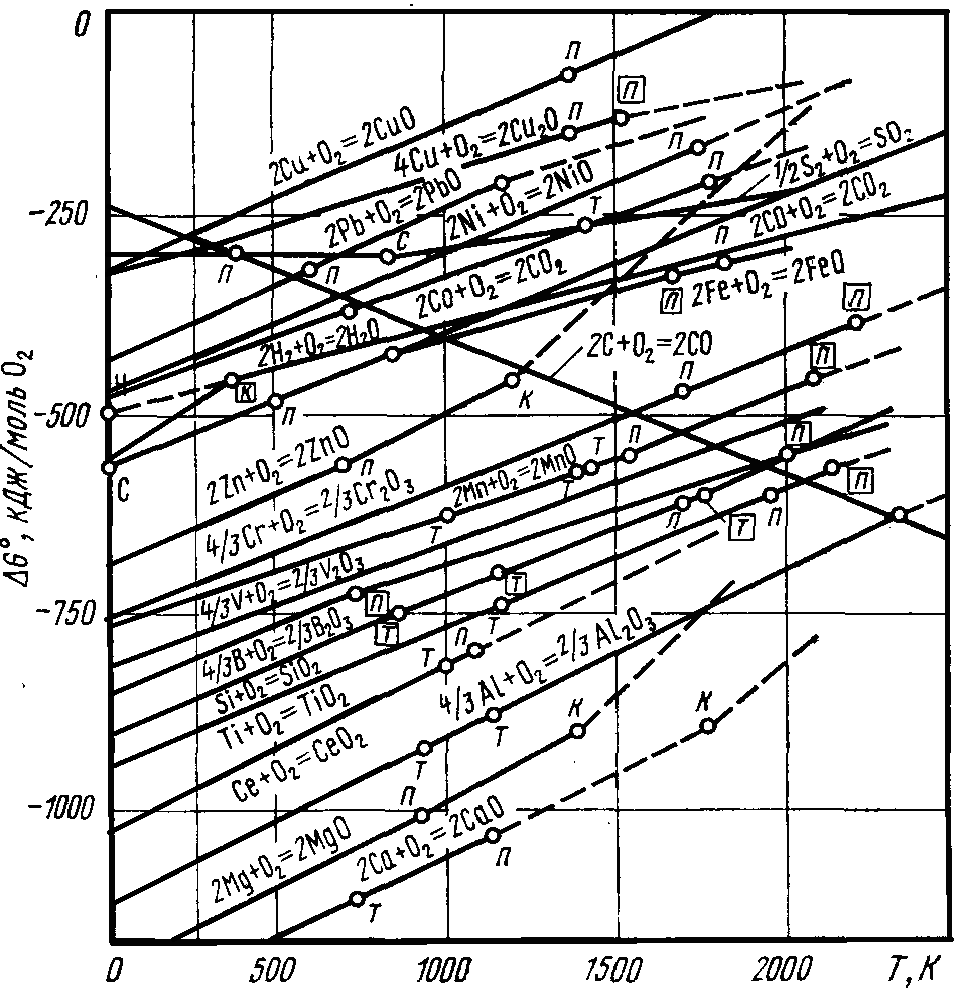
На рис. 2.3 представлена залежність ΔG0реакцій утворення оксидів від температури. Елементи Cu, Ni, Co, Fe, Cr, Mn,V, Si,Ti, Al, Mg,Caрозташовані в порядку зростання їх спорідненості до кисню і збільшення міцності їх оксидів, що підтверджується зменшенням величини ΔG0.
|
|
|
Рис. 2.3 - Залежність зміни стандартних вільних енергій утворення оксидів металів від температури (на 1моль/О2). Температура фазових перетворень для металів: плавлення - П, кипіння - К, сублімація - С. Позначення для фазових перетворень оксидів узяті в рамку |
З підвищенням температури пружність дисоціації оксидів збільшується, а їх міцність відповідно зменшується. Проте, тільки у вуглецю із зростанням температури збільшується спорідненість до кисню, тому вуглець є універсальним відновником. З одного боку, із зростанням температури міцність оксидів падає, з другого боку спорідненість вуглецю до кисню зростає.
2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
Послідовність дисоціації за наявності декількох оксидів або утворення оксидів або інших з'єднань підкоряється принципу послідовності перетворень А. А. Байкова, по якому хімічні перетворення здійснюються послідовно, скачками через хімічні сполуки, існуючі в даній системі, тобто від вищого оксиду до нижчого через проміжні сполуки. Наприклад, для заліза ряд послідовної дисоціації виглядає так: Fe2O3Fe3O4FеО, для марганцю МnO2Mn2O3Mn3O4MnO.
У природі існує три оксиди заліза Fe2O3– гематит, Fе3O4– магнетит і оксид змінного складу – вюстит, що умовно позначається як FeO.
Дисоціація оксидів заліза при t > 570С протікає по наступних реакціях:
2FeO = 2Fe + O2; (2.1)
6Fe2O3= 4Fе3О4+ O2; (2.2)
2Fe3O4 = 6FeO + O2; (2.3)
при t < 570С, де FeO нестійкий, реакції (2.1) і (2.3) не здійснюється, йде реакція
Fe3O4= 3/2 Fe + O2; (2.4)
При високих температурах оксид Fe2O3не стійкий і може розпадатися.
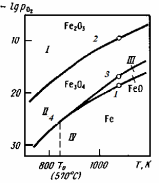
На рис. 2.4 показані залежності логарифма пружності дисоціації оксидів заліза від температури.
|
|
|
Рис. 2.4 - Залежність температури на пружність дисоціації оксидів заліза |
 <
<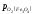 оксид – FeO міцніший, ніж Fe3O4.
При 5700С
оксид – FeO міцніший, ніж Fe3O4.
При 5700С =
=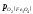 оксиди мають однакову міцність. При цій
температурі в рівновазі знаходяться 4
фази: Fe3O4– FeO – Fe – O2.
Система нонваріантна. По цій діаграмі
можливо встановити області існування
конденсуючих фаз.
оксиди мають однакову міцність. При цій
температурі в рівновазі знаходяться 4
фази: Fe3O4– FeO – Fe – O2.
Система нонваріантна. По цій діаграмі
можливо встановити області існування
конденсуючих фаз.
Область I – це
область стійкого існування Fe2O3,
тут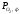 >
> >
>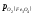 >
> .
При такому парціальному тиску кисню
залізо, вюстіт і магнетит повинні
окислюватися до Fe2O3.
.
При такому парціальному тиску кисню
залізо, вюстіт і магнетит повинні
окислюватися до Fe2O3.
Область II – область
стійкого існування Fе3O4. Тут >
>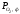 >
>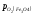 >
> .Оксид Fe2O3повинен дисоціювати до Fе3O4,
а FеO або залізо окислюватися до Fe3O4.
.Оксид Fe2O3повинен дисоціювати до Fе3O4,
а FеO або залізо окислюватися до Fe3O4.
Область III
характеризує стійкий стан FеO,
 >
> >
>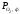 >
> .
У цій області Fe2O3і Fе3О4
відновлюються до FеО, а металево
залізо окислюється до FeO. Область IV –
стійкий стан Fe.
.
У цій області Fe2O3і Fе3О4
відновлюються до FеО, а металево
залізо окислюється до FeO. Область IV –
стійкий стан Fe.
Діаграма стану залізо–кисень
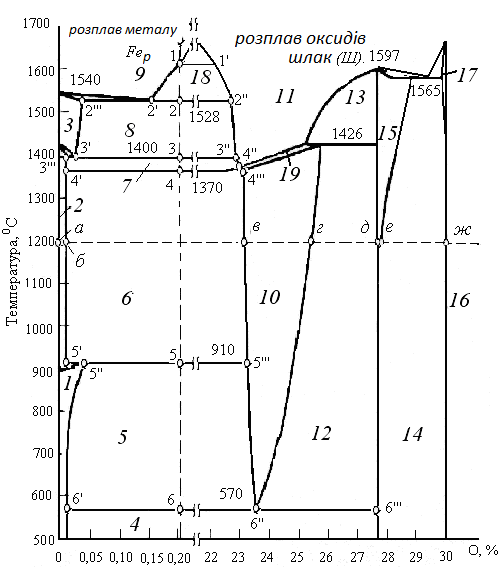
Фазовий склад системи залізо-кисень визначають за допомогою діаграми стану. В цій двокомпонентній системі може одночасно існувати не більше чотирьох фаз, що відповідає нонваріантності системи: С = 2 – 4 + 2 = 0 або Ф = К + 2 = 4. Три фази є конденсуючими. В числі фаз, які конденсують можуть бути: тверді розчини кисню в -Fe,-Fe,-Fe; вюстит, магнетит- і-Fe2О3, тверді і рідкі розчини оксидів. Діаграма стану представлена на рис.2.5. Ліва частина діаграми до розриву має концентрації кисню від 0 до 0,2%, права – від 22 до 31%.
|
|
|
Рис. 2. 5 - Діаграма стану залізо-кисень |
Розглянемо області існування різних фаз.
I – область твердого розчину кисню в -Fe + O2;
II – область твердого розчину кисню в -Fe + O2;
III – область твердого розчину кисню в -Fe + O2;
IV – область трифазного співіснування: твердого розчину кисню в -Fe + магнетиту + O2.
V – область трифазної рівноваги: твердий розчин кисню в -Fe, вюстит з мінімальним вмістом кисню + O2:
VI – область трифазної рівноваги: твердий розчин кисню в -Fe + вюстит з мінімальним вмістом кисню + O2;
VII – область твердого насиченого розчину кисню в -Fe+ шлаковий розплав + O2;
VIII – твердий насичений розчин кисню в -Fe+ шлаковий розплав + O2;
IX – ненасичений розчин кисню в рідкому залізі + O2;
X – область вюститу із змінною концентрацією кисню + O2;
XI – область шлакових розплавів + O2;
XII – трифазна область: вюстит з максимальним вмістом кисню + магнетит + O2;
XIII – шлаковий розплав + магнетит + O2;
XIV – трифазна область – до 1100С магнетит + гематит + O2; вище 1100С – твердий розчин гематиту в магнетиті + гематит + О2; склад змінний, кисню міститься більше, ніж в Fe3O4;
XV – твердий розчин гематиту в магнетиті + O2;
XVI – гематит + O2;
XVII – твердий розчин гематиту в магнетиті + O2.
Магнетит зберігає постійний склад до 1100С, а вищі за цю температуру склад магнетиту буде змінним з надмірним проти стехіометричного вмісту кисню. Магнетит плавиться при 15970С..
Розглянемо процес кристалізації рідкого заліза, що містить 0,22% кисню, відзначивши, що гранична розчинність кисню в залізі при 1600С рівна 0,23%. В крапці 1 повинна утворюватися плівка шлаку – оксидна фаза – рідкий розплав, що відповідає складу 1та містить 22,2 % кисню. Нижче за температуру крапки 1 склад металу змінюється по лінії 1 – 2, а склад шлаку – по лінії 1 - 2. Досягши 1528С починається кристалізація насиченого твердого розчину кисню в-Fe (чисте залізо кристалізується при 1540С).
Гранична розчинність кисню -Fe складає приблизно 0,04%, крапка 2. В крапці 2знаходитимуться в рівновазі чотири фази:-Fe складу 2, розплав заліза складу 2, шлаковий розплав складу 2і О2. При подальшому пониженні температуру склад твердого розчину кисню змінюється по лінії 2- 3, а склад шлаку – по лінії 2– 3. При температурі 1400С-Fe перетворюється в-Fe. При температурі 1370С шлаковий розплав кристалізується – утворюється вюстит складу крапки 4і твердий розчин кисню в-Fe складу крапки 4.
Надалі всі
перетворення відбуваються тільки з
участю твердих фаз. При 910С-Fe перетворюється
в-Fe, вірніше, розчин
кисню в-Fe + вюстит
в твердий розчин кисню в-Fe.
При 570С вюстит
розпадається на твердий розчин кисню
в залізі і на магнетит. Повна діаграма
стану Fe – О є побудовою в трьох координатах:
температура – склад фази, яка конденсує
– рівноважний тиск кисню. Розглянемо
перетворення в системі при постійній
температурі – процес ізотермічного
окислення. Проведемо ізотермічний
розріз системи Fe – О при 1200С.
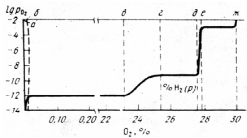
Розріз приведений на рис. 2.6. Цей розріз
показує залежність lg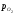 від вмісту кисню в фазах, які конденсують.
від вмісту кисню в фазах, які конденсують.
Окисленню -Fe
на діаграмі відповідає переміщення від
крапкиадоб; концентрація кисню
в твердому-Fe зростає,
росте і lg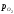 .
Від крапкибдов (див. рис. 2.6)
відбувається кількісна зміна співвідношення
двох фаз-Fe, FeO, склад
твердих фаз не змінюється.
.
Від крапкибдов (див. рис. 2.6)
відбувається кількісна зміна співвідношення
двох фаз-Fe, FeO, склад
твердих фаз не змінюється.
|
|
Рис. 2.6 – Ізотермічний розріз діаграми стану залізо-кисень при температурі 1200 0С |
Сумарний вміст
кисню в суміші зростає. Рівноважний же
тиск
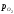 залишається незмінним – це пружність
дисоціації FeO складу крапкив. Між
крапкамивігвідбувається
зміна складу вюститу; вміст кисню в
ньому збільшується і відповідно росте
lg
залишається незмінним – це пружність
дисоціації FeO складу крапкив. Між
крапкамивігвідбувається
зміна складу вюститу; вміст кисню в
ньому збільшується і відповідно росте
lg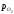 .
Між точкамигідзнову маємо
постійні склади фаз і постійну величину
lg
.
Між точкамигідзнову маємо
постійні склади фаз і постійну величину
lg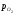 – пружність дисоціації Fe3O4.
Між крапкамидіевідбувається
зміна складу магнетиту; вміст кисню в
ньому збільшується і відповідно росте
lg
– пружність дисоціації Fe3O4.
Між крапкамидіевідбувається
зміна складу магнетиту; вміст кисню в
ньому збільшується і відповідно росте
lg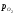 .
На ділянці між точкамие–ж знову
маємо постійні склади фаз і постійну
величину lg
.
На ділянці між точкамие–ж знову
маємо постійні склади фаз і постійну
величину lg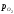 – пружність дисоціації Fe2O3.
Горизонтальні ділянки відповідають
гетерогенним областям з фазами постійного
складу, похилі ділянки відповідають
двофазним областям із змінним складом
фаз за вмістом кисню.
– пружність дисоціації Fe2O3.
Горизонтальні ділянки відповідають
гетерогенним областям з фазами постійного
складу, похилі ділянки відповідають
двофазним областям із змінним складом
фаз за вмістом кисню.