- •1 Основні поняття та цілі теорії металургійних процесів
- •2 Теоретичні основи утворення і дисоціації складних хімічних сполук
- •2.1 Термодинаміка утворення і дисоціації карбонатів
- •2.2 Термодинаміка реакцій утворення і дисоціації оксидів металів
- •2.3 Термодинаміка реакцій утворення і дисоціації оксидів заліза
- •2.4 Механізм процесів дисоціації і утворення складних хімічних з’єднань
- •2.5 Процеси окислення твердих металів
- •2.6 Будова структури окалини
- •3 Основи теорії горіння
- •3.1 Термодинаміка гомогенного горіння
- •3.2 Механізми горіння гомогенних реакцій
- •3.3 Термодинаміка реакцій горіння твердого вуглецю
- •3.4 Механізми горіння гетерогенних реакцій
- •3.5 Кінетичні закономірності горіння твердого вуглецю
- •4.1 Відновлення оксидів газами
- •4.2 Термодинаміка відновлення оксидів твердим вуглецем
- •4.3 Відновлення з участю розчинів
- •4.4 Відновлення оксидів заліза
- •4.5 Механізм відновлення оксидів металів газами
- •4.6 Механізм відновлення оксидів твердим вуглецем
- •5.Основыокислительных процессов
- •5.1. Состав, свойства и роль шлака в процессе производства стали
- •5.2.Металлический расплав
- •5.3. Важнейшие реакции сталеплавильных процессов
- •5.3.1 Окисление углерода
- •5.3.2 Окисление кремния
- •5.3.3 Поведение марганца
- •5.3.4 Поведение фосфора
- •5.3.5 Поведение серы
- •5.3.6 Газы в стали
- •5.4 Раскисление стали
- •5.4.1 Способы раскисления
- •5.4.2 Продукты раскисления и их удаление
2.5 Процеси окислення твердих металів
Якщо помістити метал в атмосферу, що містить кисень або інші окислювальні гази (СО2, Н2О і т. п.), то його поверхня покриється шаром оксидів – окалиною, товщина якої збільшується з часом. В області високих температур вказаний процес, званий високотемпературною корозією, розвивається з помітною швидкістю і приводить до втрат металу при його нагріві.
Процес окислення складається з послідовних стадій:
а) зовнішньої дифузії окислювального газу до поверхні оксиду;
б) внутрішньої дифузії в шарі окалини;
в) кристалохімічним перетворення на межах розділу фаз.
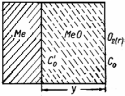
Окалина знаходиться
між двома середовищами – між металом
і газом. В її межах концентрація кисню
падає від межі розділу Газ–МеО до межі
МеО–Me, а концентрація металу зменшується
в протилежному напрямі. Це створює
передумови до дифузії речовин в шарі
оксиду. Дифузія в твердій окалині
залежить від її макробудови, визначуваної
співвідношенням мольних об'ємів оксиду
(Vок) і металу (VМе),
яке визначається за формулою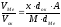 ,
деx– число атомів
металу в молекулі оксиду;М–
молекулярна маса оксиду;А– атомна
маса металу;
,
деx– число атомів
металу в молекулі оксиду;М–
молекулярна маса оксиду;А– атомна
маса металу;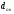 - густина оксиду,
- густина оксиду,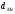 - густина металу.
- густина металу.
Якщо VМе
>Vок, тобто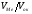 > 1, тошар оксиду, що утворюється,
пористий, і через нього окислювальний
газ порівняно легко проникає до металу.
Такими властивостями володіють, наприклад
системи:
> 1, тошар оксиду, що утворюється,
пористий, і через нього окислювальний
газ порівняно легко проникає до металу.
Такими властивостями володіють, наприклад
системи:
Метали К Na Ca Mg
Оксиди К2О Na2O CaO MgO
VМе/Vок 2,44 1,76 1,56 1,27
Навпаки, при VМе
<Vок, тобто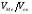 < 1, окалина покриває метал
суцільним щільним покривом, що створює
значний дифузійний опір і утрудняє
окислення. До даної другої групи
відносяться:
< 1, окалина покриває метал
суцільним щільним покривом, що створює
значний дифузійний опір і утрудняє
окислення. До даної другої групи
відносяться:
Метали Al Ni Cu Cr Fe
Оксиди А12О3 NiO Cu2O Cr2O3Fe2O3
VМе/Vок0,805 0,625 0,585 0,492 0,464
Виразимо
спостережувану швидкість процесу через
приріст товщини окалини в одиницю часу,
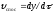 .
Швидкість внутрішньої дифузії
.
Швидкість внутрішньої дифузії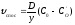 ,
деD– коефіцієнт дифузії в оксидному
шарі,СOі
,
деD– коефіцієнт дифузії в оксидному
шарі,СOі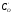 – концентрації кисню в газі і на межі
розділу MeО–Ме. (рис.7). Швидкість реакції
– концентрації кисню в газі і на межі
розділу MeО–Ме. (рис.7). Швидкість реакції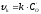 ,
де
,
де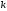 – константа швидкості.
– константа швидкості.
|
|
|
Рис. 2.9 - Схема до розрахунку товщини шару окалини |
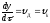 або
або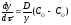 та
та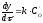 .
.
Виключивши з цих
рівнянь непіддатливу безпосередньому
визначенню проміжну концентрацію
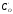 ,
одержимо
,
одержимо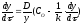 .
.
Розділивши змінні,
знайдемо
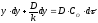 .
.
У початковий момент
процесу (= 0) окалини
ще немає,у= 0. Інтеграція від цих
граничних умов дає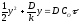 .
.
Для металів першої
групи з пористою будовою окалини D>>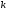 .
При не дуже великій її товщині (y)
можна нехтувати першим доданком порівняно
з другим в цьому рівнянні, яке перетворюється
в
.
При не дуже великій її товщині (y)
можна нехтувати першим доданком порівняно
з другим в цьому рівнянні, яке перетворюється
в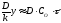 або
або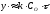 .
.
Звідки слідує:
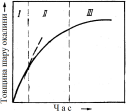
а) товщина шару окалини прямо пропорційна часу , тобто окислення йде з постійною швидкістю;
б) швидкість окислення визначається особливостями кристалохімічної ланки, тобто реакція знаходиться в кінетичній області.
Для металів другої
групи, що мають суцільний шар окалини,
коефіцієнт дифузії Dнабагато менше,
ніж у попередньому випадку, і він звична
менше константи швидкості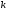 .
На початку процесу, коли товщина оксидної
плівки ще мала,y2 >>у, тут також можна нехтувати першим
доданком і одержати те ж рівняння і ті
ж висновки з нього.
.
На початку процесу, коли товщина оксидної
плівки ще мала,y2 >>у, тут також можна нехтувати першим
доданком і одержати те ж рівняння і ті
ж висновки з нього.
|
|
|
Рис. 2.10 -Залежність товщини шару окалини від часу окислення |
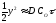 або
або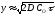 ,
звідки:
,
звідки:
а) товщина шару
окалини пропорційна
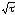 ,
тобто швидкість окислення з часом
зменшується;
,
тобто швидкість окислення з часом
зменшується;
б) процес знаходиться в дифузійній області.
Отже, у металів з щільною окалиною реакція окислення спочатку знаходиться в кінетичній області і шар оксиду наростає приблизно по лінійній залежності (рис. 2.10). При значній товщині шару залежність стає параболічною і процес лімітується внутрішньою дифузією. Між цими крайніми випадками лежить перехідна область, що враховує як особливості кристалохімічної ланки, так і дифузії.