
- •Рекомендовано предметною цмк з фармациї Одеського державного медичного університету (протокол № 2 від 10.11.2005 р. )
- •Зразок титульного листа реферату
- •Реферат
- •Структура реферату
- •Зразок титульного листа контрольної роботи
- •Загальні вимоги до оформлення контрольних робіт
- •План - графік навчального процесу 2-й курс, ііі семестр 2005/2006 навчальний рік
- •Розклад
- •Біофізика
- •Тематичний план з дисципліни
- •Механіка. Акустика Поступальний рух.
- •Обертальний рух. Біомеханіка
- •Механічні коливання
- •Механічні хвилі
- •Інфразвук та ультразвук
- •Механічні властивості та течія рідин
- •Механічні властивості біотканин
- •2 Молекулярна фізика. Термодинаміка Молекулярна фізика
- •Начала термодинаміки
- •Явища переносу.
- •3. Електростатика. Електродинаміка. Магнетизм Електростатика
- •Електричний струм
- •4. Оптика Інтерференція та дифракція світла
- •Геометрична оптика
- •Теплове випромінювання
- •5. Фізика атомів та молекул. Квантова біофізика
- •6. Іонізуюче випромінюваня. Елементи дозиметрії
- •Назва теми реферату
- •Екзаменаційні питання
- •Рекомендована література
- •Релігієзнавство
- •Тематичний план лекцій
- •Теми рефератів
- •Філософія
- •1.1. Цілі щодо викладення дисципліни.
- •Тема 1. Світогляд людини та філософія.
- •Тема 2. Філософія країн Сходу.
- •Тема 3. Філософія країн Заходу.
- •Тема 4. Вітчизняна філософія. Філософська думка України.
- •Тема 5. Буття, матерія, свідомість.
- •Тема 6. Людина та її діяльність.
- •Тема 7. Уроки людського пізнання. Діалектика чи її альтернативи?
- •Тема 8. Діалектика та методологія пізнання.
- •Тема 9. Філософське розуміння історії. Особа та суспільство. Загальнолюдські цінності суспільного життя.
- •Тема 10. Функціонування та розвиток суспільства. Діалектика матеріального та духовного виробництва.
- •Тема 11. Політична сфера суспільства. Місце держави в суспільстві. Громадінське суспільство та правова держава.
- •Тема 12. Суспільна свідомість. Цивілізація та культура на перетині хх - хх1 століть.
- •Економічна теорія.
- •Плани семінарських занять.
- •Питання для самоконтролю.
- •Тема 2. Суспільне виробництво: мета, фактори, результат. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 3. Теоретичні основи власності. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 4. Товарна організація виробництва.
- •Теми рефератів.
- •Питання для самоконтролю.
- •Тема 5. Ринкові попит та пропозиція. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 6. Основна ланка ринкової економіки. Теми рефератів.
- •Питання для самоконтролю.
- •Тема7. Суспільне відтворення та економічний ріст. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 8. Особливості державного регулювання в умовах ринкової економіки. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 9. Інфраструктура ринкової економіки. Теми рефератів.
- •Питання для самоконтролю.
- •Тема10. Грошовий обіг.Інфляція та її наслідки. Теми рефератів.
- •Питання для самоконтролю.
- •Тема11. Основні риси і тенденція розвитку всесвітнього господарства. Теми рефератів.
- •Питання для самоконтролю.
- •Перелік питань, що виносяться на залік.
- •Список літератури.
- •Аналітична хімія Загальні рекомендації
- •Оформлення контрольної роботи
- •Програма з аналітичної хімії
- •I. Вступ
- •II. Теоретичні основи аналітичної хімії Основні поняття
- •Аналітичні властивості речовин
- •Теорія розчинів та закон діючих мас в аналітичній хімії
- •Протолітична рівновага. Використання кислотно-основних реакцій в аналітичній хімії
- •Рівновага реакцій комплексоутворення. Комплексні сполуки та органічні реагенти в аналітичній хімії
- •Рівновага оксидаційно-відновних реакцій. Використання оксидаційно-відновних реакцій в аналізі
- •Гетерогенна рівновага. Використання в аналітичній хімії гетерогенних процесів
- •Математична оцінка правильності та відтворюваності результатіваналізу
- •Підготовка до проведення аналізу
- •III. Якісний аналіз
- •Якісний аналіз катіонів та аніонів
- •IV. Кількісний аналіз
- •Оформлення результатів аналізу. Титриметричний (об'ємний) аналіз.
- •Методи кислотно-основного титрування (нейтралізації)
- •Методи окисно-відновного титрування (окислення-відновлення)
- •Методи осадового титрування (осадження)
- •Методи комплексометричного титрування
- •Гравіметричні (вагові) методи аналізу
- •V. Інструментальні методи кількісного аналізу
- •Оптичні методи аналізу
- •Хроматографічні методи кількісного аналізу
- •Електрохімічні методи аналізу
- •Перелік питань, які виносяться на іспит
- •Список рекомендованої літератури
- •Розділ 1 Хімічні методи аналізу. Чутливість та специфічність аналітичних реакцій
- •Завдання для самостійного розв'язування
- •Способи вираження складу розчинів
- •Завдання для самостійного розв'язування
- •Теорії розчинів електролітів в аналітичній хімії Розділ 3 Хімічна рівновага в протолітичних реакціях
- •Завдання для самостійного розв'язування
- •Розділ 4 Хімічна рівновага в окислювально-відновних реакціях
- •Завдання для самостійного розв'язування
- •Розділ 5 Хімічна рівновага в системах осад-розчин
- •Завдання для самостійного розв'язування
- •Розділ 6 Хімічна рівновага в реакціях комплексоутворення
- •Завдання для самостійного розв'язування
- •Розділ 7 Якісний аналіз катіонів
- •Завдання для самостійного розв'язування
- •Розділ 8 Якісний аналіз аніонів
- •Завдання для самостійного розв'язування
- •Розділ 9 Якісний аналіз сухої суміші
- •Завдання для самостійного розв'язування
- •Органічна хімія Общие положения
- •Цели и задания дисциплины
- •2. Задачи относительно изучения дисциплины
- •Программа по органической химии
- •Методические указания по оформлению контрольных работ
- •Пример решения типовых заданий
- •Контрольные задания
- •Контрольная работа №1
- •Англійська мова Контрольна робота № 3
- •Вариант 3.
- •Вариант 4.
- •Французька мова Контрольна робота № 3
- •Основна література:
- •Додаткова література
- •Німецька мова Контрольна робота № 3
- •Вариант 2
- •Вариант 5
Розділ 5 Хімічна рівновага в системах осад-розчин
Приклади розв 'язку задач
Приклад 1. Добуток розчинностi AgSCN дорiвнює 1,1610-12 (25 °С). Обчислити розчинність роданiду срiбла в г/дм3.
Розв'язок.Якщо
AgSCN Ag+ + SCN,
то
[Ag+] = [SCN]=х
Звiдки
ДPAgscN = [Ag+] [SCN] = х2= 1,1610-12
х=[Ag+]
= ![]() =
1,0810-6
моль/ дм3.
=
1,0810-6
моль/ дм3.
Розчиннiсть роданiду срiбла вiдповiдає рiвноважнiй концентрацiї iонiв срiбла:
[Ag+] ==PAgSСN = 1,0810-6 моль/ дм3.
PAgSСN = l,0810-6165,95 == l,78.10-4 г/ дм3,
де 165,96 г/моль - молярна маса AgSCN.
Приклад 2. Обчислити розчиннiсть AgBrO3 в г/дм3 при 25 ОС за його добутком розчинностi,враховуючикоефiцієнтиактивностi (ДР(AgBrОз)=5,7710-5).
Розв'язок.Обчислюють спочатку розчиннiсть AgBrOз без врахування коефiцiєнтiв активностi:
PAgBrOз = [Ag+] = [BrO3 ]-= [Ag+]2(моль/ дм3).
![]()
Для точного обчислення потрiбно знайти iонну силу розчину цiєї солi
![]()
Коефiцiєнт активностi для
даної iонної сили![]() ;(таблична величина).
Тодi
;(таблична величина).
Тодi
![]()
Молярна маса AgBrO3 дорiвнює 235,77 г/моль, отже, розчинність
PAgBrOз = =8,310-3235,77=1,96 (г/ дм3).
Якщо ж прийняти коефiцiєнт активностi рiвним одиниці, то розчиннiсть осаду дорiвнюватиме 1,79 г/ дм3. Рiзницяв 0,17 г/ дм3 має практичнезначення.
Приклад 3. Порівняти розчиннiсть BaS04 в 0,01 м розчинiNa2SO4 з розчиннісю у чистій воді(ДР(BaSO4)= 1,110-10).
Розв'язок. Позначають розчиннiсть сульфату барiю через х.Ціх молей BaSO4 дадуть по х молей Ва2+ i SO42-. Однакiони SО42- утворюються також в результатi дисоцiаціїNa2SО4.Враховуючи, що кожний моль Na2SO4 дає одинмоль SO42-, записують:
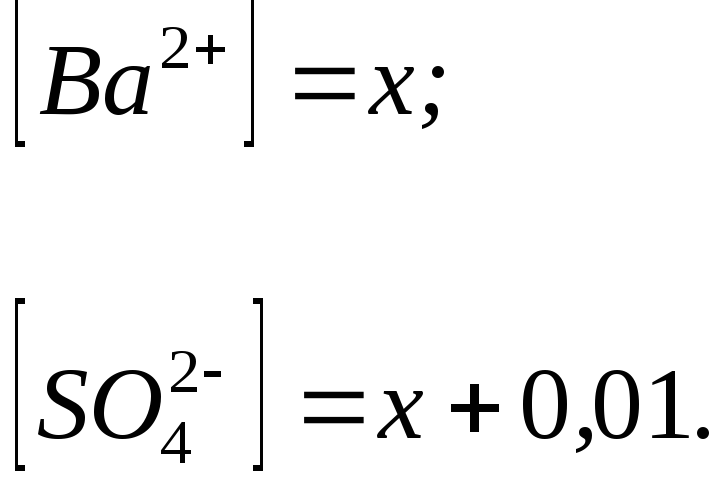
Тодi
![]()
Оскiльки розчиннiсть ВаS04 дуже мала, то величиноюхв порiвняннi з 0,01 можна знехтувати, отже
![]()
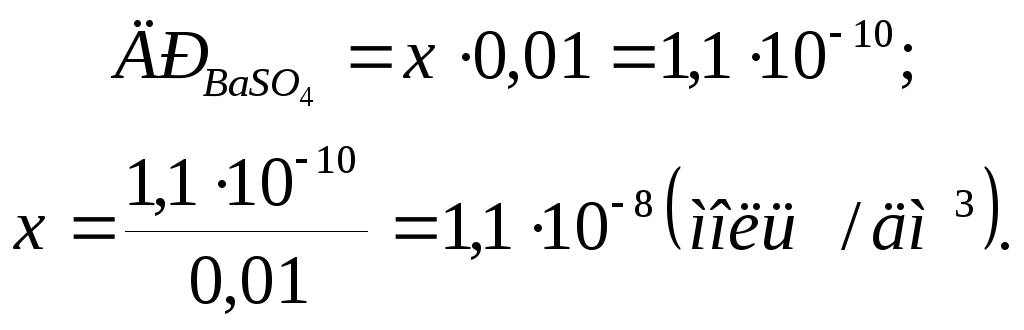
В чистiй водi
![]() ,
,
тобто
в присутностi 0,01M Na2SO4розчиннiсть зменшилась в![]() рази.Висновок:В присутностi
одноiменних iонiв розчиннiсть осаду
зменшується.
рази.Висновок:В присутностi
одноiменних iонiв розчиннiсть осаду
зменшується.
Приклад 4. Чи випаде осадпри змiшуваннi 5 см3 0,02 н. розчинуВаСl2 з 5см30,1н. розчину Na2CO3 (ДP(BaСОз)= 5,110-9).
Розв'язок.Оскiльки концентрацiя вихiдних розчинiв вираженачерез нормальнiсть, потрiбно обчислити молярнiсть розчинів.
0,02 н розчин ВаСl2 вiдповiдає 0,01М, а 0,1 н розчин Na2CO3 відповiдає0,05 М.
Пiсля змiшування розчинiв
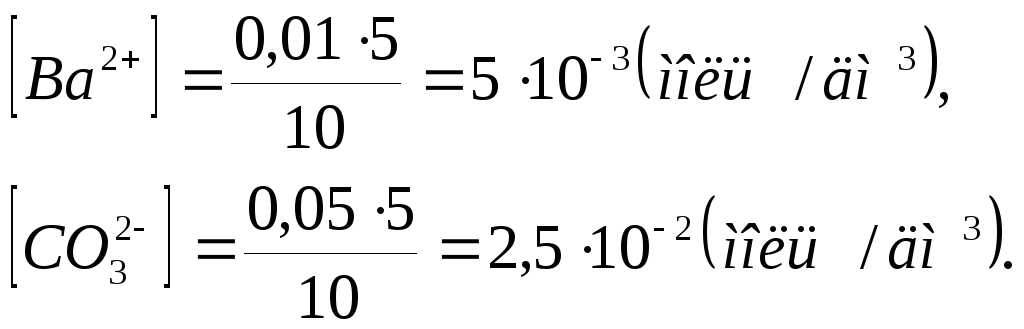
Добуток концентрацiй цих iонiв
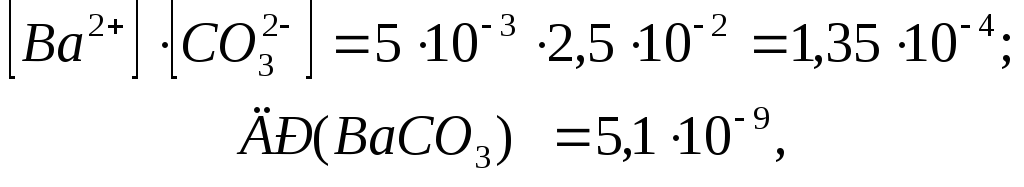
Приклад 5 При якому спiввiдношеннi концентрацій іонiв Рb2+ i Ва2+ будуть одночасно випадати осади РbСrO4 таBaCrO4 при дiї хромату калiю (ДР(РbСrO4) = 1,810-14,ДР(BaCrO4) =1,210-10) ?
Розв'язок.
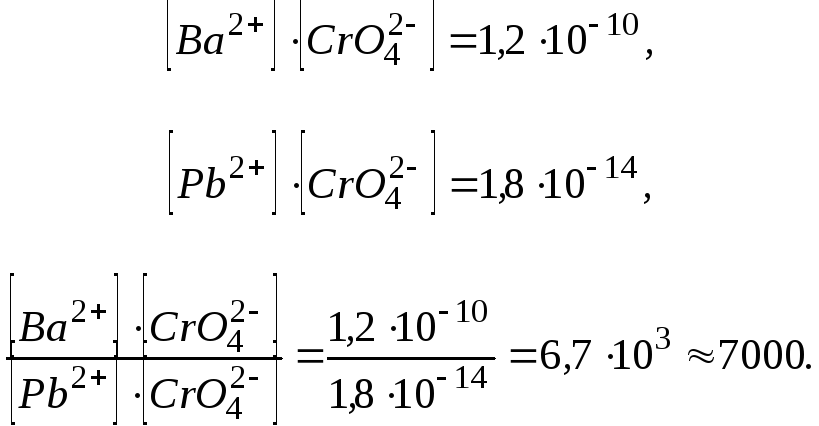
Отже, хромати барiю i свинцю будуть одночасно випадати зрозчину тодi, коли концентрацiя iонiв барiю буде в 7000разівбiльшою вiд концентрації iонiв свинцю. Якщо вiдношення[Ва2+ ]Рb2+ ] буде бiльшим вiд знайденоївеличини, то, спочатку випадатиме осад хромату барiю до тих пiр,поки вказане співвiдношення стане рiвним 7000, пiсля чого почне випадатиосад хромату свинцю. Якщо ж вiдношення [Ва2+ ]Рb2+ ] буде меншим вiд 7000, то першим почне осаджуватися хромат свинцю.
На основi правила добутку розчинностi можна також вирiшувати питання про можливiсть перетворення одного осаду в інший i про необхiдну для цього концентрацiю реактиву.
