
- •Рекомендовано предметною цмк з фармациї Одеського державного медичного університету (протокол № 2 від 10.11.2005 р. )
- •Зразок титульного листа реферату
- •Реферат
- •Структура реферату
- •Зразок титульного листа контрольної роботи
- •Загальні вимоги до оформлення контрольних робіт
- •План - графік навчального процесу 2-й курс, ііі семестр 2005/2006 навчальний рік
- •Розклад
- •Біофізика
- •Тематичний план з дисципліни
- •Механіка. Акустика Поступальний рух.
- •Обертальний рух. Біомеханіка
- •Механічні коливання
- •Механічні хвилі
- •Інфразвук та ультразвук
- •Механічні властивості та течія рідин
- •Механічні властивості біотканин
- •2 Молекулярна фізика. Термодинаміка Молекулярна фізика
- •Начала термодинаміки
- •Явища переносу.
- •3. Електростатика. Електродинаміка. Магнетизм Електростатика
- •Електричний струм
- •4. Оптика Інтерференція та дифракція світла
- •Геометрична оптика
- •Теплове випромінювання
- •5. Фізика атомів та молекул. Квантова біофізика
- •6. Іонізуюче випромінюваня. Елементи дозиметрії
- •Назва теми реферату
- •Екзаменаційні питання
- •Рекомендована література
- •Релігієзнавство
- •Тематичний план лекцій
- •Теми рефератів
- •Філософія
- •1.1. Цілі щодо викладення дисципліни.
- •Тема 1. Світогляд людини та філософія.
- •Тема 2. Філософія країн Сходу.
- •Тема 3. Філософія країн Заходу.
- •Тема 4. Вітчизняна філософія. Філософська думка України.
- •Тема 5. Буття, матерія, свідомість.
- •Тема 6. Людина та її діяльність.
- •Тема 7. Уроки людського пізнання. Діалектика чи її альтернативи?
- •Тема 8. Діалектика та методологія пізнання.
- •Тема 9. Філософське розуміння історії. Особа та суспільство. Загальнолюдські цінності суспільного життя.
- •Тема 10. Функціонування та розвиток суспільства. Діалектика матеріального та духовного виробництва.
- •Тема 11. Політична сфера суспільства. Місце держави в суспільстві. Громадінське суспільство та правова держава.
- •Тема 12. Суспільна свідомість. Цивілізація та культура на перетині хх - хх1 століть.
- •Економічна теорія.
- •Плани семінарських занять.
- •Питання для самоконтролю.
- •Тема 2. Суспільне виробництво: мета, фактори, результат. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 3. Теоретичні основи власності. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 4. Товарна організація виробництва.
- •Теми рефератів.
- •Питання для самоконтролю.
- •Тема 5. Ринкові попит та пропозиція. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 6. Основна ланка ринкової економіки. Теми рефератів.
- •Питання для самоконтролю.
- •Тема7. Суспільне відтворення та економічний ріст. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 8. Особливості державного регулювання в умовах ринкової економіки. Теми рефератів.
- •Питання для самоконтролю.
- •Тема 9. Інфраструктура ринкової економіки. Теми рефератів.
- •Питання для самоконтролю.
- •Тема10. Грошовий обіг.Інфляція та її наслідки. Теми рефератів.
- •Питання для самоконтролю.
- •Тема11. Основні риси і тенденція розвитку всесвітнього господарства. Теми рефератів.
- •Питання для самоконтролю.
- •Перелік питань, що виносяться на залік.
- •Список літератури.
- •Аналітична хімія Загальні рекомендації
- •Оформлення контрольної роботи
- •Програма з аналітичної хімії
- •I. Вступ
- •II. Теоретичні основи аналітичної хімії Основні поняття
- •Аналітичні властивості речовин
- •Теорія розчинів та закон діючих мас в аналітичній хімії
- •Протолітична рівновага. Використання кислотно-основних реакцій в аналітичній хімії
- •Рівновага реакцій комплексоутворення. Комплексні сполуки та органічні реагенти в аналітичній хімії
- •Рівновага оксидаційно-відновних реакцій. Використання оксидаційно-відновних реакцій в аналізі
- •Гетерогенна рівновага. Використання в аналітичній хімії гетерогенних процесів
- •Математична оцінка правильності та відтворюваності результатіваналізу
- •Підготовка до проведення аналізу
- •III. Якісний аналіз
- •Якісний аналіз катіонів та аніонів
- •IV. Кількісний аналіз
- •Оформлення результатів аналізу. Титриметричний (об'ємний) аналіз.
- •Методи кислотно-основного титрування (нейтралізації)
- •Методи окисно-відновного титрування (окислення-відновлення)
- •Методи осадового титрування (осадження)
- •Методи комплексометричного титрування
- •Гравіметричні (вагові) методи аналізу
- •V. Інструментальні методи кількісного аналізу
- •Оптичні методи аналізу
- •Хроматографічні методи кількісного аналізу
- •Електрохімічні методи аналізу
- •Перелік питань, які виносяться на іспит
- •Список рекомендованої літератури
- •Розділ 1 Хімічні методи аналізу. Чутливість та специфічність аналітичних реакцій
- •Завдання для самостійного розв'язування
- •Способи вираження складу розчинів
- •Завдання для самостійного розв'язування
- •Теорії розчинів електролітів в аналітичній хімії Розділ 3 Хімічна рівновага в протолітичних реакціях
- •Завдання для самостійного розв'язування
- •Розділ 4 Хімічна рівновага в окислювально-відновних реакціях
- •Завдання для самостійного розв'язування
- •Розділ 5 Хімічна рівновага в системах осад-розчин
- •Завдання для самостійного розв'язування
- •Розділ 6 Хімічна рівновага в реакціях комплексоутворення
- •Завдання для самостійного розв'язування
- •Розділ 7 Якісний аналіз катіонів
- •Завдання для самостійного розв'язування
- •Розділ 8 Якісний аналіз аніонів
- •Завдання для самостійного розв'язування
- •Розділ 9 Якісний аналіз сухої суміші
- •Завдання для самостійного розв'язування
- •Органічна хімія Общие положения
- •Цели и задания дисциплины
- •2. Задачи относительно изучения дисциплины
- •Программа по органической химии
- •Методические указания по оформлению контрольных работ
- •Пример решения типовых заданий
- •Контрольные задания
- •Контрольная работа №1
- •Англійська мова Контрольна робота № 3
- •Вариант 3.
- •Вариант 4.
- •Французька мова Контрольна робота № 3
- •Основна література:
- •Додаткова література
- •Німецька мова Контрольна робота № 3
- •Вариант 2
- •Вариант 5
Теорії розчинів електролітів в аналітичній хімії Розділ 3 Хімічна рівновага в протолітичних реакціях
Приклади розв 'язку задач
Приклад 1. Знайти активності іонів Na+ та Cl- у 0,01 М розчині NaCl.
Розв'язок. Іонна сила розчину
![]()
![]()
Коефіцієнти активності
![]()
Отже, активність іонів
![]()
Приклад
2.
Визначити
![]() та
та
![]() для
0,01 М
розчину HCl. (
для
0,01 М
розчину HCl. (![]() концентраційне;
концентраційне;
![]() термодинамічне)
термодинамічне)
Розв'язок.
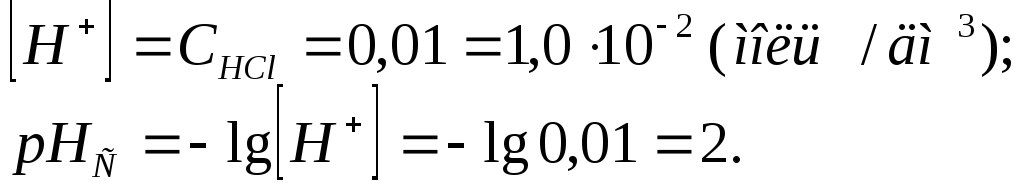
Для визначення активності водневих іонів обчислимо спочатку іонну силу розчину
![]()
Беручи коефіцієнт активності fН+ = 0,89 знаходимо активність водневих іонів
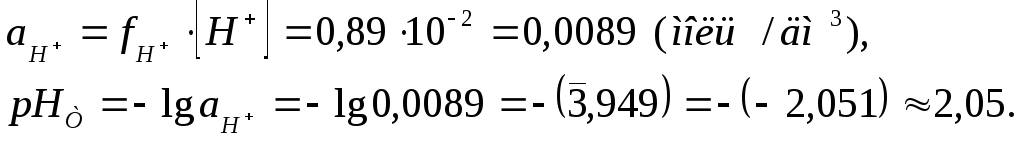
При такій значній концентрації
соляної кислоти (0,01 М)
відносна помилка у
розрахунку
![]() та
та
![]() складає
складає
![]()
Із збільшенням концентрації
іонна сила розчину зростає, у зв’язку
з чим збільшується різниця між
![]() та
та
![]() .
Навпаки, іззменшенням
концентрації іонна сила розчину
зменшується і коефіцієнт активності
поступово наближається
до одиниці, тобто f 1.
.
Навпаки, іззменшенням
концентрації іонна сила розчину
зменшується і коефіцієнт активності
поступово наближається
до одиниці, тобто f 1.
В цих умовах
![]()
Приклад
3.
Визначити
![]() та
рН
0,0005 М розчину
КОН (t
=25 oC).
та
рН
0,0005 М розчину
КОН (t
=25 oC).
Розв'язок.
![]()
Обчислимо іонну силу розчину:
![]()
![]()
Коефіцієнт активності при
![]() будеfН+
= 0,97, тоді
будеfН+
= 0,97, тоді
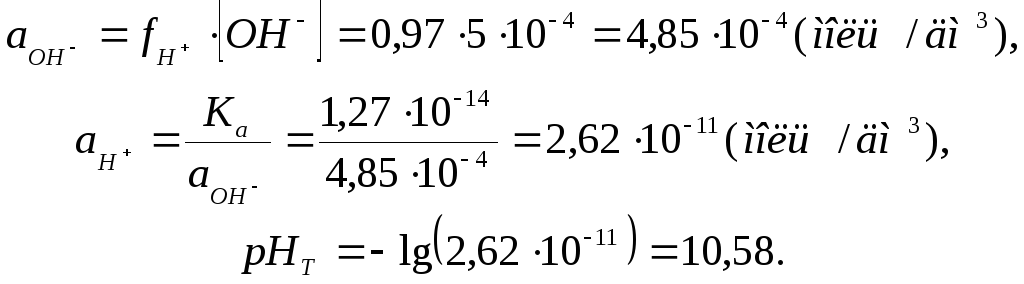
Приклад 4. Визначити рН у 0,15 М розчині CH3COOH .
Розв'язок.
0,15 >> 1.7510-5,
тобто
![]() ,
значить
,
значить
![]() ,
,
звідки
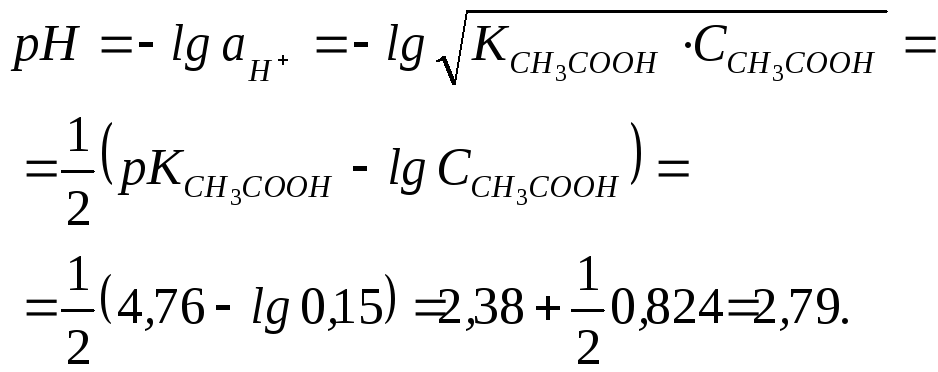
Раніше було показано, що для слабких електролітів, коли CНА значно більше, ніж КНА, можна без втрати точності прийняти, що
![]()
При розв’занні прикладу вважали, що
![]()
![]()
Рівноважна концентрація оцтової(ацетатної) кислоти прирівнювалась до активності, тому що константа надавалась термодинамічна. Якщо при обчисленні рН в 0,15 М розчині оцтової кислоти провести за більш точною формулою, з урахуванням рівноважної концентрації [CH3COOH], то розбіжність з величиною рН, що була обчислена раніше за спрощенною формулою, виявляється незначною:
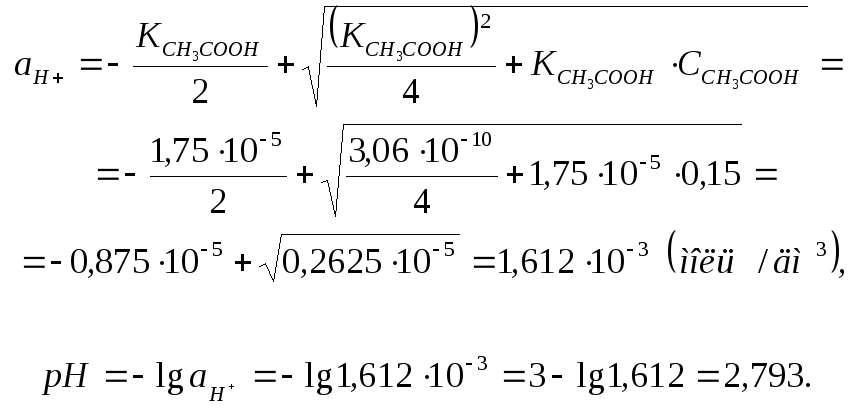
При обчисленні за спрощенною формулою було знайдено, що рН=2,79. Значить, такі спрощення у розрахунках допустимі.
Приклад 5. До 9 см3 0,5 М розчину оцтової кислоти додано 1 см3 2Мрозчину ацетату натрію.Визначити рН отриманого розчину.
Розв'язок. Концентрація оцтової кислоти у розчині
![]()
Концентрація ацетату натрію:
![]()
Іонна сила розчину
![]() ,
а коефіцієнт активності
,
а коефіцієнт активності
![]() .
.
Тоді активність Н+-іонів
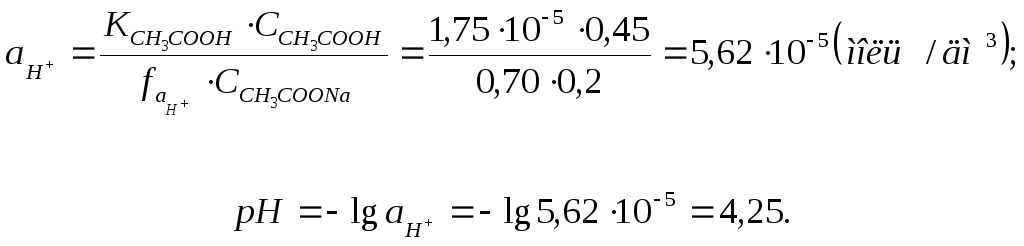
Приклад 6. Визначення іонного складу розчину вугільної (карбонатної)кислоти
Розв'язок. Для дисоціації вугільної кислоти за першим ступенем
![]()
константа дисоціації
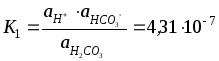 ,
,
а для дисоціації за другим ступенем
![]()
![]()
константа дисоціації
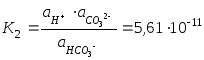 ,
,
Оскільки у даному випадку K2 << K1, то
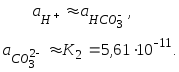
У насиченому розчині при t = 25 oC
![]()
тому
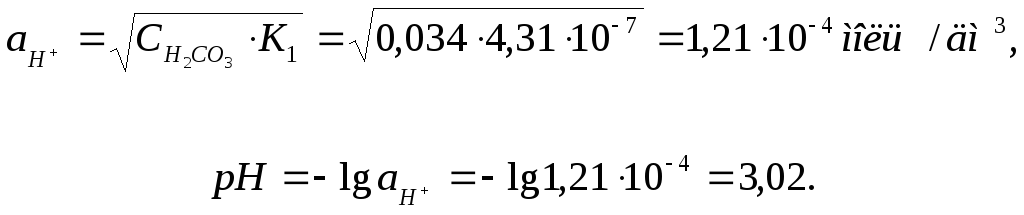
Тепер розглянемо, як буде змінюватись активність іонів СО32- у водних розчинах вугільної кислоти при зміні активності водневих іонів.
Перемножаючи значення констант дисоціації К1 та К2 отримаємо
![]()
![]()
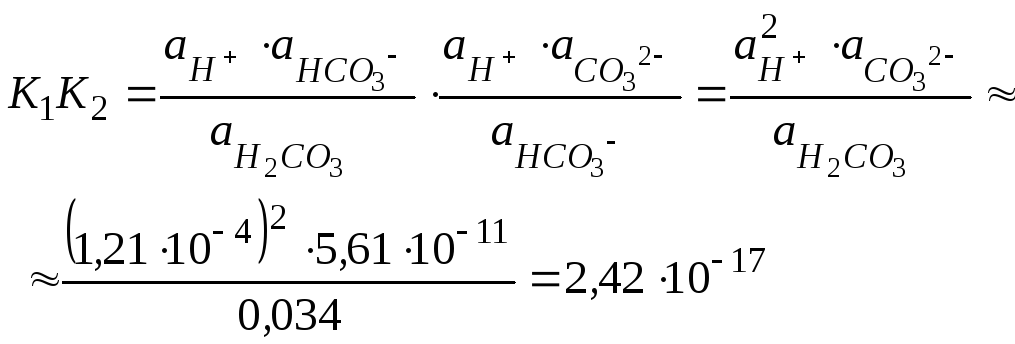
Приймаючи
до уваги, що![]() ,будемо мати:
,будемо мати:
![]()
Це співвідношення дає можливість обчислювати активності іонів СО32- в залежності від активності іонів Н+ :
![]()
У загальному вигляді формула
для обчислення
![]() у розчині двуосновної
слабкої кислоти буде
у розчині двуосновної
слабкої кислоти буде
![]()
Приклад 6.Обчислити рН буферної сумішіCH3COOH+CH3COONa, яка містить по 0,1молькожної речовини.
Показати, як зміниться рН при додаванні до 1 дм3 суміші:
а) 0,01 моль HCl;
б) 0,01 моль NaOH;
в) при розведені суміші водою у 100 разів.
Розв'язок. Оскільки для оцтової кислоти рК = 4,76 , маємо:
![]()
Якщо до 1 лцієї суміші додати 0,01моль HCl, то 0,01моль CH3COONaперетворюється у рівне число молейCH3COOH.
Отже
![]()
Подібним чином при додаванні до 1 дм3суміші 0,01моль NaOH рівну кількість молейCH3COOH буде перетворено уCH3COONa:
![]()
При розведені розчину у 100 разів:
![]()
Таким чином, обчислення підтверджують здатність буферних сумішей підтримувати практично постійний рН при додаванні до них невеликих кількостей кислот або лугів, а також при розведені самого розчину.
