
- •Глава 1. Основні поняття та закони хімії
- •1.1. Основні поняття хімії
- •1.2. Фундаментальні та стехіометричні закони хімії
- •1.2.1. Закон збереження маси речовини
- •1.2.2. Закон сталості складу речовин
- •1.2.3. Закон кратних відношень
- •1.2.4. Закон еквівалентів.
- •1.3. Закони газового стану
- •1.3.1. Закон об’ємних відношень гей-люсака
- •1.3.2. Закон авогадро
- •1.3.3. Закон бойля – маріотта
- •Контрольні завдання
- •Б) Із закону Авогадро випливає, що об’єм 0,025 моль h2s за нормальних умов
- •В) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
- •Приклад 3. Який об’єм за нормальних умов займуть 4 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 104 Па?
- •Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
- •Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Відповідно до закону еквівалентів (1.1), маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
- •Зі співвідношення (1.8) знаходимо еквівалентну масу h3ро4:
- •Приклад 8. Обчислити точну атомну масу металу, якщо питома теплоємність металу дорівнює 0,23 кДж/(кг к), а хлорид цього металу містить 61,2% металу.
- •Приклад 10. Визначити формулу речовини, якщо відомо, що її густина за воднем дорівнює 29, а масові частки елементів наступні: с – 82,76%, н – 17,24%.
- •Глава 2. Класи неорганічних сполук
- •2.1. Оксиди.
- •2.1.1. Способи одержання оксидів
- •2.1.2. Класифікація та хімічні властивості оксидів
- •2.2. Гідроксиди металів
- •2.2.1. Способи одержання гідроксидів
- •2.2.2. Хімічні властивості гідроксидів металів
- •2.3. Кислоти
- •2.3.1. Способи одержання кислот
- •2.3.2. Хімічні властивості кислот
- •2.4.1.Основні способи одержання солей
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •3.2. Корпускулярно-хвильова природа електрона
- •3.3. Принцип невизначеності
- •3.4. Періодичний закон
- •3.5. Періодична система елементів
- •3.6. Електронні хмари
- •3.7. Квантові числа
- •3.8. Принцип паулі
- •3.9. Послідовність заповнення електронами енерґетичних рівнів у багатоелектронних атомах
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •Приклад 8. Які найвищий та найнижчий ступені окислення у фосфору, сульфуру та хлору? Скласти формули сполук даних елементів, що відповідають цим ступеням окислення.
- •Приклад 12. Як залежать кислотно-основні властивості оксидів і гідроксидів від ступеня окиснення атомів елементів, що їх утворюють?
- •Приклад 13. Відомо, що кремній є неметалом з напівпровідниковими властивостями. Які властивості будуть виявляти алюміній і фосфор?
- •Приклад 15. Як змінюються властивості вищих оксидів елементів третього періоду?
- •4.1.1. Характерні властивості ковалентного зв’язку
- •4.1.1.1. Насиченість ковалентного зв’язку
- •Мал. 4.3. Різновиди σ-зв’язків.
- •Мал. 4.3. Різновиди π-зв’язків.
- •4.1.1.3. Полярність і поляризованість ковалентного зв’язку.
- •4.3. Водневий зв’язок
- •4.5. Міжчастинкові взаємодії
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач Приклад 1. Довжина диполя молекули дорівнює 2,2 10-11 м. Обчисліть дипольний момент молекули.
- •Приклад 2. Обчислити довжину зв’язку в молекулі hBr, якщо між’я-дерні відстані у молекулах h2 та Br2 відповідно дорівнюють 7,4 · 10-11 м та 2,28 10-10 м.
- •Приклад 3. Яка гібридизація електронних хмар має місце в атомі карбону при утворенні молекули cf4? Якою є просторова конфігурація цієї молекули?
- •Приклад 4. Якими є валентні можливості атома фосфору в основному та збудженому станах?
- •Приклад 5. Визначте, що є донором електронної пари при утворенні йона bh4-.
- •Глава 5. Основи хімічної термодинаміки
- •5.2. Перший закон термодинаміки
- •5.3. Закони термохімії
- •5.4. Поняття про ентропію
- •5.5. Другий закон термодинаміки
- •5.6.Третій закон термодинаміки
- •5.7. Вільна енергія Ґіббса
- •Приклад 1. Складіть термохімічне рівняння реакції горіння 1 моль ацетилену, якщо при цьому виділяється 1255,61 кДж теплоти.
- •Приклад 3. Не здійснюючи обчислень, поясніть, як змінюється ентропія системи (s): а) при переході води в пару; б) у реакції:
- •Приклад 4. Обчисліть зміну енерґії Ґіббса у хімічній реакції
- •І зробіть висновки про можливість мимовільного перебігу даної реакції за стандартних умов.
- •Стандартні зміни енерґій Ґіббса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •6.1. Поняття про швидкість хімічної реакції
- •6.2. Основний закон хімічної кінетики – закон діючих мас.
- •Межі застосування закону діючих мас.
- •6.3. Молекулярність реакції.
- •6.4. Порядок реакції.
- •6.5. Особливості кінетики гетероґенних реакцій.
- •6.6. Механізм хімічних реакцій.
- •6.7. Вплив температури на швидкість реакції. Правило Вант-Гоффа.
- •6.8. Рівняння Арреніуса. Енерґія активації
- •Вихідні Активов. Продукти
- •Мал.6.3. Енерґетична діаграма Мал.6.4. Розподіл молекул за
- •Глава 7. Хімічна рівновага.
- •7.1. Константа хімічної рівноваги
- •7.2. Зсув хімічної рівноваги. Принцип Ле-Шательє
- •7.3. Рівновага у гетероґенних системах
- •Константа рівноваги.
- •Глава 8. Поняття про каталіз.
- •8.1. Автокаталіз
- •8.2.Промотори та каталітичні отрути
- •8.3. Селективність каталізаторів
- •8.4. Механізми гомоґенного та гетероґенного каталізу
- •Підставляючи дані нашої задачі, одержуємо:
- •Глава 9. Розчини
- •9.1. Процес розчинення. Типи розчинів
- •9.2. Способи виразу концентрації речовин
- •9.3. Хімічна (гідратна) теорія розчинів д.І. Менделєєва
- •9.4. Теплові ефекти розчинення
- •9.5. Розчинність
- •Глава 10. Властивості розчинів
- •10.1. Тиск пари розчинника над розчином
- •10.2. Температури замерзання та кипіння розчинів
- •10.3. Осмотичний тиск
- •Глава 11. Електролітична дисоціація.
- •11.1. Основні положення теорії електролітичної дисоціації
- •11.2. Ступінь дисоціації
- •11.3. Слабкі електроліти. Константа дисоціації слабких електролітів
- •11.4. Вплив однойменних іонів на дисоціацію слабких електролітів
- •11.5. Розчини сильних електролітів
- •11.6. Електролітична дисоціація води. Йонний добуток води. Водневий показник
- •11.7. Поняття про індикатори
- •11.8. Іонні реакції
- •11.8. Гідроліз солей
- •Типові випадки гідролізу.
- •11.8.1. Ступінь і константа гідролізу
- •Глава 12. Комплексні сполуки
- •12.1. Основні положення координаційної теорії а.Вернера
- •12.2. Класифікація комплексних сполук
- •12.3. Номенклатура комплексних сполук
- •12.3.1. Назви катіонних комплексних сполук
- •12.3.2. Назви аніонних комплексних сполук
- •12.3.3. Назви нейтральних комплексних сполук
- •12.4. Ізомерія комплексних сполук
- •12.5. Дисоціація комплексних сполук
- •Якщо у гібридизації беруть участь d-орбіталі передостаннього рівня, тоді йон називається внутрішньоорбітальним. Іноді у комплексах проявляється йонно-дипольний зв’язок, наприклад в аквакомплексах.
- •Глава 13. Електрохімічні процеси
- •13.1. Хімічні процеси на електродах
- •13.2. Електродний потенціал
- •13.3. Електрохімічний ряд напруг металів
- •13.4. Гальванічний елемент
- •13.5. Окисні й відновні потенціали
- •13.6. Рівняння Нернста
- •13.7. Акумулятори
- •13.8. Паливні елементи
- •13.9. Електроліз
- •13.9.1. Закони Фарадея
- •1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •13.10. Корозія металів
- •0,01 Моль/л 0,1 моль/л
- •Глава 14. Окисно-відновні реакції складання рівнянь окисно-відновних реакцій
- •Контрольні завдання
- •Додатки
- •Додаток 6 – Перехідні коефіцієнти
- •Предметний покажчик
- •Відновлення 18-19, 77, 81, 124, 126, 128, 135-139
- •Водень 14, 17, 37, 75, 125, 130-132, 139
- •Ізомерія 119
- •Лантаноїди 25
- •Натрій 20-21, 69, 89
- •Термодинамічні 8, 54
- •Атомів 33, 50
- •Список рекомендованої літератури
- •Глава 1. Основні поняття та закони хімії ........................ 5
4.3. Водневий зв’язок
Водневий зв’язок пояснюється здатністю атома гідроґену сполученого з атомом сильно електронеґативного елемента (F, O, N, у меншій мірі Cl та S), утворювати ще один хімічний зв’язок із електронеґативним елементом. Утворення водневого зв’язку зумовлене дуже малим розміром досить поляризованого атома гідроґену в сполуці. При утворенні полярного ковалентного зв’язку між атомами гідроґену та атомами з високою електронеґативністю електронна хмара атома гідроґену сильно зсувається до атома електронеґативного елемента. У підсумку атом електронеґативного елемента набуває значного ефективного від’ємного заряду, а ядро атома гідроґену (протон) майже втрачає електронну хмару. Між протоном гідроґену та від’ємно зарядженим атомом ковалентно-полярної молекули виникає електростатична взаємодія, яка й зумовлює утворення водневого зв’язку. Окрім того, виникнення водневого зв’язку зумовлює також донорно-акцепторна взаємодія, оскільки атом гідроґену має вакантну орбіталь, а атом електронеґативного елемента – неподілену електронну пару (чи пари). У графічних формулах водневий зв’язок позначається трьома крапками. У твердому, рідкому і навіть газоподібному станах молекули фтороводню асоційовані у зигзагоподібні ланцюги:


 F
F F
F
F F
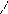






 H H
H H H H
H H
H H H H



F F F F
що зумовлено водневими зв’язками. Кут між зв’язками HFH дорівнює 134о. Як показує визначення густини пари, навіть при температурі, близькій до точки кипіння, середній склад фтороводню приблизно відповідає формулі (HF)4. Асоціація молекул спричинює аномально високі температури плавлення й кипіння фтороводню порівняно з водневими сполуками інших елементів головної підґрупи сьомої ґрупи. Енерґія водневого зв’язку становить 8 – 40 кДж/моль і за міцністю дещо перевищує енергію вандерваальсової взаємодії, проте набагато менша за енергію ковалентного зв’язку.
Енерґія водневого зв’язку зменшується зі збільшенням температури. Водневий зв’язок відіграє важливу роль при асоціації молекул, кристалізації, розчиненні, утворенні кристалогідратів, електролітичні дисоціації, у хімії органічних сполук, особливо вуглеводів, білків, нуклеїнових кислот.
Водневий зв’язок може виникати не лише між атомами різних молекул, а й між атомами однієї молекули, що особливо характерно для орґанічних речовин. Одним із типових прикладів може служити внутрішньо-молекулярний водневий зв’язок у молекулі орто-нітрофенолу:
 N-----
O
N-----
O
О
Н
O
4.4. ХІМІЧНИЙ ЗВ'ЯЗОК У МЕТАЛАХ
Наявність вільних електронів визначає всю сукупність властивостей речовин у металічному стані: високу електро- і теплопровідність; позитивний температурний коефіцієнт електроопору, здатність добре відбивати світлові хвилі (що зумовлює їхній характерний блиск і непрозорість), високу пластичність (ковкість), термоелектронну емісію, явище фотоефекту, магнітні властивості та ін.
На відміну від ковалентних і йонних сполук у металах невелике число електронів одночасно зв'язує велике число атомних ядер. Узагальненням валентних електронів металевий зв'язок дещо нагадує ковалентний. Проте у металів узагальнені електрони не належать окремим парам атомів, вони повністю делокалізовані. Цим пояснюється відсутність просторової напрямленості та насиченості металевого зв'язку. Делокалізація валентних електронів є наслідком багатоцентрового характеру металічного зв'язку й причиною високої електро- та теплопровідності металів.
Отже, металевий зв'язок є багатоцентровим хімічним зв'язком з дефіцитом електронів і базується на узагальненні зовнішніх електронів атомів. Тому він характерний лише для конденсованого стану речовини. У газуватому стані атоми всіх речовин, у тому числі й металів, зв'язані між собою тільки ковалентним зв'язком.
