
- •Глава 1. Основні поняття та закони хімії
- •1.1. Основні поняття хімії
- •1.2. Фундаментальні та стехіометричні закони хімії
- •1.2.1. Закон збереження маси речовини
- •1.2.2. Закон сталості складу речовин
- •1.2.3. Закон кратних відношень
- •1.2.4. Закон еквівалентів.
- •1.3. Закони газового стану
- •1.3.1. Закон об’ємних відношень гей-люсака
- •1.3.2. Закон авогадро
- •1.3.3. Закон бойля – маріотта
- •Контрольні завдання
- •Б) Із закону Авогадро випливає, що об’єм 0,025 моль h2s за нормальних умов
- •В) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
- •Приклад 3. Який об’єм за нормальних умов займуть 4 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 104 Па?
- •Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
- •Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Відповідно до закону еквівалентів (1.1), маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
- •Зі співвідношення (1.8) знаходимо еквівалентну масу h3ро4:
- •Приклад 8. Обчислити точну атомну масу металу, якщо питома теплоємність металу дорівнює 0,23 кДж/(кг к), а хлорид цього металу містить 61,2% металу.
- •Приклад 10. Визначити формулу речовини, якщо відомо, що її густина за воднем дорівнює 29, а масові частки елементів наступні: с – 82,76%, н – 17,24%.
- •Глава 2. Класи неорганічних сполук
- •2.1. Оксиди.
- •2.1.1. Способи одержання оксидів
- •2.1.2. Класифікація та хімічні властивості оксидів
- •2.2. Гідроксиди металів
- •2.2.1. Способи одержання гідроксидів
- •2.2.2. Хімічні властивості гідроксидів металів
- •2.3. Кислоти
- •2.3.1. Способи одержання кислот
- •2.3.2. Хімічні властивості кислот
- •2.4.1.Основні способи одержання солей
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •3.2. Корпускулярно-хвильова природа електрона
- •3.3. Принцип невизначеності
- •3.4. Періодичний закон
- •3.5. Періодична система елементів
- •3.6. Електронні хмари
- •3.7. Квантові числа
- •3.8. Принцип паулі
- •3.9. Послідовність заповнення електронами енерґетичних рівнів у багатоелектронних атомах
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •Приклад 8. Які найвищий та найнижчий ступені окислення у фосфору, сульфуру та хлору? Скласти формули сполук даних елементів, що відповідають цим ступеням окислення.
- •Приклад 12. Як залежать кислотно-основні властивості оксидів і гідроксидів від ступеня окиснення атомів елементів, що їх утворюють?
- •Приклад 13. Відомо, що кремній є неметалом з напівпровідниковими властивостями. Які властивості будуть виявляти алюміній і фосфор?
- •Приклад 15. Як змінюються властивості вищих оксидів елементів третього періоду?
- •4.1.1. Характерні властивості ковалентного зв’язку
- •4.1.1.1. Насиченість ковалентного зв’язку
- •Мал. 4.3. Різновиди σ-зв’язків.
- •Мал. 4.3. Різновиди π-зв’язків.
- •4.1.1.3. Полярність і поляризованість ковалентного зв’язку.
- •4.3. Водневий зв’язок
- •4.5. Міжчастинкові взаємодії
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач Приклад 1. Довжина диполя молекули дорівнює 2,2 10-11 м. Обчисліть дипольний момент молекули.
- •Приклад 2. Обчислити довжину зв’язку в молекулі hBr, якщо між’я-дерні відстані у молекулах h2 та Br2 відповідно дорівнюють 7,4 · 10-11 м та 2,28 10-10 м.
- •Приклад 3. Яка гібридизація електронних хмар має місце в атомі карбону при утворенні молекули cf4? Якою є просторова конфігурація цієї молекули?
- •Приклад 4. Якими є валентні можливості атома фосфору в основному та збудженому станах?
- •Приклад 5. Визначте, що є донором електронної пари при утворенні йона bh4-.
- •Глава 5. Основи хімічної термодинаміки
- •5.2. Перший закон термодинаміки
- •5.3. Закони термохімії
- •5.4. Поняття про ентропію
- •5.5. Другий закон термодинаміки
- •5.6.Третій закон термодинаміки
- •5.7. Вільна енергія Ґіббса
- •Приклад 1. Складіть термохімічне рівняння реакції горіння 1 моль ацетилену, якщо при цьому виділяється 1255,61 кДж теплоти.
- •Приклад 3. Не здійснюючи обчислень, поясніть, як змінюється ентропія системи (s): а) при переході води в пару; б) у реакції:
- •Приклад 4. Обчисліть зміну енерґії Ґіббса у хімічній реакції
- •І зробіть висновки про можливість мимовільного перебігу даної реакції за стандартних умов.
- •Стандартні зміни енерґій Ґіббса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •6.1. Поняття про швидкість хімічної реакції
- •6.2. Основний закон хімічної кінетики – закон діючих мас.
- •Межі застосування закону діючих мас.
- •6.3. Молекулярність реакції.
- •6.4. Порядок реакції.
- •6.5. Особливості кінетики гетероґенних реакцій.
- •6.6. Механізм хімічних реакцій.
- •6.7. Вплив температури на швидкість реакції. Правило Вант-Гоффа.
- •6.8. Рівняння Арреніуса. Енерґія активації
- •Вихідні Активов. Продукти
- •Мал.6.3. Енерґетична діаграма Мал.6.4. Розподіл молекул за
- •Глава 7. Хімічна рівновага.
- •7.1. Константа хімічної рівноваги
- •7.2. Зсув хімічної рівноваги. Принцип Ле-Шательє
- •7.3. Рівновага у гетероґенних системах
- •Константа рівноваги.
- •Глава 8. Поняття про каталіз.
- •8.1. Автокаталіз
- •8.2.Промотори та каталітичні отрути
- •8.3. Селективність каталізаторів
- •8.4. Механізми гомоґенного та гетероґенного каталізу
- •Підставляючи дані нашої задачі, одержуємо:
- •Глава 9. Розчини
- •9.1. Процес розчинення. Типи розчинів
- •9.2. Способи виразу концентрації речовин
- •9.3. Хімічна (гідратна) теорія розчинів д.І. Менделєєва
- •9.4. Теплові ефекти розчинення
- •9.5. Розчинність
- •Глава 10. Властивості розчинів
- •10.1. Тиск пари розчинника над розчином
- •10.2. Температури замерзання та кипіння розчинів
- •10.3. Осмотичний тиск
- •Глава 11. Електролітична дисоціація.
- •11.1. Основні положення теорії електролітичної дисоціації
- •11.2. Ступінь дисоціації
- •11.3. Слабкі електроліти. Константа дисоціації слабких електролітів
- •11.4. Вплив однойменних іонів на дисоціацію слабких електролітів
- •11.5. Розчини сильних електролітів
- •11.6. Електролітична дисоціація води. Йонний добуток води. Водневий показник
- •11.7. Поняття про індикатори
- •11.8. Іонні реакції
- •11.8. Гідроліз солей
- •Типові випадки гідролізу.
- •11.8.1. Ступінь і константа гідролізу
- •Глава 12. Комплексні сполуки
- •12.1. Основні положення координаційної теорії а.Вернера
- •12.2. Класифікація комплексних сполук
- •12.3. Номенклатура комплексних сполук
- •12.3.1. Назви катіонних комплексних сполук
- •12.3.2. Назви аніонних комплексних сполук
- •12.3.3. Назви нейтральних комплексних сполук
- •12.4. Ізомерія комплексних сполук
- •12.5. Дисоціація комплексних сполук
- •Якщо у гібридизації беруть участь d-орбіталі передостаннього рівня, тоді йон називається внутрішньоорбітальним. Іноді у комплексах проявляється йонно-дипольний зв’язок, наприклад в аквакомплексах.
- •Глава 13. Електрохімічні процеси
- •13.1. Хімічні процеси на електродах
- •13.2. Електродний потенціал
- •13.3. Електрохімічний ряд напруг металів
- •13.4. Гальванічний елемент
- •13.5. Окисні й відновні потенціали
- •13.6. Рівняння Нернста
- •13.7. Акумулятори
- •13.8. Паливні елементи
- •13.9. Електроліз
- •13.9.1. Закони Фарадея
- •1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •13.10. Корозія металів
- •0,01 Моль/л 0,1 моль/л
- •Глава 14. Окисно-відновні реакції складання рівнянь окисно-відновних реакцій
- •Контрольні завдання
- •Додатки
- •Додаток 6 – Перехідні коефіцієнти
- •Предметний покажчик
- •Відновлення 18-19, 77, 81, 124, 126, 128, 135-139
- •Водень 14, 17, 37, 75, 125, 130-132, 139
- •Ізомерія 119
- •Лантаноїди 25
- •Натрій 20-21, 69, 89
- •Термодинамічні 8, 54
- •Атомів 33, 50
- •Список рекомендованої літератури
- •Глава 1. Основні поняття та закони хімії ........................ 5
4.1.1. Характерні властивості ковалентного зв’язку
До них відносяться насиченість, напрямленість і поляризованість.
4.1.1.1. Насиченість ковалентного зв’язку
Насиченість виражається в обмеженні ковалентних зв’язків, що може утворити атом даного елемента. Число ковалентних зв’язків, які утворює атом називають ковалентністю. Валентність визначається кількістю незбуджених електронів або утворює при своєму збудженні.
Збудження атома досягається переходом електронів з одного підрівня на інший (з вищою енергією) за рахунок зовнішнього енергетичного чинника. Розглянемо основний та збуджений стани деяких елементів другого й третього періоду періодичної системи:
3Li – 1s22s1 B = 1 (у збудженому та незбудженому станах);
4Ве – 1s22s2 B = 0 (у незбудженому стані);
4Ве* – 1s22s12p1 В = 2 (у збудженому стані);
5В – 1s22s22p1 В = 1 (у незбудженому стані);
5В* – 1s22s12p2 В = 3 (у збудженому стані);
Атоми елементів третього періоду на зовнішньому енергетичному рівні мають вакантний d - підрівень на який при збудженні можуть переходити s - та p - електрони зовнішнього рівня. При цьому з’являється додаткова можливість збільшення числа неспарених електронів. Так, наприклад, атом хлору в основному стані має один неспарений електрон і при затраті енергії може бути переведений у збуджений стан, який характеризується наявністю трьох, п’яти й семи неспарених електронів:
17Cl – 3s23p5 В = 1 (у незбудженому стані);
17Cl * – 3s23p43d1 В = 3 (у збудженому стані);
17Cl ** – 3s23p33d2 В = 5 (у збудженому стані);
17Cl *** – 3s13p43d3 В = 7 (у збудженому стані);
Донорно-акцепторний механізм утворення ковалентного зв’язку.
У багатьох випадках ковалентні зв’язки утворюються не внаслідок спарювання електронів різних атомів, а за рахунок неподіленої електронної пари, яка знаходиться на зовнішньому енергетичному рівні певного атома. Розглянемо донорно-акцепторний механізм утворення ковалентного зв’язку на прикладі взаємодії аміаку з катіоном водню:

У молекулі аміаку з восьми зовнішніх електронів атома шість утворюють три ковалентні зв’язки і є загальними для атомів нітроґену та гідроґену. Проте два електрони належать лише атомові нітроґену та називаються неподіленою електронною парою. Така пара електронів може брати участь в утворенні ковалентного зв’язку з іншими атомами, якщо останні мають на зовнішньому енергетичному рівні вільну орбіталь. Вільну 1s - орбіталь має наприклад іон гідроґену Н+. Тому при взаємодії молекул аміаку з катіоном гідроґену між ними виникає ковалентний зв’язок за рахунок неподіленої електронної пари атома нітроґену та вільної орбіталі йона гідроґену. При цьому утворюється катіон амонію. Такий механізм утворення ковалентного зв’язку називається донорно-акцепторним. Атом, який віддає свою неподілену електронну пару для утворення зв’язку (атом нітроґену), називається донором, а атом, який має вільну (вакантну) орбіталь і приймає електронну пару називається акцептором (катіон гідроґену).
Завдяки донорно-акцепторному механізмові утворення зв’язків збільшуються валентні можливості атомів. Наприклад, у молекулі NH3 нітроґен тривалентний, а в іоні NH4+ – чотиривалентний. Це означає, що валентність елемента визначається не тільки числом неспарених електронів, як зазначалося раніше, а й наявністю неподілених електронних пар чи вільних орбіталей на зовнішньому енергетичному рівні. Отже, у загальному випадку валентність (ковалентність елемента визначається числом орбіталей, які використовуються при утворенні хімічного зв’язку.
4.1.1.2. Напрямленість ковалентного зв’язку.
Відповідно до методу валентних зв’язків хімічний зв’язок між атомами зумовлюється перекриванням s-, p-, d- та f-орбіталей, які (окрім s-орбіталей) мають напрямленість у просторі. Тому й хімічні зв’язки, які утворюються за їхньою участю, мають у просторі певну напрямленість. Оскільки електронні орбіталі мають різну форму, то їхнє взаємне перекривання може здійснюватись різними способами. Залежно від способу перекривання електронних орбіталей розрізняють - (сигма) та - (пі) зв’язки. Сигма-зв’язок здійснюється при перекриванні електронних орбіталей вздовж лінії, яка з’єднує два ядра атомів. Він може утворюватись за рахунок двох s-електронів, одного s- і одного p-електрона, двох p-електронів, двох d-електронів. Сигма-зв’язок характеризується однією областю перекривання електронних орбіталей, він завжди одинарний, тобто утворюється за рахунок однієї електронної пари (мал.4.2)



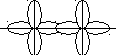



s – s (σ) p – p (σ) d – d (σ)
