
- •Основные законы химии
- •Моль. Молярная масса
- •Относительная атомная и молекулярная массы
- •Газовые законы
- •1. Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
- •Закон эквивалентов
- •Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Строение атома
- •Модели Томсона и Резерфорда
- •Закон Мозли
- •Электронная оболочка атомов по Бору
- •Представления квантовой механики
- •Современная модель состояния электрона в атоме
- •Строение электронных оболочек атомов
- •Способы записи электронных конфигураций атомов и ионов
- •Периодический закон и периодическая система элементов д.И. Менделеева в свете учения о строении атомов
- •Свойства атомов. Их периодичность
- •Химическая связь и строение молекул
- •Ковалентная связь
- •Метод валентных связей
- •Сигма () и пи ()-связи
- •Донорно-акцепторная связь
- •Свойства ковалентной связи
- •Полярные и неполярные молекулы
- •Относительная электроотрицательность атомов
- •Ионная связь
- •Гибридизация атомных орбиталей
- •Гибридизация орбиталей и пространственная конфигурация молекул
- •Металлическая связь
- •Водородная связь
- •Типы кристаллических решеток
- •Валентность
- •Степень окисления
- •Комплексные соединения (комплементарность) Структура комплексных соединений
- •Хелаты и внутрикомплексные соединения
- •Реакции образования комплексных соединений
- •Номенклатура комплексных соединений
- •Пространственное строение и изомерия комплексных соединений
- •Диссоциация комплексных соединений в растворах. Константа нестойкости. Константа устойчивости
- •Связь в комплексных ионах
- •Реакции с участием комплексных соединений
- •1) Реакции обмена
- •2) Окислительно-восстановительные реакции
- •Элементы химической термодинамики Основные понятия
- •Внутренняя энергия. Первый закон термодинамики. Энтальпия
- •Закон Гесса. Следствия из него
- •Второй закон термодинамики. Энтропия
- •Термодинамические потенциалы
- •14 Типы реакций, различающиеся возможностьюи условиями протекания в зависимости от характера изменения ∆н и ∆s
- •Химическая кинетика Основные понятия
- •Скорость химической реакции
- •Зависимость скорости реакции от концентрации реагентов
- •Влияние температуры на скорость реакции
- •Дисперсные системы
- •Классификация дисперсных систем
- •Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Количественные характеристики дисперсных систем
- •Устойчивость дисперсных систем
- •Применение
- •Растворы Растворы в природе. Теории растворов
- •Механизм процесса растворения
- •Тепловые эффекты при растворении
- •Ненасыщенные, насыщенные и пересыщенные растворы
- •Растворимость различных веществ в воде
- •Выражение количественного состава растворов
- •Разбавленные растворы неэлектролитов и их свойства
- •Эбуллиоскопическая и криоскопическая константы
- •Растворы электролитов и их свойства
- •Диссоциация воды. Водородный показатель
- •Гидролиз солей
- •Буферные растворы
- •Водородный показатель (рН) растворов
- •Свойства кислотно-основных индикаторов
- •Применение
- •Окислительно-восстановительные реакции
- •Распространенные окислители и их продукты
- •Важнейшие восстановители и окислители
- •Методы составления уравнений окислительно-восстановительных реакций
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Эквивалентные массы окислителя и восстановителя
- •Классификация окислительно-восстановительных реакций
- •4) Особые случаи овр:
- •Электрохимические системы Общая характеристика
- •Электродный потенциал. Измерение электродных потенциалов
- •Ряд стандартных электродных потенциалов (напряжений). Уравнение Нернста
- •Ряд напряжений металлов
- •Гальванические элементы, их электродвижущая сила
- •Аккумуляторы
- •Характеристики аккумулятора Эдисона и свинцового аккумулятора
- •Топливные элементы
- •Электролиз
- •Законы электролиза
- •Применение электролиза
- •Высокомолекулярные соединения (вмс) или полимеры
- •Физические свойства
- •Классификация
- •Полимеризационные полимеры
- •Поликонденсационные полимеры
- •Применение
- •Олигомеры
Влияние среды на протекание окислительно-восстановительных реакций
Реакции окисления-восстановления могут протекать в различных средах: в кислой (избыток Н+ - ионов ), нейтральной (Н2О) и щелочной (избыток гидроксид – ионов ОН-). В зависимости от среды может измениться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Рассмотрим взаимодействие перманганата калия с сульфитом калия в зависимости от pH среды.
Реакции в кислой среде
5K2S+4O3 + 2KMn+7O4 + 3H2SO4 = 6K2S+6O4 + 2Mn+2SO4 + 3H2O
электронный баланс
|
Mn7+ + 5ē = Mn2+ |
2 |
|
S4+ – 2ē = S+6 |
5 |
метод полуреакций
|
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O |
2 |
|
SO32- + H2O – 2ē = SO42- + 2H+ |
5 |
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
или 2MnO4- + 6H+ + 5SO32- = 2Mn2+ + 3H2O + 5SO42-
Фиолетовый раствор KMnO4 обесцвечивается при добавлении раствора K2SO3.
Реакции в нейтральной среде
3K2S+4O3 + 2KMn+7O4 + H2O = 3K2S+6O4 +2Mn+4O2¯ + 2KOH
электронный баланс
|
S4+ – 2ē = S6+ |
3 |
|
Mn7+ + 3ē = Mn4+ |
2 |
метод полуреакций
|
MnO41- + 2H2O + 3ē = MnO2 + 4OH- |
2 |
|
SO32- + 2OH- - 2ē = SO42- + H2O |
3 |
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 4H2O + 3SO32- + 6OH- = 2MnO2 + 8OH- + 3SO42- + 3H2O
или 2MnO4- + H2O + 3SO32- = 2MnO2 + 2OH- + 3SO42-
Фиолетовый раствор KMnO4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
Реакции в щелочной среде
K2S+4O3 + 2KMn+7O4 + 2KOH = K2S+6O4 +2K2Mn+6O4 + H2O
электронный баланс
|
S4+ – 2ē = S6+ |
1 |
|
Mn7+ + 1ē = Mn6+ |
2 |
метод полуреакций
|
SO32- + 2OH- - 2ē = SO42- + H2O |
1 |
|
MnO41- + ē = MnO42- |
2 |
–––––––––––––––––––––––––––––––––––––
SO32- + 2OH- + 2MnO4- = SO42- + H2O + 2MnO42-
Фиолетовый раствор KMnO4 превращается в зеленоватый раствор K2MnO4.
Схематически эти изменения можно представить

Перманганат калия называют минеральным «хамелеоном».
Реакции
с дихроматом калия в качестве окислителя.
Хром
в своих соединениях имеет наиболее
характерные степени окисления +6 и +3. В
первом случае соединения хрома проявляют
свойства окислителей, во втором
восстановителей. В кислой среде ионы
![]() –
сильные окислители, они восстанавливаются
до соединенийCr3+.
В щелочной среде ионы [Cr(OH)6]3-
окисляются до ионов
–
сильные окислители, они восстанавливаются
до соединенийCr3+.
В щелочной среде ионы [Cr(OH)6]3-
окисляются до ионов
![]() .Наблюдается
изменение окраски реакционной массы с
желто-оранжевого цвета до зеленого или
фиолетового. Схематически
эти изменения можно представить
.Наблюдается
изменение окраски реакционной массы с
желто-оранжевого цвета до зеленого или
фиолетового. Схематически
эти изменения можно представить
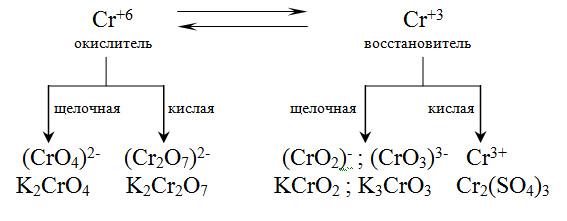
В зависимости от реакции среды имеют место переходы
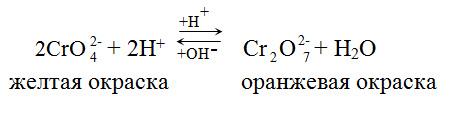
Реакции в кислой среде.
K2Cr2+6O7 + 3H2S-2 + 4H2SO4 = K2SO4 + Cr2+3(SO4)3 + 3S0 + 7H2O
электронный баланс
|
2Cr6+ + 6ē = 2Cr3+ |
1 |
|
S2- - 2ē = S0 |
3 |
метод полуреакций
|
Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O |
1 |
|
H2S0 - 2ē = S0 + 2H+ |
3 |
––––––––––––––––––––––––––––––––––
Cr2O72- + 8H+ + 3H2S = 2Cr3+ + 7H2O + 3S0
K2Cr2+6O7 + 6Fe+2SO4 + 7H2SO4 = 3Fe2+3(SO4)3 + K2SO4 + Cr2+3(SO4)3 + 7H2O
электронный баланс
|
2Cr6+ + 6ē = 2Cr3+ |
1 |
|
Fe2+ – ē = Fe3+ |
6 |
метод полуреакций
|
Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O |
1 |
|
Fe2+ - ē = Fe3+ |
6 |
–––––––––––––––––––––––––––––––––––––
6Fe2+ + Cr2O72- + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
K2Cr2+6O7 + 14HCl- = 3Cl20 + 2KCl + 2Cr+3Cl3 + 7H2O
электронный баланс
|
2Cr6+ + 6ē = 2Cr3+ |
1 |
|
2Cl- – 2ē = Cl20 |
3 |
метод полуреакций
|
Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O |
1 |
|
2Cl1- - 2ē = Cl20 |
3 |
–––––––––––––––––––––––––––––––––––
Cr2O72- + 6Cl- + 14H+ = 2Cr3+ + 3Cl20 + 7H2O
Реакции в щелочной среде. Для создания щелочной среды применяют растворы гидроксида калия или натрия. В результате реакции, вновь образующиеся анионы кислотных остатков взаимодействуют с металлом среды и образуют соли.
+3 0 +6 -1
NaCrO2 + Cℓ2 + NaOH = Na2CrO4 + NaCℓ + H2O
восстановитель окислитель среда
метод полуреакций
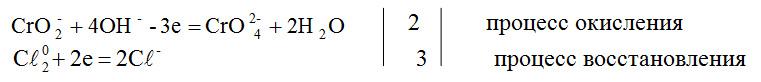
![]() +
8OH–
=
+
8OH–
=
![]() +
4H2O
+ 6Cℓ-
+
4H2O
+ 6Cℓ-
или
2NaCrO2 + 3Cℓ2 + 8NaOH = 2Na2CrO4 + 6NaCℓ + 4H2O.
Реакции в нейтральной среде.
Fe+2(OH)2 + O20 + H2O = Fe+3(OH)3
восстановитель окислитель среда
электронный баланс

4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
