
- •СОДЕРЖАНИЕ
- •ХРОМАТОГРАФИЯ
- •ХРОМАТОГРАФИЯ НА БУМАГЕ
- •ТОНКОСЛОЙНАЯ ХРОМАТОГРАФИЯ
- •ГАЗОВАЯ ХРОМАТОГРАФИЯ
- •ВЫСОКОЭФФЕКТИВНАЯ ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ
- •ХИРАЛЬНАЯ (ЭНАНТИОСЕЛЕКТИВНАЯ) ХРОМАТОГРАФИЯ
- •СВЕРХКРИТИЧЕСКАЯ ФЛЮИДНАЯ ХРОМАТОГРАФИЯ
- •АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- •ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- •ЭЛЕКТРОПРОВОДНОСТЬ
- •ЭЛЕКТРОФОРЕЗ
- •КАПИЛЛЯРНЫЙ ЭЛЕКТРОФОРЕЗ
- •СПЕКТРОМЕТРИЯ В БЛИЖНЕЙ ИНФРАКРАСНОЙ ОБЛАСТИ
- •АВТОМАТИЧЕСКИЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ
- •ОПТИЧЕСКАЯ МИКРОСКОПИЯ
- •ПОТЕРЯ В МАССЕ ПРИ ВЫСУШИВАНИИ
- •ОБЩИЕ РЕАКЦИИ НА ПОДЛИННОСТЬ
- •КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- •МЕТОД СЖИГАНИЯ В КОЛБЕ С КИСЛОРОДОМ
- •АЛЮМИНИЙ
- •АММОНИЙ
- •КАЛЬЦИЙ
- •МЫШЬЯК
- •РТУТЬ
- •СЕЛЕН
- •СУЛЬФАТЫ
- •ФОСФАТЫ
- •ХЛОРИДЫ
- •ЦИНК
- •ВАЛИДАЦИЯ АНАЛИТИЧЕСКИХ МЕТОДИК
- •ОПРЕДЕЛЕНИЕ ВОДЫ
- •ОПРЕДЕЛЕНИЕ ФТОРА
- •ОПРЕДЕЛЕНИЕ ЦИНКА В ПРЕПАРАТАХ ИНСУЛИНА
- •СПЕКТРОФОТОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ФОСФОРА
- •АНИЗИДИНОВОЕ ЧИСЛО
- •ГИДРОКСИЛЬНОЕ ЧИСЛО
- •ЙОДНОЕ ЧИСЛО
- •КИСЛОТНОЕ ЧИСЛО
- •ПЕРЕКИСНОЕ ЧИСЛО
- •ЧИСЛО ОМЫЛЕНИЯ
- •ЭФИРНОЕ ЧИСЛО
- •БИОЛОГИЧЕСКИЕ ИСПЫТАНИЯ ИНСУЛИНА
- •ИСТИРАЕМОСТЬ ТАБЛЕТОК
- •ОДНОРОДНОСТЬ ДОЗИРОВАНИЯ
- •ПРОЧНОСТЬ ТАБЛЕТОК НА РАЗДАВЛИВАНИЕ
- •РАСПАДАЕМОСТЬ ТАБЛЕТОК И КАПСУЛ
- •СИТОВОЙ АНАЛИЗ
- •СТЕПЕНЬ СЫПУЧЕСТИ ПОРОШКОВ
- •СТЕРИЛИЗАЦИЯ
- •ВОДА ОЧИЩЕННАЯ
- •ВОДА ДЛЯ ИНЪЕКЦИЙ
- •ИЗМЕНЕНИЯ И ДОПОЛНЕНИЯ
34. ОДНОРОДНОСТЬ ДОЗИРОВАНИЯ (ОФС 42-0129-09)
Целью испытания на «однородность дозирования» является контроль равномерности распределения действующего вещества по отдельно взятым единицам дозированной лекарственной формы (таблеткам, капсулам, суппо-
зиториям и др.). Результаты этого испытания позволяют количественно оце-
нить показатели, характеризующие разброс в содержании действующего ве-
щества по отдельно взятым единицам испытуемого дозированного препарата.
Испытание на «однородность дозирования» применимо к дозирован-
ным препаратам, содержащим как одно, так и несколько действующих ве-
ществ.
Данному испытанию обычно не подвергают:
–поливитаминные препараты;
–препараты, содержащие микроэлементы;
–препараты, содержащие активные компоненты растительного или животного происхождения;
–суспензии, эмульсии, гели, предназначенные для наружного или местного применения
идругие препараты при наличии соответствующего обоснования.
Испытание на «однородность дозирования» может быть выполнено
двумя способами:
количественным определением содержания действующего веще-
ства по отдельности в каждой отобранной для испытания единице препарата (способ 1);
точным определением массы нетто каждой отобранной для испы-
тания единицы препарата (способ 2).
Способ 1 применим для любых дозированных препаратов.
Способ 2, при отсутствии специальных обоснований, применим для оценки однородности дозирования действующего вещества при его содержании в препарате ≥25 мг и массовой доле ≥25 %. Условиями, определяющими воз-
можность применения способа 2, являются также равномерное распределе-
ние действующего вещества по массе испытуемого препарата и предусмот-
ренное в частной фармакопейной статье использование навесок усредненной пробы при «количественном определении» действующего вещества.
Случаи возможного применения способов 1 и 2 по отношению к раз-
личным лекарственным формам приведены в табл. 34.1.
Наряду со способом 2 в частную фармакопейную статью может быть включена в качестве альтернативной методика проведения испытания по способу 1, результат которой следует считать окончательным.
ОПРЕДЕЛЕНИЕ ОДНОРОДНОСТИ ДОЗИРОВАНИЯ
От испытуемой серии препарата отбирают случайным образом пробу в ко-
личестве 30 единиц, из них в произвольном порядке отбирают 10 единиц для проведения первого этапа испытания. В каждой из отобранных единиц опреде-
ляют содержание действующего вещества по способу 1 или 2. Оставшиеся 20
единиц лекарственной формы сохраняют для проведения второго этапа испыта-
ния.
Таблица 34.1 Применимость способов 1 и 2 для оценки однородности дозирования
|
Лекарственная |
|
Доза и массовая доля |
|||
|
форма |
|
действующего вещества |
|||
|
|
|
|
≥25 мг и |
|
<25 мг или |
|
|
|
|
≥25 % |
|
<25 % |
Таблетки |
|
без оболочки |
|
2 |
|
1 |
|
|
покрытые |
пленочной |
2 |
|
1 |
|
|
оболочкой |
|
|
|
|
|
|
покрытые оболочкой ме- |
|
|
|
|
|
|
тодом наращивания или |
|
1 |
|
|
|
|
прессования |
|
|
|
|
Капсулы |
|
твердые |
|
2 |
|
1 |
|
|
мягкие, содержащие |
|
|
|
|
|
|
суспензию, гель или |
|
1 |
|
|
|
|
эмульсию |
|
|
|
|
|
|
мягкие, содержащие рас- |
|
2 |
|
|
|
|
твор |
|
|
|
|
Гранулы в однодозовой |
|
|
|
1 |
|
|
упаковке |
|
|
Порошки в однодозовой |
однокомпонентные без |
2 |
упаковке |
вспомогательных ве- |
|
|
ществ |
|
|
содержащие два и более |
1 |
|
действующих веществ |
|
|
и/или вспомогательные |
|
|
вещества |
|
Лиофилизированные |
|
2 |
препараты в однодозо- |
|
|
вой упаковке |
|
|
Суспензии, эмульсии, |
|
|
гели в однодозовой |
|
|
упаковке, предназна- |
|
1 |
ченные для паренте- |
|
|
рального применения и |
|
|
приема внутрь |
|
|
Суппозитории |
|
1 |
Трансдермальные сис- |
|
1 |
темы |
|
|
Примечание
1 – применяется способ 1;
2 – возможно применение способа 2.
Способ 1 (прямое определение содержания действующего вещества)
В каждой из 10 отобранных единиц испытуемого препарата (n = 10) опреде-
ляют содержание действующего вещества по методике, приведенной в соответст-
вующем разделе частной фармакопейной статьи. Каждый из полученных резуль-
татов выражают в процентах (хi) от номинального содержания действующего ве-
щества в одной дозе (i – номер единицы препарата по порядку проведения анализа).
Cпособ 2
(расчетное определение содержания действующего вещества по массе единиц дозированного препарата)
Для каждой из 10 отобранных единиц испытуемого препарата (n = 10)
определяют массу (wi) непосредственно или по разности масс заполненной и полностью опорожненной упаковки (массу нетто) c точностью взвешивания
±0,0002 г. В частной фармакопейной статье предусматривают меры, обеспе-
чивающие полноту удаления препарата из опорожненных упаковок, но не
приводящие к изменению их масс.
С использованием полученных результатов в каждой из 10 единиц пре-
парата вычисляют содержание действующего вещества в процентах (хi) от
номинального значения:
A xi wi W ,
где: i |
– |
номер единицы препарата по порядку взвешивания; |
wi |
– |
масса нетто единицы испытуемого препарата; |
W– средняя масса нетто, определенная на единицах препарата, и с- пользованных в тесте «Количественное определение»;
А– содержание действующего вещества в единице испытуемого препарата, полученное, как указано в разделе «Количественное определение», и выраженное в процентах от номинального значения.
Примечание. Величину А рассчитывают по формуле:
A B 100
L
где: B – содержание действующего вещества в единице испытуемого пр е- парата (таблетке, капсуле, ампуле, флаконе и др.), полученное как указано в разделе «Количественное определение»;
L – номинальное содержание действующего вещества в единице исп ы- туемого препарата.
ВЫЧИСЛЕНИЕ ПОКАЗАТЕЛЕЙ ПРИЕМЛЕМОСТИ
Для полученной любым из описанных способов совокупности значе-
ний хi рассчитывают величины среднего арифметического ( X ) и стандартно-
го отклонения (s).
Соответственно найденной величине X выбирают эталонное значение
дозы (М) и рассчитывают значения первого (АV) и при необходимости второ-

го ( M-xi max) показателей приемлемости результатов испытания на «одно-
родность дозирования».
Cведения, необходимые для проведения расчетов, выбора эталонного значения дозы и нормирования первого и второго показателей приемлемости,
приведены в табл. 34.2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 34.2 |
||||||||||
|
|
|
|
|
Порядок обработки экспериментальных данных |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Обозначение |
Определение |
Пояснения (условия) |
Формула или значение |
|||||||||||||||||||||||||
|
|
|
|
|
Число единиц препара- |
Первый этап |
|
|
|
|
10 |
|
|
|
|
|
|
|||||||||||
|
n |
та, участвующих в |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
испытании |
Второй этап |
|
|
|
|
30 |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
(объем выборки) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
Номер единицы препа- |
|
|
|
|
|
|
|
|
|
|
|
от 1 до n |
|
|
|
|
|||||||||
|
|
рата по порядку анализа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
или взвешивания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
Содержание действую- |
Результаты рассчиты- |
Определяют эксперимен- |
|
||||||||||||||||||||
|
xi |
вают в % от номи- |
тально (по способу 1 или |
|
||||||||||||||||||||||||
|
щего вещества в едини- |
нального значения |
способу 2), как указано в |
|
||||||||||||||||||||||||
|
|
|
|
|
це испытуемого препа- |
содержания дейст- |
частной фармакопейной |
|
||||||||||||||||||||
|
|
|
|
|
рата, в % |
вующего вещества |
|
|
|
|
статье |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
Среднее арифметическое |
Вычисляют при |
|
|
|
|
|
xi |
|
|
|
|
||||||||||||
|
X |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
значений xi, в % |
n = 10 или n = 30 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
n |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Табличное значение |
При n = 10 |
|
|
|
|
2,3 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
критерия Стъюдента для |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
t |
f степеней свободы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
(f = n – 1) при до- |
При n = 30 |
|
|
|
|
2,0 |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
верительной вероятности |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
P, равной 95 % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вычисляется соот- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
X2 |
|
||||||||||
|
|
s |
Стандартное |
ветственно объему |
|
|
|
|
х i |
|
|
|
|
|||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||
|
|
отклонение |
выборки при |
|
|
i |
1 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
n |
1 |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
n = 10 или 30 |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
Эталонное значение дозы |
|
|
При |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
98,5 % ≤ X ≤ 101,5 % |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
М |
в % от ее номинального |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
значения |
|
|
|
|
< 98,5 % |
|
|
|
|
98,5 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
При X |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
101,5 % |
|
|
|
|
101,5 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
При X |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
АV |
Первый |
Вычисляется соответ- |
|
|
|
|
|
|
|
|
|
t s |
|
|
|
|
||||||||||
|
|
показатель |
|
|
|
M X |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
приемлемости, в % |
ственно значению M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L1 |
Максимально допусти- |
Должно выполняться |
|
|
|
|
15,0 |
|
|
|
|
|
|
|||||||||||||
|
|
условие АV ≤ L1 при |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
мое значение АV, в % |
n = 10 или 30 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
L2 |
Опорное значение |
|
|
|
|
|
|
|
|
|
|
|
25,0 |
|
|
|
|
|
|
|||||||
|
|
второго показателя |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
приемлемости, в % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M xi |
|
Второй |
Для величин xi долж- |
|
|
|
|
0,01·L2·М |
|
|
|
|
|||||||||||||||
|
max |
показатель |
но выполняться |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
приемлемости, в % |
уловие |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
М – xi ≤ 0,01·L2·М |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||

Примечание. 1. В табл. 34.2 указаны значения М для препаратов, в которых не предусмотрено превышение дозировки действующего вещества по отношению к номинальному значению.
2. Если предусмотрен избыток в содержании действующего вещества, то эту величину выражают в процентах (Т) от номинального значения (Т > 101,5 %). Допускается также, если это предусмотрено в частной фармакопейной статье, рассчитывать Т как процентное отношение среднего арифметического верхнего и нижнего пределов содержания действующего вещества в одной дозе препарата от номинального значения.
Величина М выбирается соответственно найденному значению X : при 98,5 % ≤ X ≤ T принимают M = X ,
при X < 98,5 % принимают M = 98,5 % , при X > T принимают M = T.
С использованием принятого значения М рассчитывают первый и второй показатели приемлемости, как это указано в табл. 34.2.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
Если не указано иначе в частной фармакопейной статье, то результат
испытания признается удовлетворительным, если при n = 10 первый показа-
тель приемлемости AV L1.
Если это условие не выполняется, испытание продолжают на остав-
шихся 20 ранее отобранных единицах испытуемого препарата. Окончатель-
ный результат испытания признается удовлетворительным, если при n = 30
первый показатель приемлемости AV ≤ L1 и все значения хi удовлетворяют
неравенству |
M xi |
0,01 L 2 M . |
35. ОДНОРОДНОСТЬ МАССЫ ДОЗИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ (ОФС 42-0130-09)
Испытание проводят на 20 единицах дозированной лекарственной формы или содержимого контейнеров однодозовых лекарственных форм в индивиду-
альных контейнерах, отобранных случайным образом.
Методика. Определяют среднюю массу взвешиванием 20 единиц дози-
рованной лекарственной формы или содержимого контейнеров однодозовых лекарственных форм в индивидуальных контейнерах: взвешивают каждую единицу в отдельности и рассчитывают среднюю массу.
Для капсул и твердых лекарственных форм в однодозовых контейнерах массу содержимого определяют, как описано ниже.
Капсулы. Взвешивают невскрытую капсулу. Вскрывают капсулу и уда-
ляют как можно полнее ее содержимое. Оболочку мягких капсул промывают растворителем, указанным в частной фармакопейной статье, и оставляют на воздухе до удаления запаха растворителя. Взвешивают оболочку. Массу со-
держимого каждой капсулы рассчитывают как разность между взвешивания-
ми. Повторяют определение на 19 оставшихся контейнерах.
Твердые лекарственные формы (порошки, гранулы, лиофилизаты) в
однодозовых контейнерах. При необходимости удаляют бумажную этикетку с поверхности контейнера. Промывают и высушивают внешнюю поверх-
ность контейнера. Контейнер вскрывают и тотчас взвешивают. Осторожным постукиванием освобождают контейнер от содержимого как можно полнее,
при необходимости ополаскивают его водой, затем спиртом 96 % и сушат при температуре от 100 до 105 °С в течение 1 ч или, если материал контейне-
ра не позволяет использовать нагревание при этой температуре, сушат при более низкой температуре до постоянной массы. Охлаждают в эксикаторе и взвешивают. По разности взвешиваний рассчитывают массу содержимого контейнера. Повторяют определение на 19 оставшихся контейнерах.
Требование. Лекарственную форму считают выдержавшим испытание,
если не более двух индивидуальных масс отклоняются от средней массы на вели-
чину, превышающую значение, указанное в табл. 35.1. При этом ни одна индиви-
дуальная масса не должна отклоняться от средней массы на величину, в два раза превышающую значение, указанное в табл. 35.1.
Таблица 35.1 Допустимые отклонения от средней массы дозированных
лекарственных форм
Дозированная лекарственная |
Средняя масса |
Допустимое |
|
форма |
отклонение, % |
||
|
|||
|
|
|
|
|
80 мг и менее |
10 |
|
|
|
|
|
Таблетки без оболочки и покры- |
Более 80 мг, но менее |
7,5 |
|
тые пленочной оболочкой |
250 мг |
|
|
|
250 мг и более |
5 |
|
|
|
|
|
Таблетки c оболочкой, получен- |
Для всех случаев |
15 |
|
ной методом наращивания |
|||
|
|
||
|
|
|
|
Капсулы и гранулы без покрытия, |
Менее 300 мг |
10 |
|
|
|
||
|
|
||
порошки для приема внутрь, ме- |
300 мг и более |
7,5 |
|
стного и наружного применения |
|||
|
|
||
|
|
|
|
Твердые лекарственные формы |
Более 40 мг |
10 |
|
для приготовления лекарственных |
|||
|
|
||
форм для парентерального при- |
|
|
|
менения |
|
|
|
40 мг и менее*) |
– |
||
|
|||
|
|
|
|
Суппозитории |
Для всех случаев |
5 |
|
|
|
|
*) Лекарственная форма подлежит испытанию на однородность содержания действующего вещества и не подлежит испытанию на однородность массы
Если не указано иначе в частной фармакопейной статье, данное испы-
тание не проводят для поливитаминных лекарственных препаратов и для ле-
карственных препаратов, содержащих микроэлементы.
Испытание «Однородность массы дозированных лекарственных форм» не применяют в случае, если для всех действующих веществ проводят испы-
тание на однородность дозирования.
36. ОПРЕДЕЛЕНИЕ ВРЕМЕНИ ПОЛНОЙ ДЕФОРМАЦИИ СУППОЗИТОРИЕВ НА ЛИПОФИЛЬНОЙ ОСНОВЕ (ОФС 42-0131-09)
Испытание позволяет при заданных условиях определить время,
необходимое для полной деформации суппозиториев, изготовленных на липофильной основе, под действием приложенной массы.
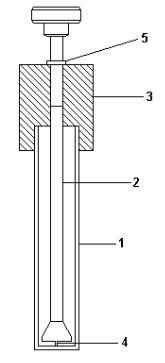
Прибор 1 (рис. 36.1) состоит из плоскодонной стеклянной трубки (1) с
внутренним диаметром 15,5 мм и длиной около 140 мм, и стержня (2)
диаметром 5,0 мм, расширяющегося книзу до диаметра 12 мм, со свободно скользящим поддерживающим устройством (3), имеющим отверстие диаметром 5,2 мм. К нижней, плоской стороне стержня крепится металлическая игла (4) диаметром 1 мм и длиной 2 мм. На верхней части стержня имеется скользящее маркировочное кольцо (5).
Стержень состоит из 2-х соединенных частей: нижней, изготовленной из пластмассы, и верхней, изготовленной из пластмассы или металла с диском определенной массы. Масса всего стержня (30 ± 0,4) г.
Рис. 36.1. Прибор 1
1 – стеклянная трубка; 2 – стержень; 3 – поддерживающее устройство стержня; 4 – металлическая игла; 5 – маркировочное кольцо в нулевом положении
Методика. Устанавливают нулевое положение маркировочного кольца, для чего вводят стержень в стеклянную трубку до достижения дна и фиксируют это положение поддерживающим устройством. При этом маркировочное кольцо передвигается на уровень верхнего края поддерживающего устройства стержня (нулевое положение).
В стеклянную трубку помещают 10 мл воды и погружают ее вертикально в водяную баню с температурой (36,5 ± 0,5) °С на глубину не менее 7 см ниже поверхности воды, но так, чтобы она не касалась дна водяной бани. В трубку заостренным концом вниз помещают суппозиторий,
затем вводят стержень до тех пор, пока металлическая игла не коснется основания суппозитория. С этого момента включают секундомер.
Регистрируют время, необходимое для достижения иглой стержня дна стеклянной трубки, соответствующего нулевому положению маркировочного кольца.
Прибор 2 (рис. 36.2) состоит из водяной бани (А) с крышкой, в
которую вставлены термометр (Б) и стеклянная трубка (В) с капиллярным переходом, закрытая пробкой с короткого конца, и вставки (Г).
В качестве вставки могут быть использованы:
– стеклянный стержень (Г1) в форме трубки, запаянной с обоих концов,
имеющий свинцовый ободок на нижнем конце. Масса стержня (30 ± 0,4) г;
– проникающая вставка (Г2), состоящая из стержня весом
(7,5 ± 0,1) г в штоке, который имеет расширение книзу для крепления суппозитория; обе части изготовлены из нержавеющей стали.
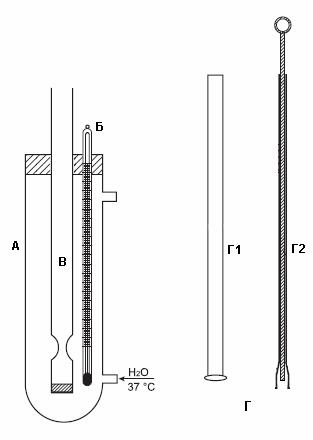
Рис. 36.2. Прибор 2
А – водяная баня; Б – термометр; В – стеклянная трубка; Г1 – стеклянный стержень; Г2 – проникающая вставка
Методика. Устанавливают и поддерживают температуру водяной бани
(36,5 ± 0,5) ºС. В трубку (В) помещают 5 мл воды с температурой
(36,5 ± 0,5) °С, суппозиторий заостренным концом вниз и вводят вставку (Г1
или Г2). При помощи секундомера регистрируют время, необходимое для достижения нижним краем вставки суженной части стеклянной трубки.
