
- •Лекции по курсу
- •Рецензенты:
- •Предисловие
- •Введение
- •Глава 1. Общие вопросы защиты окружающей среды от загрязнения
- •1. Глобальные проблемы цивилизации: энергетические, демографические, продовольственные, ресурсные, парниковый эффект, озоновые дыры, кислотные дожди и др.
- •2. Изменение глобальных характеристик биосферы под действием антропогенных факторов.
- •Природные ресурсы
- •Воздействие горного производства на окружающую среду
- •Сокращение полезной площади земель Изменение режима грунтовых вод
- •Факторы деградации почв
- •Загрязнение
- •Влияние железнодорожного транспорта на окружающую среду
- •Лекция 3. Общие положения охраны окружающей среды при хозяйственной деятельности
- •Стадии хозяйственного процесса
- •Доэксплуатационная эксплуатационная послеэксплуатационная
- •Инженерные природоохранные мероприятия
- •Формы управления Управление природопользованием
- •Управление охраной природной среды
- •Нормирование качества окружающей природной среды
- •Нормирование загрязняющих веществ в воздухе
- •Предельно допустимые концентрации некоторых веществ в воздухе, мг/м3
- •Нормирование загрязняющих веществ в водных объектах
- •Критерии оценки загрязненности воды по пдк вредных веществ
- •Экологическое нормирование
- •Регламентация выбросов загрязнений в окружающую среду
- •Глава 2. Научные основы технологических процессов Лекции 5. Основные понятия и законы природоохранных технологий
- •В этой лекции рассмотрим два вида переноса, движущую силу процесса, закономерности переноса массы и энергии, классификацию основных процессов и принципы оптимизации технологических процессов.
- •Это уравнение будем называть материальным балансом. Из уравнения (2) видно, что в процессе производства происходит перенос массы из одних компонентов, входящих в аппарат в другие.
- •Классификация основных процессов пищевых технологий
- •Теплообменные процессы
- •Массообменные процессы
- •Лекция 7. Процессы разделения неоднородных и гетерогенных систем
- •Классификация неоднородных и гетерогенных систем
- •Химические процессы
- •Сущность отдельных химических процессов и их роль в природоохранных технологиях
- •Биохимические процессы
- •Глава 3. Защита атмосферного воздуха от загрязнения
- •Источники загрязнения атмосферы
- •Пыльные бури Промышленные предприятия
- •Глава 4. Защита водного бассейна от загрязнения
- •Подпиточная Оборотная Средообразующая Промывающая Реакционная
- •Особенности канализования сточных вод
- •Условия выпуска производственных сточных вод в городскую канализацию
- •Химическая очистка сточных вод
- •Физико-химические методы очистки
- •Биологические методы очистки сточных вод
- •Доочистка сточных вод
- •Глава 5. Утилизация и ликвидация твердых отходов
- •Классификация опасности отходов производства
- •Глава 6. Защита окружающей среды от энергетического воздействия
- •Заключение
- •Литература
- •620034, Г. Екатеринбург, ул. Колмогорова, 66 УрГупс
Химическая очистка сточных вод
Химическая или реагентная очистка производственных сточных вод может применяться как самостоятельный метод перед подачей производственных сточных вод в систему оборотного водоснабжения, а также перед спуском их в водоем или городскую канализационную сеть. Применение химической очистки в ряде случаев целесообразно перед биологической или физико-химической очисткой. Химическая обработка находит применение также и как метод глубокой очистки производственных сточных вод с целью их дезинфекции, обесцвечивания или извлечения из них различных компонентов.
Нейтрализация. На железнодорожном транспорте и других отраслях промышленности производственные сточные воды от технологических процессов содержат щелочи NaOH, КОН, кислоты HCl, H2SO4, H3PO4, а также соли металлов, образованных на основе кислот или щелочей. Поэтому с целью предупреждения коррозии материалов канализационных сооружений, нарушения биохимических процессов в биологических окислителях и водоемах, а также осаждения из сточных вод солей тяжелых металлов кислые и щелочные стоки подвергают нейтрализации. В результате нейтрализации в водных растворах происходит реакция между гидратированными ионами водорода и ионами гидроксида, содержащимися соответственно в сильных кислотах и основаниях, с образованием молекулы воды и гидроксида металлов. В результате рН среды приближается к 7. Указанные реакции и способы нейтрализации подробно рассмотрены в главе 2. Здесь же рассмотрим расчет расхода реагентов.
Расход щелочного (кислого) реагента на нейтрализацию 1 м3 кислоты (щелочи), содержащейся в сточных водах, определяется по формуле:
m = CM1/М2, (90)
где С – концентрация кислоты (щелочи) или солей металлов, содержащихся в сточной воде, кг/м3;
M1 – молекулярная масса щелочного (кислого) реагента;
М2 – молекулярная масса кислоты (щелочи) или солей металлов, содержащихся в сточной воде.
В качестве реагента для нейтрализации используют любые щелочи, кислоты или их соли (NaOH, KOH, H2SO4, известняк, доломит, мел, мрамор, магнезит, сода и др.).
Процессы нейтрализации осуществляют в специальных реакторах, оборудованных перемешивающим устройством, и при необходимости проветривания – системой вытяжной вентиляции. Расчет реакторов достаточно подробно изложен в книге Плановский А.Н., Николаев П.И. «Процессы и аппараты химической и нефтехимической технологий» [1], поэтому в данной работе не рассматривается.
Кроме нейтрализации к химическим методам очистки относятся осаждение, окисление и электрохимическая обработка. Химизм этих процессов рассмотрен в главе 2. По методам расчета и аппаратурному оформлению осаждение и окисление мало отличается от нейтрализации, поэтому в данной главе они не рассматриваются.
Электрохимическая обработка широко используется для очистки сточных вод от шестивалентного хрома. Этот метод основан на пропускании постоянного электрического тока через сточную воду, находящуюся в открытых или закрытых электролизных ваннах, в которых размещены попеременно чередующиеся стальные аноды и катоды. При этом в сточной воде не должно содержаться механических примесей со скоростью осаждения (всплывания) более 0,0003 м/с и концентрацией их более 0,05 кг/м3. Очистка сточных вод от соединений шестивалентного хрома основана на реакции восстановления бихромат- и хромат-ионов ионами трехвалентного железа, которые образуются при электролитическом растворении анода, а также гидроксидом железа Fe(ОН)2, который возникает в сточной воде при взаимодействии ионов Fe2+ и ОН– (при рН ≥ 5,5).
В промышленных условиях биохимическую очистку сточных вод от соединений хрома проводят на установках, использующих в качестве питательной среды городские бытовые сточные воды со средним значением БПК 0,1 г/л. На рис. 52. представлена схема установки биохимической очистки хромсодержащих сточных вод гальванического цеха. Бытовые сточные воды с расходом 0,0236 м3/с из отстойника 1 насосом подают в смеситель 2, куда одновременно поступают хромсодержащие сточные воды с расходом 0,013 м3/с и концентрацией соединений хрома до 85 мг/л, а также активный ил с содержанием бактерий рода Pseudomonas. Из смесителя сточные воды с активным илом поступают в биовосстановители 3, в которых происходит процесс биохимического восстановления хроматов с образованием гидроксида хрома. Процесс восстановления идет при постоянном перемешивании смеси и поддержании активного ила во взвешенном состоянии. Из биовосстановителей сточная вода поступает в отстойник 4, отстаивается и очищенная от хрома направляется в резервуар 5. В этот же резервуар сбрасывается избыточный активный ил с гидроксидом хрома и осадок сточных вод из отстойника 1. Осевший активный ил из отстойника 4 перекачивается в смеситель 2 для поддержания в биовосстановителях концентрации, равной 7 г/л. Из резервуара 5 сточная вода перекачивается в канализацию и далее поступает в биологические установки станции водоочистки, где в первичных отстойниках осаждается гидроксид хрома.
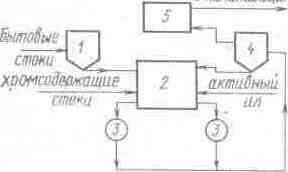
Рис. 57. Схема установки биохимической очистки хромсодержащих сточных вод:
1 – отстойник бытовых вод; 2 – смеситель; 3 – биовосстановители; 4 – отстойник; 5 – резервуар.
