
- •Лекции по курсу
- •Рецензенты:
- •Предисловие
- •Введение
- •Глава 1. Общие вопросы защиты окружающей среды от загрязнения
- •1. Глобальные проблемы цивилизации: энергетические, демографические, продовольственные, ресурсные, парниковый эффект, озоновые дыры, кислотные дожди и др.
- •2. Изменение глобальных характеристик биосферы под действием антропогенных факторов.
- •Природные ресурсы
- •Воздействие горного производства на окружающую среду
- •Сокращение полезной площади земель Изменение режима грунтовых вод
- •Факторы деградации почв
- •Загрязнение
- •Влияние железнодорожного транспорта на окружающую среду
- •Лекция 3. Общие положения охраны окружающей среды при хозяйственной деятельности
- •Стадии хозяйственного процесса
- •Доэксплуатационная эксплуатационная послеэксплуатационная
- •Инженерные природоохранные мероприятия
- •Формы управления Управление природопользованием
- •Управление охраной природной среды
- •Нормирование качества окружающей природной среды
- •Нормирование загрязняющих веществ в воздухе
- •Предельно допустимые концентрации некоторых веществ в воздухе, мг/м3
- •Нормирование загрязняющих веществ в водных объектах
- •Критерии оценки загрязненности воды по пдк вредных веществ
- •Экологическое нормирование
- •Регламентация выбросов загрязнений в окружающую среду
- •Глава 2. Научные основы технологических процессов Лекции 5. Основные понятия и законы природоохранных технологий
- •В этой лекции рассмотрим два вида переноса, движущую силу процесса, закономерности переноса массы и энергии, классификацию основных процессов и принципы оптимизации технологических процессов.
- •Это уравнение будем называть материальным балансом. Из уравнения (2) видно, что в процессе производства происходит перенос массы из одних компонентов, входящих в аппарат в другие.
- •Классификация основных процессов пищевых технологий
- •Теплообменные процессы
- •Массообменные процессы
- •Лекция 7. Процессы разделения неоднородных и гетерогенных систем
- •Классификация неоднородных и гетерогенных систем
- •Химические процессы
- •Сущность отдельных химических процессов и их роль в природоохранных технологиях
- •Биохимические процессы
- •Глава 3. Защита атмосферного воздуха от загрязнения
- •Источники загрязнения атмосферы
- •Пыльные бури Промышленные предприятия
- •Глава 4. Защита водного бассейна от загрязнения
- •Подпиточная Оборотная Средообразующая Промывающая Реакционная
- •Особенности канализования сточных вод
- •Условия выпуска производственных сточных вод в городскую канализацию
- •Химическая очистка сточных вод
- •Физико-химические методы очистки
- •Биологические методы очистки сточных вод
- •Доочистка сточных вод
- •Глава 5. Утилизация и ликвидация твердых отходов
- •Классификация опасности отходов производства
- •Глава 6. Защита окружающей среды от энергетического воздействия
- •Заключение
- •Литература
- •620034, Г. Екатеринбург, ул. Колмогорова, 66 УрГупс
Массообменные процессы
Основы массопередачи
Технологические процессы, скорость протекания которых определяется скоростью переноса вещества (массы), называются массообменными. К массообменным процессам относятся: абсорбция, адсорбция, ионный обмен, перегонка и ректификация, растворение и кристаллизиция, сушка, экстрагирование и экстракция, мембранные процессы.
Движущей силой массобменных процессов является разность концентраций.При растворении вещества в воде оно переходит из твердой фазы в жидкую. При очистке жидкостей или газов с помощью активированного угля вещество переходит из жидкой или газовой фазы в твердую. При разбавлении растворов происходит переход вещества из одной жидкой фазы в другую.
Массообменные процессы принято классифицировать по агрегатному состоянию и характеру взаимодействия фаз. Переход вещества из одной фазы в другую в направлении достижения равновесия называется массопередачей.Значит, в основе наших представлений о массопередаче лежит понятиеравновесия фаз. Массоперенос начинается, если концентрация вещества во взаимодействующих фазах отличается от равновесной.Достижение равновесия системы подчиняется принципу Ле-Шателье: реакция системы против внешнего воздействия направлена на уменьшение этого воздействия. При этом, скорость перехода распределяемого вещества из одной фазы в другую пропорциональна разности между его фактической концентрацией в данной фазе и равновесной концентрацией. Это и есть истинная движущая сила этого процесса.
Состояние равновесия подчиняется правилу фаз Гиббса, которое гласит:для равновесной термодинамической системы, на которую из внешних факторов действуют только температура и давление, число степеней свободы С равно числу компонентов К минус число фаз Ф, плюс два:
С = К – Ф + 2 (29)
Число степеней свободы – это число независимых переменных (температура, давление и концентрация вещества в фазах). Если однокомпонентная система состоит из двух фаз находящихся в равновесии, число степеней свободы в этом случае равно 1. Это значит, что для нее произвольно выбирать можно только один параметр, с помощью которого эту систему можно будет вывести из равновесия и начать технологический процесс. Например, для однокомпонентной системы вода-пар от изменения давления изменяются количество воды, обращенной в пар и температура смеси.
Основной закон массопередачи можно сформулировать, исходя из общих кинетических закономерностей физико-химических процессов: скорость процесса равна движущей силе, деленной на сопротивление:
d2M/dFdτ=ΔC/R, (30)
где dM– количество вещества, перешедшего из одной фазы в другую,dF– площадь поверхности фазового контакта;dτ– продолжительность процесса;ΔC– движущая сила массообменного процесса;R– сопротивление массопереносу.
Заменив сопротивление Rв уравнении (30) на коэффициент массопередачи
kм= 1/Rи проинтегрировав его по времени получим для установившихся процессов основное уравнение массопередачи:
М = kмΔCF(31)
Основные законы массопередачи
В процессах переноса распределяемого вещества из одной фазы в другую надлежит различать два случая: 1)перенос из потока жидкости в поток жидкости; 2)перенос из твердого тела в поток жидкости или в обратном направлении. Элементарными законами, которым подчиняется этот перенос, являются законы молекулярной диффузии, закон массоотдачи и закон массопроводности.
Закон молекулярной диффузии (первый закон Фика). Молекулярная диффузия в газах и растворах жидкостей происходит в результате хаотического движения молекул, не связанного с движением потока жидкости. Благодаря этому осуществляется перенос вещества из области с высокой концентрацией в область с низкой концентрацией, который подчиняетсяпервому закону Фика: количество диффундирующего вещества пропорционально градиенту концентрации, площади, перпендикулярной к направлению диффузного потока, через которую осуществляется перенос и времени:
d2M= -D(ðC/ðx)dFdτ, (32)
где D– коэффициент диффузии; ðC/ðx– градиент концентрации в направлении диффузии;dF– площадь поверхности, через которую диффундирует вещество;dτ– продолжительность диффузии.
Коэффициент диффузии показывает, какое количество вещества переходит через поверхность в 1 м2 за 1 с при разности концентраций на расстоянии 1 м, равной единице.
Знак минус в уравнении (32) показывает, что перенос вещества осуществляется навстречу градиенту концентраций. Размерность коэффициента диффузии зависит от размерности концентрации, но в системе СИ она имеет следующий вид [м2/с]. Эти коэффициенты измеряются опытным путем, и для большинства веществ эти данные приводятся в справочной литературе.
Заметим, что первый закон Фика является аналогом закона теплопроводности Фурье, а явления переноса теплоты и массы во многом схожи. Это обстоятельство и аналогичность в описании других законов тепло- и массопереноса используются при расчетах массопередачи.
Второй закон Фика – дифференциальное уравнение молекулярной диффузии. Аналогично дифференциальному уравнению теплопроводности Фурье дифференциальное уравнение молекулярной диффузии имеет следующий вид:
ðC/ðτ=D(ð2C/ð2x+ ð2C/ð2y+ ð2C/ð2z) или ðC/ðτ=D2С (33)
Закон массоотдачи Щукарева. Этот закон является аналогом закона теплоотдачи (закона охлаждения) твердого тела Ньютона. Он был сформулирован русским ученым А.Н.Щукаревым при изучении кинетики растворения твердых тел:Количества вещества, переносимого из одной фазы в другую, пропорционально разности концентраций у поверхности раздела фаз и в ядре потока воспринимающей фазы, площади поверхности фазового контакта и времени:
d2M=β(Cr- Сf)dFdτ, (34)
где Crи Сf– концентрации вещества у поверхности раздела и в ядре потока воспринимающей фазы;β– коэффициент массоотдачи, имеющий размерность м/с.
Коэффициент массоотдачи показывает, какое количества вещества переносится из одной фазы в другую через 1 м2 поверхности фазового контакта за 1 с, если разность концентраций на границе раздела фаз и в ядре потока равна единице.
Для установившихся процессов и неизменности коэффициента теплоотдачи закон Щукарева принимает форму:
M=β(Cr- Сf)F(35)
Закон массопроводности. Массопередача в система с твердой фазой представляет особо сложный процесс. В нем, кроме массопередачи от поверхности раздела фаз в поток жидкости, имеет место и перемещение вещества в твердой фазе – массопроводность. К указанным процессам можно отнести процессы адсорбции, сушки и выщелачивания (извлечение вещества растворителем из пор твердого тела).Закон массопроводностизаключается в следующем:количество вещества, переместившегося в твердой фазе за счет массопроводности, пропорционально градиенту концентраций, площади перпендикулярной направлению потока вещества, и времени:
dM= - Км(ðC/ðx)dFdτ, (36)
где Км– коэффициент массопроводности или коэффициент «стесненной» диффузии, который можно определить по формуле Кади и Виьямса
Dст =D/[1 +m(r/R)], (37)
где D– коэффициент молекулярной диффузии,r– размер диффундирующих молекул;R– поперечный размер пор твердого тела;m– числовой коэффициент.
Абсорбция
Абсорбция – поглощение газов или паров из газовых или паровых смесей жидкостями поглотителями, называемыми абсорбентами.
Для большинства случаев этот процесс обратимый, т.е. в определенных условиях, например, при нагревании, можно выделить газ из жидкости. Такой процесс называется десорбцией.
Процесс насыщения воды диоксидом углерода, называемый сатурацией, является классическим примером процесса абсорбции.
Закон Генри. Равновесие при абсорбции. Количество газа, которое может поглотить жидкость, зависит от свойств газа и жидкости, температуры и парциального давления поглощаемого газа в газовой смеси над поверхностью жидкости. В качестве основного закона, характеризующего равновесие в системе газ-жидкость, используетсязакон Генри:при данной температуре концентрация газа в растворе пропорциональна парциальному давлению газа над раствором:
х= р/Е, (38)
где р – парциальное давление газа над раствором, х – концентрация газа в растворе, Е – коэффициент пропорциональности (коэффициент Генри), который зависит от природы растворяющегося вещества и температуры и не зависит от давления.
Для идеальных растворов по диаграмме р – х (рис. 14) зависимость равновесных концентраций от давления изображается прямой линией с угловым коэффициентом, равным Е.
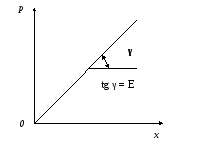
Рис. 14. Зависимость растворимости газа от давления
При неизменных давлении и концентрации, но с повышением температуры константа Е увеличивается, что ведет к уменьшению растворимости газа в жидкости.
Уменьшение общего давления ведет к уменьшению парциального давления компонентов, что соответствует закону Дальтона: общее давление газовой смеси равно сумме парциальных давлений, составляющих смесь компонентов:
Р = рА+ рВ(39)
Из закона Дальтона следует, что парциальное давление компонента пропорционально общему давлению и его концентрации
рА= РуА (40)
Подставив последнее выражение в закон Генри (38) получим:
уА = Е хА/ р или уА =nхА, (41)
где n– коэффициент распределения или константа фазового равновесияn= Е/р.
Если равновесная система состоит из жидкости и смеси газов, закону Генри может следовать каждый из компонентов смеси в отдельности.
Ректификация
Ректификация – разделение жидкой смеси на чистые или обогащенные составляющие в результате противоточного взаимодействия пара и жидкости.Очень часто ректификация используется для очистки воды или почвы, загрязненных нефтепродуктами. В этом случае имеет место переход веществ из жидкой фазы в паровую, и наоборот. При ректификации исходная смесь делится на две части: часть, обогащенную летучими компонентами – дистиллят, и часть, обедненную летучими компонентами – остаток.
Обычно ректификационный аппарат состоит из двух частей или ступеней – верхней и нижней. В нижней ступени исходная, подвергаемая разделению смесь, взаимодействует с паром, начальный состав которого равен составу остатка. Вследствие этого из смеси извлекается летучий компонент.
В верхней ступени пар начального состава, соответствующего составу исходной смеси, взаимодействует с жидкостью, начальный состав которой равен составу дистиллята. Вследствие этого пар обогащается летучим компонентом до требуемого предела, а менее летучий компонент извлекается из паровой фазы.
Пар для питания ректификационного аппарата получается многократным испарением жидкости, имеющей тот же состав, что и остаток, а жидкость – многократной конденсацией пара, имеющего состав, одинаковый с составом дистиллята.
Схема периодически действующей ректификационной установки приведена на рис. 15. Исходная смесь загружается в куб 1, где нагревается до температуры кипения и испаряется. Пары проходят через ректификационную колонну 2, взаимодействуя в противотоке с жидкостью, возвращаемой из дефлегматора 3. В дефлегматоре (конденсаторе) богатые летучим компонентом пары конденсируются, и конденсат поступает в делитель потока 4. Часть жидкости из делителя потока направляется на орошение колонны, а другая часть – дистиллят – проходит через холодильник 5 и направляется в сборник 6 или 7.
Необходимо отметить, что одной из важнейших частей ректификационной установки является конденсатор или дефлегматор. Полученный в нем конденсат делится на две части: одна часть направляется обратно в колонну (флегма), другая является отбираемым продуктом (дистиллят).
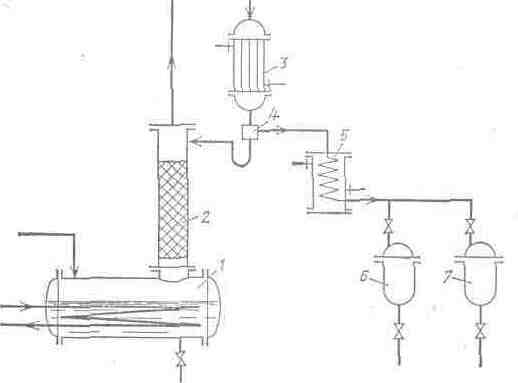
Рис. 15. Принципиальная схема ректификационной установки периодического действия
1 – куб; 2 – ректификационная колонна; 3 – дефлегматор; 4 – разделительный стакан; 5 – холодильник; 6, 7 – сборники.
Адсорбция
Адсорбция – избирательное поглощение газов, паров, или растворенных в жидкости веществ твердым поглотителем, способным поглощать одно или несколько веществ из их смеси. Процессы адсорбции и адсорбции внешне схожи. Разница между ними заключается в том, что одном случае вещество поглощается всем объемом жидкости, а в другом – только поверхностью твердого поглотителя – адсорбента.
Равновесие при адсорбции.Количество вещества, поглощенного сорбентом, зависит от концентрации поглощаемого вещества в парогазовой смеси или растворе, а также от температуры, при которой осуществляется процесс. Для изотермических процессов условие равновесия для адсорбции принимает вид уравнения Френдлиха:
xn=Cy1/n, (42)
где С и n– константы для данных веществ, зависящие от температуры.
Линии равновесия, соответствующие уравнению (41) получили название изотерм сорбции (рис. 16). Их строят по опытным данным, а затем используют для расчетов адсорбентов.
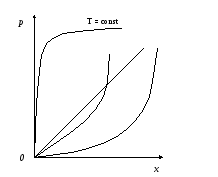
Рис. 16. Характерные формы кривых изотерм сорбции различных веществ на разных адсорбентах
В процессе адсорбции происходит выделение теплоты, что ведет к повышению температуры системе и снижение активности адсорбентов. Поэтому для поддержания скорости процессов в промышленных адсорберах предусматривают охлаждение адсорбентов.
Адсорбенты.Количество поглощаемого вещества зависит от площади поверхности поглотителя. Поэтому адсорбенты обладают чрезвычайно развитой поверхностью, что достигается за счет образования большого количества пор в твердом теле. К наиболее распространенным адсорбентам относятся:
Активированный уголь.Это самый распространенный адсорбент. Его получают сухой перегонкой дерева с последующей активизацией – прокаливанием при температуре около 900оС. Суммарная поверхность 1 г активированного угля 600-1700 м2. Размеры кусков его в зависимости от марки лежат в пределах от 1 до 5 мм. Недостатком этого адсорбента является его небольшая механическая прочность.
Силикагели.Этот адсорбент получают обезвоживанием геля кремниевой кислоты, обрабатывая силикат натрия (жидкое стекло) минеральными кислотами. Размер гранул от 0,2 до 7 мм. Суммарная поверхность 1 г силикагеля 400-770 м2.
Цеолиты.Это пористые водные алюмосиликаты катионов элементов первой и второй групп Периодической системы Д.И.Менделеева. Встречаются в природе и добываются карьерным способом. В промышленности чаще применяют синтетические цеолиты, обладающие весьма однородной структурой.
К этой же группе адсорбентов относятся апоки и клиноптилолит.
В качестве естественных адсорбентов для доочистки сточных вод используют мелкодисперсные глины: бентонит, диатомит, каолин.
Ионный обмен
Это разновидность процессов сорбции, основанная на химическом взаимодействии адсорбентов, называемых ионитами, с очищаемыми растворами. Иониты могут избирательно извлекать из раствора ионы. Этот процесс следует отнести к хемосорбции – процессу, сопровождающемуся химическими реакциями.
Очистка сточных вод методом ионного обмена позволяет извлекать и утилизировать ценные примеси, ПАВ, радиоактивные вещества, очищать сточную воду до ПДК с последующим использованием ее в технологических процессах или в системах оборотного водоснабжения.
По знаку обменивающихся ионов иониты делятся на катиониты и аниониты. Ведущая роль принадлежит синтетическим органическим ионитам – ионообменным смолам, которые подразделяются на следующие виды:
1)сильнокислотные катиониты, содержащие сульфогруппы SO3H и сильноосновные аниониты, содержащие четвертичные аммониевые основания;
2)слабокислотные катиониты, содержащие карбоксильные СООН и фенольные группы, диссоциирующие при рН>7, а также слабоосновные аниониты, содержащие первичные NH2 и вторичные NН аминогруппы, диссоциирующие при рН <7;
3)иониты смешанного типа, проявляющие свойства смеси сильных и слабых кислот или оснований.
Иониты характеризуются полной и рабочей емкостью. Полная емкость – количество ионов, которое может поглотить 1 кг ионита до полного насыщения, а рабочая емкость – количество находящихся в воде ионов, которое может поглотить 1 кг ионита до начала проскока в фильтрат.
Если катиониты находятся в Н- или Na-форме, обмен катионов будет проходить по реакциям:
Ме+ + Н(К) = Ме(К) + Н+
Ме+ + Na(К) = Ме(К) + Na+
Где Ме+ - катион, находящийся в сточной воде, (К) – сложный комплекс катионита.
Регенерация катионитов осуществляется промывкой кислотой (при Н-катионите) или раствором хлористого натрия (при Na-катионите)
2Ме(К) + Н2SО4 = 2Н(К) + МеSО4
Ме(К) + NaCl = Na(K) + MeCl
Поскольку в сточных водах, как правило, содержится несколько катионов, большое значение имеет селективность их поглощения. Для каждого вида катионита установлены ряды катионов по энергии их вытеснения.
Слабоосновные аниониты поглощают анионы сильных кислот
2(А)ОН + Н2SО4 = (А)2SО4 + 2Н2О
Для большинства анионитов справедлив следующий ряд по поглощающей способности: SO4 >NO3>Cl
Регенерация слабоосновных анионитов достигается фильтрованием через слой анионита 2-4%-ных водных растворов NaOH, Na2CO3, NH4OH
(A)2SO4 + 2NaOH + Na2SO4
Процессы ионообменной очистки сточных вод осуществляются в аппаратах периодического (фильтрах) и непрерывного действия, примерно таких же, как при сорбционной очистке.
Экстракция
Экстракция – извлечение растворенного в одной жидкости вещества или группы веществ другой жидкостью, которая не смешивается или частично не смешивается с первой.
Существует и другое определение экстракции – процесса избирательного извлечения одного или нескольких растворимых компонентов из растворов или твердых тел с помощью жидкого растворителя – экстрагента. Если вещество извлекается из жидких систем, то процесс называется жидкостной экстракцией.
Второе определение более общее. Под него подпадают и процессы растворения, выщелачивания и т.д
В общем виде процесс экстрагирования из твердого тела (выщелачивание) можно разбить на 4 стадии:
проникновение эктрагента в поры растительного сырья;
растворение извлекаемого вещества экстрагентом;
диффузионный перенос извлекаемого вещества к поверхности куска или частицы сырья;
перенос извлекаемого вещества с поверхности сырья в жидкую фазу – экстрагент.
В зависимости от вида очищаемого вещества отдельные стадии процесса могут отсутствовать вовсе, но чаще от скорости переноса на одной из стадий зависит скорость процесса в целом.
Расчет процессов экстрагирования выполняют, исходя из основного уравнения массопередачи. Количество извлекаемого вещества при экстрагировании из твердого тела зависит от скорости внутренней диффузии и определяется по следующему уравнению:
М = (Dвн/L)FΔCτ, (43)
где Dвн– коэффициент внутренней «стесненной» диффузии, м2/с;L– определяющий размер, для стружки это толщина, м;F– суммарная поверхность стружки, м2;ΔC– разность между средней концентрацией вещества внутри стружки и средней концентрацией вещества в растворе, окружающем стружку, кг/м3;τ– продолжительность процесса, с.
Процесс жидкостной экстракции основан на распределении извлекаемого вещества в смеси двух взаимонерастворимых жидкостей соответственно его растворимости в них. Отношение взаимно уравновешивающихся концентраций в двух несмешивающихся растворителях при достижении равновесия является постоянным и называется коэффициентом распределения
Кр = Сэ/Своды = const (44)
После достижения равновесия концентрация экстрагируемого вещества в экстрагенте значительно выше, чем в перерабатываемой растворе. После экстракции раствор и насыщенный экстрагент разделяются. Затем сконцентрированное в экстрагенте вещество отделяется от растворителя и может быть утилизировано. Этот процесс называется реэкстракция. Экстрагент после этого используется вновь в процессе очистки.
Сушка
Сушка – удаление влаги из материалов (продуктов, изделий) при их подготовке к транспортировке, переработке, использованию или захоронению.
Материалы, подвергаемые сушке можно разделить на две группы: твердые кристаллические тела. Различные тела неодинаково взаимодействуют с содержащейся в них влагой, по-разному ее связывают. Академик П.А.Ребиндер предложил классификацию форм связи влаги на основе энергии связи:
а) механическая – влага смачивания, содержащаяся в капиллярах и микрокапиллярах. Эта форма связи наименее прочная, такую влагу можно удалить путем механического воздействия, например, прессованием или в центрифуге;
б) физико-химическая форма связи – адсорбционная, осмотическая и структурная влага, содержащаяся в клетках и микрокапиллярах. Для разрушения этой формы связи требуется намного больше энергии. Для ее удаления требуется ее испарение;
в) химическая форма связи наиболее прочная. Это ионная связь (NаОН) и вода в кристаллогидратах (СuSO4. 5H2O). Эта связь может быть разрушена либо путем химического воздействия, либо нагревом до высоких температур – прокаливанием.
Анализируя виды связи влаги с материалом, можно сделать вывод, что сначала целесообразно удалить влагу из материала механическим способом и только затем перейти к тепловой сушке.
Самый распространенный способ тепловой сушки – конвективный. В этом способе осуществляется конвективный перенос теплоты от нагретого сушильного агента к материалу. В качестве сушильных агентов используются топочные и инертные газы, а также воздух. Сушильный агент выполняет и вторую, не менее важную задачу – поглощает образовавшийся водяной пар и выводит его из сушилки. Таким образом, интенсивность процесса зависит от скорости переноса массы этой влаги в сушильный агент. Самым распространенным сушильным агентом является предварительно подогретый воздух.
Другие способы тепловой сушки, например, кондуктивный или контактный, когда материал нагревается при непосредственном контакте с поверхностью сушилки или сушка в инфракрасных лучах, как правило, комбинируют с конвективным способом.
Кристаллизация
Кристаллизация – выделение вещества из жидкой фазы, расплавов или паров в виде твердой фазы (кристаллов).
Поведение системы кристалл-раствор или кристалл-расплав в широком интервале температур, давлений и концентраций отображает диаграмма состояния, или фазовая диаграмма, на которой графически изображается равновесие между различными фазами данной системы (рис. 17).
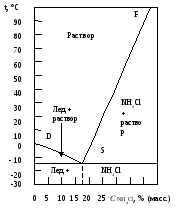
Рис. 17. Фазовая диаграмма для двухкомпонентной системы Н2О –NH4Cl
Линия FSна диаграмме является геометрическим местом точек, соответствующих насыщенным растворам, а линияSD– находящимся в равновесии со льдом. Таким образом, линияFSявляется кривой растворимостиNH4Clв воде, а линияSDсоответствует условиям выделения льда в системе соль-вода. ТочкаSявляется эвтектической точкой системы, в которой раствор находится в равновесии с двумя твердыми фазами: солью и льдом. В водных системах эвтектическую смесь называют криогидратом, а саму точку – криогидратной точкой.
Процесс кристаллизации состоит из двух последовательных стадий: образование зародышей кристаллов и рост кристаллов. Образование зародышей происходит в пересыщенных растворах, когда пересыщение достигает определенной величины. Разность между концентрацией раствора, при котором начинают образовываться зародыши, и концентрацией насыщенного раствора, называют максимальным пересыщением. После возникновения в пересыщенном растворе зародышей кристаллов с размерами большими критических (нерастворимых в пересыщенном растворе), на их поверхности начинает отлагаться кристаллическое вещество. Рост кристаллов, образование зародышей во многом зависят от температуры и интенсивности перемешивания.
Процесс кристаллизации ведется в специальных кристаллизаторах
