
- •Лекции по курсу
- •Рецензенты:
- •Предисловие
- •Введение
- •Глава 1. Общие вопросы защиты окружающей среды от загрязнения
- •1. Глобальные проблемы цивилизации: энергетические, демографические, продовольственные, ресурсные, парниковый эффект, озоновые дыры, кислотные дожди и др.
- •2. Изменение глобальных характеристик биосферы под действием антропогенных факторов.
- •Природные ресурсы
- •Воздействие горного производства на окружающую среду
- •Сокращение полезной площади земель Изменение режима грунтовых вод
- •Факторы деградации почв
- •Загрязнение
- •Влияние железнодорожного транспорта на окружающую среду
- •Лекция 3. Общие положения охраны окружающей среды при хозяйственной деятельности
- •Стадии хозяйственного процесса
- •Доэксплуатационная эксплуатационная послеэксплуатационная
- •Инженерные природоохранные мероприятия
- •Формы управления Управление природопользованием
- •Управление охраной природной среды
- •Нормирование качества окружающей природной среды
- •Нормирование загрязняющих веществ в воздухе
- •Предельно допустимые концентрации некоторых веществ в воздухе, мг/м3
- •Нормирование загрязняющих веществ в водных объектах
- •Критерии оценки загрязненности воды по пдк вредных веществ
- •Экологическое нормирование
- •Регламентация выбросов загрязнений в окружающую среду
- •Глава 2. Научные основы технологических процессов Лекции 5. Основные понятия и законы природоохранных технологий
- •В этой лекции рассмотрим два вида переноса, движущую силу процесса, закономерности переноса массы и энергии, классификацию основных процессов и принципы оптимизации технологических процессов.
- •Это уравнение будем называть материальным балансом. Из уравнения (2) видно, что в процессе производства происходит перенос массы из одних компонентов, входящих в аппарат в другие.
- •Классификация основных процессов пищевых технологий
- •Теплообменные процессы
- •Массообменные процессы
- •Лекция 7. Процессы разделения неоднородных и гетерогенных систем
- •Классификация неоднородных и гетерогенных систем
- •Химические процессы
- •Сущность отдельных химических процессов и их роль в природоохранных технологиях
- •Биохимические процессы
- •Глава 3. Защита атмосферного воздуха от загрязнения
- •Источники загрязнения атмосферы
- •Пыльные бури Промышленные предприятия
- •Глава 4. Защита водного бассейна от загрязнения
- •Подпиточная Оборотная Средообразующая Промывающая Реакционная
- •Особенности канализования сточных вод
- •Условия выпуска производственных сточных вод в городскую канализацию
- •Химическая очистка сточных вод
- •Физико-химические методы очистки
- •Биологические методы очистки сточных вод
- •Доочистка сточных вод
- •Глава 5. Утилизация и ликвидация твердых отходов
- •Классификация опасности отходов производства
- •Глава 6. Защита окружающей среды от энергетического воздействия
- •Заключение
- •Литература
- •620034, Г. Екатеринбург, ул. Колмогорова, 66 УрГупс
Лекция 7. Процессы разделения неоднородных и гетерогенных систем
План лекции:
1. Понятие неоднородных и гетерогенных систем.
2. Процессы осаждения под действием силы тяжести.
3. Осаждение в поле центробежных сил.
4. Фильтрование.
5. Коагуляция, флокуляция и флотация.
Неоднородными называют системы, образованные двумя или большим числом фаз, которые взаимно нерастворимы друг в друге. Эти системы обладают различной степенью устойчивости и могут быть, как правило, разделены под воздействием механических сил. Одна из фаз, сплошная, называется дисперсионной, а другая, мелкораздробленная и распределенная в первой – дисперсной фазой. В зависимости от вида дисперсионной среды различают неоднородные смеси, жидкие и газовые (таблица 5).
Таблица 5
Классификация неоднородных и гетерогенных систем
|
Среда |
Наименование неоднородной системы | |
|
Дисперсионная |
Дисперсная | |
|
Твердая |
Твердая |
Твердые гетерогенные системы |
|
Твердая |
Жидкая |
Капиллярные системы (жидкость в пористых телах) |
|
Твердая |
Газообразная |
Пористые тела, твердые пены |
|
Жидкая |
Твердая |
Суспензии: грубые, тонкие, мути, коллоидные растворы, и лиозоли |
|
Жидкая |
Жидкая |
Эмульсии |
|
Жидкая |
Газообразная |
Газовые эмульсии и пены |
|
Газообразная |
Твердое тело |
Аэрозоли (пыли, дымы), порошки |
|
Газообразная |
Жидкость |
Аэрозоли: туманы, в том числе и промышленные |
|
Газообразная |
Газообразная |
Коллоидная система не образуется |
Частицы веществ дисперсной фазы могут иметь различные размеры и форму. Раздробленность определяется размером тела по наименьшей оси (а). Она также характеризуется величиной обратной «а», называемой дисперсностью (D). Все дисперсные системы классифицируются по степени дисперсности: грубодисперсные (а › 10-3см), микрогетерогенные (10-3 ≥ а › 10-5см), коллоидные (10-5 ≥ а ›10-7 см), молекулярные коллоиды (растворы высокомолекулярных соединений) с размером частиц менее 10-7 см. Частицы с размером менее 10-8 см образуют растворы.
Дисперсные системы с частицами коллоидных размеров принято называть золями, системы с газовой дисперсионной средой независимо от природы газа называют аэрозолями, а системы с жидкой дисперсионной средой – лиозолями.
Коллоидные системы образуются двумя путями: диспергированием – дроблением грубодисперсных частиц до коллоидной дисперсности; конденсацией – соединением атомов ионов или молекул в более крупные частицы коллоидных размеров.
К микрогетерогенным системам относятся суспензии (дисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой), эмульсии (системы, состоящие из двух жидкостей, в которой вещества дисперсной фазы нерастворимы в дисперсионной среде), пены (высококонцентрированные дисперсные системы, в которых дисперсионная среда – жидкость, а дисперсная фаза – газ), аэрозоли и порошки (осажденные аэрозоли с твердыми частицами).
К молекулярным коллоидам относятся белки и полисахариды.
Все процессы разделения неоднородных систем по виду движущей силы относятся к механическим и гидромеханическим. Эффект разделения – это отношение количества компонента, выделенного из дисперсионной среды (Go), к начальному количеству в смеси (Gн):
Ер = (Go/Gн) 100% (45)
Процессы осаждения под действием силы тяжести
Процессы осаждения под действием силы тяжести применяются там, где система составлена из компонентов, плотность которых существенно различна. Эти способы используются для разделения грубых дисперсий и некоторых промышленных пылей. К этим процессам относится осаждение – отстаивание в поле гравитационных сил твердых частиц в жидкой среде в отстойниках различной конструкции и пылеосаждение в пылеосадительных камерах.
Остановиться на теории отстаивания. Рассмотрим вариант нахождения в воде твердых примесей (рис. 18). В начале в стакане с мутной водой примеси распространены равномерно (позиция 1 рис. 18), затем в стакане примеси образуют 4 зоны (позиция 2 рис. 18). Как видно из рисунка в течение времени появляются следующие зоны: 1 – зона осветления воды, П – зона свободного осаждения Ш – зона сгущенной суспензии (зона стеснения осаждения) – осаждение частиц происходит за счет выталкивания дисперсной средой воды, 1У – зона осадка. В последствие идет перераспределение материала по зонам, а в конце процесса (позиция 6 рис. 18) остается две зоны: 1 – зона осветления воды и 1У – зона осадка.
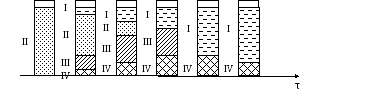
Рис. 18. Зависимость осаждения твердых частиц в воде от продолжительности протекания процесса
І – зона осветления воды, ІІ – зона свободного осаждения ІІІ – зона сгущенной суспензии (зона стеснения осаждения) – осаждение частиц происходит за счет выталкивания дисперсной средой воды, ІV – зона осадка.
Кинетика процесса осветления (отстаивания) характеризуется следующей кривой (рис. 19).
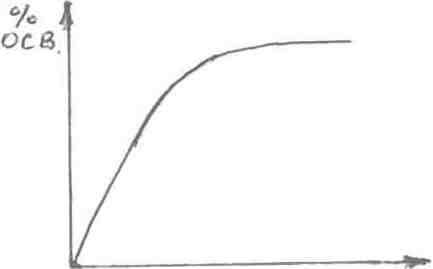
τ
Рис. 19. Кинетика процесса отстаивания твердых частиц в стакане
На основании приведенных данных можно сделать следующие выводы:
- скорость осветления непостоянна, она уменьшается с увеличением времени отстаивания;
- лимитирующей стадией является скорость стесненного осаждения (зона Ш);
- в производственных аппаратах образуются те же самые зоны, но они не изменяются по высоте.
Осаждение в поле центробежных сил
Также осаждение производится в поле центробежных сил. Этот способ применяют для разделения тонких суспензий и мутей, содержащих мелкие частицы, а также эмульсей. Для этих целей применяют центрифуги, циклоны и гидроциклоны.
Электростатическое осаждение
Для отделения пыли в газовых системах используют электростатическое поле, где осаждение происходит в результате взаимодействия частиц с ионизированным газом.
Фильтрование
Фильтрование – процесс разделения неоднородных систем за счет «просеивания» их через фильтрующую перегородку. Эти процессы используются для разделения в жидких и газовых системах. В качестве движущей силы здесь может использоваться сила тяжести (нутч-фильтр) или разность давлений по разные стороны фильтрующей перегородки (фильтр-прессы). Фильтрование можно осуществлять и в центробежном поле.
Существует два способа фильтрации:
1)Фильтрация через слой зернистой загрузки, 2) через фильтровальную перегородку
Первый способ фильтрации заключается в следующем: через слой зернистой загрузки пропускается вода, содержащая взвешенные частицы. При этом происходит отложение взвешенных частиц в порах фильтрующего материала и отложение на поверхности этого материала.
Механизм удержания взвешенных веществ: во-первых, это молекулярное взаимодействие (прилипание) и кулоновское (электрическое) взаимодействие. Эффект очистки взвешенных частиц определяется соотношением сил сцепления и отрыва от фильтрующего материала.
Коагуляция и флокуляция
В тех случаях, когда даже при длительном отстаивании не образуется зона осадка из-за малого объема присутствующих в воде частиц, используют коагуляцию или флокуляцию.
Коагуляция – это слипание частиц коллоидной системы при их столкновении в процессе теплового движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате коагуляции образуются агрегаты – более крупные (вторичные) частицы, состоящие из скопления мелких (первичных). Первичные частицы в таких агрегатах соединены силами межмолекулярного взаимодействия непосредственно или через прослойку окружающей дисперсной среды. Коагуляция сопровождается прогрессирующим укрупнением частиц и уменьшением общего их числа в объеме дисперсной среды. Слипание однородных частиц называется гомокоагуляцией, а разнородных – гетерокоагуляцией.
Производственные сточные воды в большинстве случаев представляют собой слабоконцентрированные эмульсии или суспензии, содержащие коллоидные частицы размером 0,001-0,1 мкм, мелкодисперсные частицы размером 0,1-10 мкм, а также частицы размером 10 мкм и более. В процессе механической очистки из сточных вод достаточно легко удаляются частицы размером 10 мкм и более, мелкодисперсные частицы и коллоидные практически не удаляются. Поэтому их надо укрупнять. Для этих целей применяют коагуляцию.
Известно, что коллоидные частицы, представляющие совокупность большого числа молекул вещества, содержащегося в сточной воде в диспергированном состоянии. Обладая большой удельной поверхностью, эти частицы удерживают покрывающий их слой воды и адсорбируют находящиеся в воде ионы преимущественно одного знака. Ионы, непосредственно прилегающие к ядру, образуют адсорбирующий слой. В связи с тем, что на границе адсорбционного слоя создается электрический заряд, вокруг гранулы (ядра с адсорбционным слоем) образуется диффузный слой, в котором находятся остальные противоположно заряженные ионы, компенсирующие заряд гранул. Гранула вместе диффузным слоем называется мицеллой. В связи с тем, что мы имеем дело с электрическими зарядами, то поле вокруг мицеллы характеризуется определенным потенциалом, который уменьшается к границе адсорбционного слоя. Потенциал на границе адсорбционного слоя называется электрохимическим потенциалом. Если потенциал системы становится менее 0,03 В, то силы взаимного (гравитационного) притяжения между частицами начинают преобладать над электрическим отталкиванием. При потенциале равном нулю коагуляция происходит с максимальной интенсивностью, состояние коллоидной системы в этом случае называется изоэлектрическим состоянием, а величина рН называется изоэлектрической точкой системы (рис. 20).
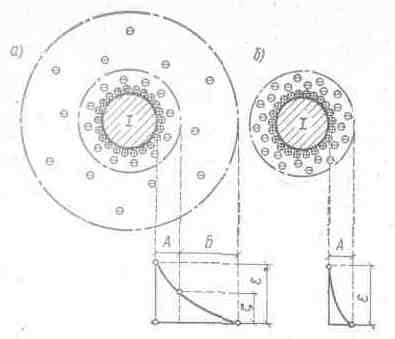
Рис. 20. Строение миацеллы и изменение ее напряженности электрического поля:
а – адсорбционный слой; б – диффузионный слой; І – ядро.
Одним из методов снижения потенциала коллоидной системы является увеличение концентрации в воде электролитов. Способность электролита вызывать коагуляцию возрастает с увеличением валентности коагулирующего иона, обладающего зарядом противоположным заряду коллоидных частиц. Соотношение коагулирующей способности 1:П:Ш(валентных ионов)= 1:30:1000.
Основным же процессом коагуляции является гетерокоагуляция – взаимодействие коллоидных и мелкодисперсных частиц с агрегатами, образующимися при введении в сточную воду коагулянтов. При коагуляции хлопья образуются сначала за счет взвешенных частиц и коагулянта. Образовавшиеся хлопья сорбируют вещества, загрязняющие сточные воды и, осаждаясь вместе с ними, очищают воду.
При использовании в качестве коагулянтов алюминия и железа в результате реакции гидролиза образуются малорастворимые в воде гидроксиды железа и алюминия, которые сорбируют на развитой хлопьевидной поверхности взвешенные, мелкодисперсные, коллоидные и растворенные вещества и при благоприятных гидродинамических условиях оседают на дно отстойника, образуя осадок
Al2(SO4)3 + 6H2O = 2Al(OH)3 + 3H2SO4
FeSO4 + 2H2O = Fe(OH)2 + 4H2SO4
Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Образующаяся в процессе гидролиза кислоту следует нейтрализовать известью или другими щелочами. Нейтрализация кислот может также протекать за счет щелочного резерва сточной жидкости, например,
H2SO4 + NaHCO3 = NaHSO4 + CO2 + H2O
Для очистки сточных вод применяют различные коагулянты, количество которых зависит от его вида, расхода, состава и требуемой очистки воды и определяется, как правило, экспериментально.
Однако коагуляция, идущая с применением неорганических коагулянтов, имеет ряд недостатков, к которым относятся: неуправляемость процесса и малая эффективность работы аппаратуры, связанная с медленным гидролизом коагулянтов и малой скоростью хлопьеобразования. Поэтому стали применять процесс флокуляции. Процесс этот открыт Анри в 1903 году.
Флокуляцией называется процесс, при котором мелкие частицы, находящиеся во взвешенном состоянии, под влиянием специально добавляемых неорганических и органических веществ – флокулянтов образуют интенсивно оседающие рыхлые хлопьевидные скопления.
Флокулянты – линейные органические полимеры с очень высокой молекулярной массой. Схема образования агрегата при флокуляции носит название мостиковая модель. Механизм флокуляции следующий: 1)закрепление концов макромолекул на поверхности частиц, 2)адсорбция сегментов молекул на вакантных участках частиц. Наиболее эффективно процесс идет, когда размеры частиц соизмеримы с размером молекул. В других случаях эффективность флокуляции уменьшается (рис. 21).

Рис. 21. Схема флокуляции
Флотация процесс молекулярного прилипания частиц флотируемого материала к поверхности раздела двух фаз, обычно газа (чаще воздуха) и жидкости, обусловленный избытком свободной энергии поверхностных пограничных слоев, а также поверхностными явлениями смачивания.
Процесс очистки сточных вод, содержащих ПАВ, нефть, нефтепродукты, масла, волокнистые материалы, методом флотации заключается в образовании комплексов «частицы-пузырьки», всплывании этих комплексов и удалении образовавшегося пенного слоя с поверхности обрабатываемой жидкости. Прилипание частицы к поверхности газового пузырька возможно только тогда, когда наблюдается несмачивание или плохое смачивание частицы жидкостью.
Смачивающая способность жидкости зависит от ее полярности, с возрастанием которой способность смачивать твердые тела уменьшается. Внешним проявлением способности жидкости к смачиванию является величина поверхностного натяжения ее на границе с газовой фазой, а также разность полярностей на границе жидкой и твердой фаз. Процесс флотации идет эффективно при поверхностном натяжении воды не более 60-65 мН/м. Степень смачиваемости водой твердых или газовых частиц, взвешенных в воде, характеризуется величиной краевого угла Θ (рис. 22).

Рис. 22. Условия смачиваемости и несмачиваемости твердых частиц

Рис. 23. Схема прилипания пузырька воздуха 1 к взвешенной в воде частице 2
Чем больше этот угол, тем более гидрофобна поверхность частицы, т.е. увеличивается вероятность прилипания к ней и прочность удержания на ее поверхности воздушных пузырьков. Такие частицы обладают малой смачиваемостью и легко флотируются. Большое значение при флотации имеет размер, количество и равномерность распределения воздушных пузырьков в сточной воде. Оптимальные размеры воздушных пузырьков 15-30 мкм, а максимальные – 100-200 мкм.
Также используются и другие методы очистки жидкостей и газов: промывные или мокрые способы очистки газов, абсорбционные, адсорбционные, каталитические и ряд других методов, которые будут рассмотрены позднее.
Лекция 8. Химические и биохимические процессы
План лекции:
1. Химические процессы.
2. Основные факторы, влияющие на химические процессы.
3. Сущность отдельных химических процессов и их роль в природоохранных технологиях.
4. Биохимические процессы.
