- •103 Лекция № 7 Урок как основная форма обучения химии
- •Виды уроков
- •Общие педагогические требования к уроку
- •Структура урока
- •I. Уроки изучения нового материала
- •II. Уроки формирования и совершенствования умений и навыков
- •III. Уроки обобщения и систематизации знаний
- •IV. Уроки контроля и коррекции знаний, умений и навыков
- •V. Проблемный урок
- •Лекция № 8 Методы проверки знаний и умений учащихся
- •Устная проверка знаний
- •Письменная проверка знаний
- •Тестовый контроль
- •Экзамен по химии
- •Критерии оценки знаний
- •Лекция № 9 Методические особенности изучения темы
- •Анализ темы
- •Методы и средства изучения темы
- •Формирование и развитие системы понятий "Химический элемент" в курсе химии средней школы
- •Методика формирования и развития системы понятий о химической реакции
- •Лекция № 11 Факультативные курсы и внеклассная работа по химии Факультативные занятия
- •Виды факультативных занятий
- •Особенности и значение внеурочной работы по химии
- •Основные принципы организации внеурочных занятий
- •Формы внеурочных занятий
- •Массовые формы
- •Лекция № 12 Организация и планирование учебного процесса в вуЗе
- •Лекция № 13 Информационные компоненты системы учебного процесса в высшей школе
- •Семинарские занятия
- •Лабораторные работы
- •Лекция № 14 Основы методики преподавания в высшей школе
- •Эвристические методы обучения
- •Методы проблемного обучения
- •Компоненты контроля в вуЗе
- •Показатели качества знаний
- •Выпускная квалификационная работа
- •Примерный перечень основных компетенций магистра химии
Методика формирования и развития системы понятий о химической реакции
В курсе химии средней школы четко различают 6 компонентов понятия "химическая реакция", которые рассматриваются в единстве и формируются постепенно:
1. Признаки сущности реакций.
2. Закономерности возникновения и протекания.
3. Количественные характеристики.
4. Классификация.
5. Практическое использование.
6. Методы исследования.
Химическая реакция должна характеризоваться с позиций всех шести блоков. Каждый из них имеет свою структуру.
Например, структура содержания понятий о классификации химических реакций имеет такой вид:
Классификация химических реакций
|
Принцип классификации |
Характеристика реакции |
Примеры реакций |
|
Исходное состояние реаги- |
Гомогенные |
2H2 + O2 = 2H2O |
|
рующей системы |
Гетерогенные |
CaO + CO2 = CaCO3 |
|
Наличие окислительно-восстановительного процесса |
Окисление-восстановление реакции |
Zn + HCl = ZnCl2 |
|
|
Реакции, в которых окислительно-восстановительный процесс отсутствует |
CaCO3 = CaO + CO2 |
|
Участие катализатора |
Каталитические. |
3H2 + N2 = 2NH3 |
|
|
Некаталитические |
NaOH + HCl = NaCl + H2O |
|
Обратимость реакции |
Обратимые |
SO2 + H2O H2SO3 |
|
|
Необратимые |
(NH4)2Cr2O7 = Cr2O3 + 4H2O + N2 |
|
Энергетический эффект |
Экзотермические |
2Mg + O2 = 2MgO + Q |
|
|
Эндотермические |
2HgO = 2Hg + O2 - Q |
|
Соотношение числа исход- |
Соединения |
CaO + H2O = Ca(OH)2 |
|
ных и полученных веществ |
Разложения |
HgO = Hg + 1/2 O2 |
|
|
Замещения |
Fe + CuCl2 = Cu + FeCl2 |
|
|
Обмена |
AgNO3 + HCl = AgCl + HNO3 |
|
Реакции, протекающие без изменения качественного |
Аллотропные превращения |
3O2 = 2O3 |
|
состава простых, сложных веществ |
Изомеризация |
|
Система понятий о сущности и признаках химической реакции может быть представлена двумя сторонами: внешние признаки и внутренние. Внешние признаки (цвет, газ, тепло, осадок) изучаются в теме "Первоначальные химические понятия".
Понятие о внутренней сущности реакций развивается постепенно, усложняясь от теории к теории.
Атомно-молекулярная теория, рассматривая сущность химической реакции, объясняет ее, как перегруппировку атомов.
Теория химической связи – как процесс разрыва одних связей и образования других.
Теория электролитической диссоциации – как взаимодействие ионов.
Закономерности протекания химических реакций выражены понятиями об скорости химической реакции, катализе, химическом равновесии.
Количественная сторона химической реакции отражается в расчетах на основе:
1) закона сохранения массы вещества при химических реакциях;
2) молярных отношений реагирующих веществ (массовых и объемных);
3) термохимических расчетов.
Развитие этих понятий выражено в постепенном усложнении расчетов.
Необходимым условием изучения химических реакций является демонстрационный и ученический эксперименты, практические работы.
При изучении химических реакций широко применяется самостоятельная работа, а также разнообразные наглядные средства обучения: химическое оборудование, таблицы, кинофильмы и др.
Лекция № 10
Методические особенности изучения
Периодического закона Д.И. Менделеева
Место темы в школьном курсе химии
и ее учебно-воспитательное значение
На тему "Периодический закон и периодическая система химических элементов" отводится 17-20 часов в программе 8 класса. Однако эта тема в учебно-методическом отношении является центральной не только в курсе химии 8 класса. Она важна для всего курса химии, так как создает предпосылки для изучения вещества, исходя из проблемы: строение – свойства.
К этой теме учащиеся возвращаются постоянно, рассматривая свойства веществ, исходя из положения соответствующих элементов в периодической системе.
Углубление знаний периодического закона осуществляется в 11 классе в курсе "Общая химия", где более полно рассматривается электронная структура атома, идет знакомство с d‑ и f‑элементами.
В 8 классе изучению Периодического закона предшествует ознакомление учащихся с понятием о естественных группах элементов на примере галогенов и щелочных металлов, а также с первыми попытками классификации веществ. Выясняются причины относительности классификации Берцелиуса (1808 г.), разделившего 20 известных в то время элементов на металлы и неметаллы. Вводится понятие об элементах, оксиды и гидроксиды которых проявляют амфотерные свойства, на примере соответствующих соединений цинка и алюминия. Рассказывается о практической необходимости классификации химических элементов, возникшей в 60-х годах XIX века, в связи с успехами в развитии химической науки и химической промышленности.
Учитывая уровень знаний учащихся 8 класса, на изучение параграфа "Периодический закон Д.И. Менделеева" рекомендуют отводить 2 урока. На первом уроке, после краткого повторения вопроса о первых попытках классификации химических элементов и сообщения цели урока, внимание учащихся обращается на факты (объективные условия), которые привели Д.И. Менделеева к гениальному открытию.
Первоначально в книге "Основы химии" он описал химию четырех элементов в порядке возрастания валентности: H(I), O(II), N(III), C(IV), то есть первоначально за основу изучения свойств элементов он взял валентность. Но впоследствии, так как многие элементы проявляют переменную валентность, он в основу классификации, как постоянную величину, взял атомную массу.
Структурировав известные в то время 63 элемента в сходные по химическим свойствам группы (щелочные металлы, галогены и т.д.), в порядке возрастания их атомных масс, сопоставляя эти группы в той же последовательности и внося некоторые изменения, Д.И. Менделеев и пришел к открытию Периодического закона химических элементов и построению периодической системы химических элементов.
Таким образом, открытию Периодического закона предшествовали следующие, накопившиеся у Д.И. Менделеева за период многолетних занятий химией данные:
1. Научные знания о физических и химических свойствах элементов и формах их соединений (оксидах, основаниях, кислотах).
2. Сопоставление свойств элементов в группах (галогены, щелочные металлы и др.).
3. Валентность элементов и ее изменения.
4. Связь свойств элементов с их атомной массой.
5. Предположения о зависимости свойств элементов от внутреннего строения атома.
Такое ознакомление учащихся с диалектикой процесса научного открытия показывает роль и необходимость знаний о предмете химии для объяснения закономерностей явлений природы, большую роль самого Д.И. Менделеева, проделавшего колоссальный труд и открывшего объективный закон природы, который, безусловно, существовал и до его открытия.
Вторая сторона цели урока состоит в том, чтобы создать проблемную ситуацию, разрешая которую, учащиеся становятся на путь исследователей.
Ход урока может быть представлен следующим образом:
Учитель: Воспользуемся нашими знаниями свойств водорода и кислорода, классов неорганических соединений, а также галогенов и щелочных металлов. Пойдем по пути Д.И. Менделеева. Расположим 18 химических элементов от водорода до аргона в порядке возрастания их атомных масс. Будем работать вместе. Причем запись сделаем в одну строку на двух листах тетради, с интервалами между химическими знаками для формул оксидов и гидроксидов.
Графы таблицы:
- порядковый номер элемента;
- химический знак (символ химического элемента);
- относительная атомная масса;
- высшая валентность по кислороду (заполняется в форме беседы);
- формула оксида (обращается внимание на составление формул бинарных соединений по валентности элементов, устанавливается характер оксида);
- формула гидроксида;
- характер гидроксида.
Последние две графы, как и предыдущие, заполняются в ходе беседы (оставляется место для графика).
Например, Учитель: Расскажите о натрии.
Ученик: Натрий одновалентный щелочной металл. Его оксид Na2O. Это основной оксид. Его гидроксид NaOH – щелочь.
В процессе такой аналитико-синтетической работы с учащимися закрепляются их знания о свойствах основных, кислотных и амфотерных оксидов и соответствующих гидроксидов. Под руководством учителя заполняются две последние графы – "формула летучего водородного соединения" и "валентность по водороду". Первый урок на этом заканчивается.
На втором уроке по данной теме используется составленная на первом уроке таблица и производится анализ изменений свойств элементов и форм их соединений с тем, чтобы на этой основе подойти к пониманию явлений периодической изменяемости и к выводу Периодического закона. Здесь учитель использует эксперимент и условное графическое изображение изменения валентности, металлических и неметаллических свойств элементов и форм их соединений.
Если все уроки проводятся в химическом кабинете, целесообразно до урока воспроизвести таблицу на доске. При ее разборе удобны цветные мелки (учащиеся работают цветными карандашами). После краткой беседы по материалу первого урока следует выяснить усвоение учащимися следующих вопросов:
1. Что явилось причиной поисков естественнонаучной классификации элементов?
2. Какие научные данные привели Д.И. Менделеева к открытию Периодического закона?
3. В какой последовательности на прошлом уроке мы располагали 18 химических элементов?
4. Что отражено в составленной нами таблице?
Затем сообщается цель урока и с помощью химического эксперимента и аналогии исследуется составленная таблица.
Отмечается закономерная повторяемость (вывод делают учащиеся):
- возрастание высшей валентности по кислороду;
- уменьшение основных и нарастание кислотных свойств;
- возрастание, а затем уменьшение валентности по водороду;
- ослабление металлических свойств;
- усиление неметаллических свойств.
Все эти зависимости графически отображают учащиеся в тетради, а учитель на доске. Для демонстрации ослабления металлических свойств используют опыты взаимодействия Na, Mg, и Al c H2O, а для подтверждения возрастания неметаллических свойств проводят опыты соответствующих кислот цинком. Берут H2SiO3, H3PO4 и H2SO4 и по интенсивности их взаимодействия с Zn делают вывод об увеличении силы кислот в этом ряду.
После того, как все зависимости отражены графически, учителю необходимо добиться от учащихся осмысливания слова "периодичность". Желательно, чтобы учащиеся сами назвали это слово. Сделать это можно на примере разбора повторяемости таких явлений, как смена суток, времени года и т.д. Затем вновь внимание обращается на условие составления таблицы, и учащиеся таким образом подводятся к самостоятельному выводу: если расположить химические элементы в порядке возрастания их атомных масс, обнаруживается, что свойства простых веществ и форм их соединений периодически повторяются. Учитель подчеркивает, что к этому выводу в результате многолетних раздумий и экспериментальной работы 1 марта 1869 года пришел Д.И. Менделеев и назвал его Периодическим законом. Дается точная формулировка закона, отмечается, что этот закон существовал в природе и существует независимо от нашего сознания.
На заключительной части урока проводится обобщающая беседа по двум урокам. Внимание учащихся фиксируется на тех свойствах элементов и формах их соединений, которые позволяют осмыслить суть периодичности.
При последующем ознакомлении со структурой Периодической системы элементов, как графического отображения Периодического закона Д.И. Менделеева, учащиеся встречаются с противоречием места элемента в Периодической системе. Известно, что указанное противоречие явилось причиной поиска сложной структуры атома. Таким образом, осуществляется подход к изучению строения атома и пониманию физического смысла Периодического закона на последующих уроках.
Завершая изучение Периодического закона, учащиеся очень твердо должны:
1. Знать его формулировку и физический смысл.
2. Уметь пользоваться периодической системой и законом для объяснения свойств веществ.
3. Уметь характеризовать строение атома и химическую связь, исходя из положения элемента в периодической системе.
4. Уметь объяснять периодические изменения металлических и неметаллических свойств, кислотных и основных свойств, окислительных и восстановительных свойств.
В тему "Периодический закон и периодическая система" включен вопрос "Жизнь и научная деятельность Д.И. Менделеева". При рассмотрении этого вопроса материал надо подобрать таким образом, чтобы не просто сообщить биографические данные, но и показать пример человека, достойного подражания: большую трудоспособность Д.И. Менделеева, его самоотверженность и энтузиазм в работе, преданность России и др.
Методические особенности изучения основ курса органической химии
I. Цели, задачи и значение органической химии в школьном курсе
Значение данного предмета, прежде всего, определяется характером самой науки.
1. Органическая химия дает представление о веществах, составляющих организмы растений, животных, человека.
Таким образом, органическая химия устанавливает связь между живой и неживой природой, позволяет понять процессы, лежащие в основе развития живой природы.
2. Вторая познавательная роль органической химии состоит в том, что она не только объясняет природу, но и помогает человеку управлять химическими процессами и на этой основе создавать промышленное производство нужных веществ и материалов. Учащиеся знакомятся с производством ряда материалов органического происхождения.
3. Содержание курса органической химии открывает широкие возможности и для умственного развития учащихся. Изучение органической химии в большей степени строится на работе мысли учащихся, нежели на работе памяти.
Учащиеся должны постоянно представлять себе непосредственно не наблюдаемые явления, например, строения молекулы, что, несомненно, требует известного напряжения мысли.
4. Продолжается формирование представлений о методах современного научного исследования на примере органической химии.
II. Содержание и построение курса органической химии в средней школе
Исходя из первой задачи, которая стоит перед органической химией, необходимо подвести учащихся к пониманию роли органических веществ в жизни организмов. Таким образом, в программу курса должны войти белки, жиры, углеводы. Изучение других классов соединений должно подвести к пониманию этих биологически важных соединений.
Для изучения белков необходимо знать аминокислоты, как их структурные элементы, в свою очередь к аминокислотам можно подойти после рассмотрения аминов и карбоновых кислот, к знанию кислот – от альдегидов.
Можно установить следующую генетическую связь органических соединений:
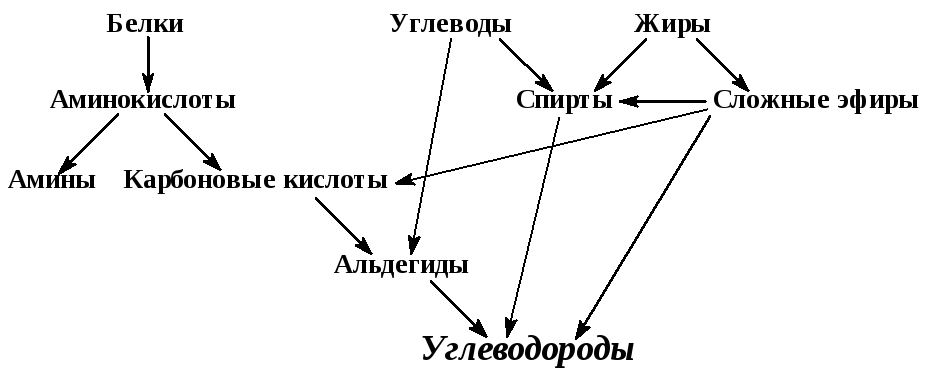
Изучение всех классов соединений требует, в конечном счете, знания углеводородов.
В тесной связи с отбором классов соединений находится отбор веществ для их характеристики. Здесь два критерия - теоретическийипрактический.
Теоретическийкритерийзаключается в том, что отбираются те вещества, на примере которых можно убедительно показать характерное строение соединений данного ряда, их типичные химические свойства и генетическую связь с другими классами.
Практический критерийпредусматривает показ учащимся на примере отобранных веществ значения органической химии в производстве, повседневной жизни, быту.
Органические вещества, отбираемые для изучения должны, таким образом:
а) характеризовать вид химической связи или функциональную группу;
б) отражать типичные химические свойства класса;
в) отражать генетические связи с другими классами;
г) быть основой для суждения о важнейших областях применения соединений данного класса.
Принцип изучения тот же, что и в неорганической химии: строение – свойства.Теоретическая основа –Теория А.М. Бутлерова.
План изучения каждого класса:
- Гомологический ряд;
- Номенклатура;
- Строение, изомерия, функциональная группа;
- Физические и химические свойства;
- Нахождение в природе;
- Получение;
- Применение.
Практическое значение органической химии рассматривается на некоторых примерах органического синтеза (производство полиэтилена, каучука, капронового волокна, переработка целлюлозы), а также на примере переработки горючих ископаемых (перегонка нефти, крекинг нефтепродуктов, получение ацетилена и метана, как одно из направлений химической переработки природного газа и некоторое другое).