
- •Федеральное агентство по образованию рф
- •Введение
- •Литературный обзор
- •2.1 Исторический обзор
- •Пиразин. Общая характеристика
- •Нахождение в природе
- •2.4 Получение пиразинов
- •Строение пиразина и его производных
- •Химические свойства пиразина.
- •Электрофильное Замещение
- •Нуклеофильное замещение
- •Реакция с радикалами.
- •Металлирование галогендиазинов
- •Реакционноспособность заместителей боковой цепи
- •Окисление
- •Восстановление.
- •Производные пиразина
- •Аминопиразины.
- •Гидрированные пиразины.
- •Метилпиразины.
- •3. Обсуждение результатов
- •3.1 Синтез 1-[3-замещенных пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •3.1.1. Хлорирование 2-хлорпиразина сульфурилхлоридом
- •3.1.2. Синтез 2-хлор-3-(замещенных)пиразинов
- •3.1.3. Использование каталитической системы kf/Al2o3 для активации атома хлора в реакциях нуклеофильного замещения
- •Ямр 1н спектр 1-[3-(м-толилтио)пиразин-2-ил]-пиперидин-3-карбоновой кислоты
- •3.2. Амиды 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •3.2.1. Синтез карбамидных производных
- •3.2.2. Анализ спектров ямр 1н высокого разрешения амидов 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •3.2.3. Анализ спектров ямр 1н высокого разрешения амидов 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •Ямр1н спектр 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-3-хлор-бензиламида
- •Ямр1н спектр 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-3-хлор-бензиламида (ароматическая зона)
- •4. Экспериментальная часть
- •4.1.5. Методика получения 2-хлор-3-(замещенного)пиразина
- •4.1.6. Методика получения 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •4.2. Общая методика получения амидов 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •4.3. Физико-химические методы исследований
- •6. Список литературы
- •Приложение
- •Данные спектров 1н ямр производных 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоновой кислоты в дмсо-d6, δ (м. Д.), j (Гц)
- •В дмсо-d6, δ (м. Д.), j (Гц)
- •Физико-химические свойства исследуемых веществ
- •Физико-химические свойства исследуемых веществ
4.1.6. Методика получения 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот
Смесь 0.1 моль 3, 0.1 моль этилового эфира пиперидин-3-карбоновой кислоты, 0.11 мольKOH, 10 гKF/Al2O3, 0.01 моль 18-краун-6 в 100 мл ДМСО перемешивали 24 час при температуре 100°С. К фильтрату после отделения осадка неорганических солей прибавляли раствор 0.25 моль КОН в 250 мл воды и перемешивали 2 час при 80-90°С. Раствор отфильтровывали, фильтрат нейтрализовали конц.HClи оставляли на ночь для кристаллизации. Выпавший осадок промывали водой и высушивали.
Спектр ЯМР 1Н,, м.д. (J, Гц): 12.20 с (1H, СООН); 7.96 д (1Н, Н6,3J= 2.7), 7.86 д (1Н, Н5,3J=2.7); 7.29 т (2Н, Н5’,6’, 3J=3.55), 7.26 с (1Н, Н2’), 7.23 м (1Н, Н4’), 2.35 с (3H,CH3), 3.82 д (1H,He2”,3J= 12,8); 3.62 д (1H,He6”,3J= 12,8); 2.96 т (1Н,Ha2”,3J=11.5); 2.85 т (1H,Ha6”,3J= 10.75), 2.08 м (1H,He4”), 1.70 м (1Н,Ha4”), 1.85 м (1H,He5”), 1.60 м (1H,Ha5”), метиновый протон при атоме С-3 наблюдается в виде мультиплета при δ 2.60 м.д..
4.2. Общая методика получения амидов 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот.
К раствору 1 моль 4в абсолютном ДМФА добавляли 1.1 моль КДИ (1,1′-N,N′-карбонилдиимидазола). Реакционную смесь перемешивали на магнитной мешалке при температуре 40–500С в течение 1.5 часов. По окончании первой стадии реакции (после прекращения выделения углекислого газа) к образовавшемуся имидазолиду добавляли 0.7 моль амина при температуре 50–600С. Через 8 – 10 часов выделяли целевые продукты высаждением 10%-ным растворомNa2CO3. Образовавшиеся осадки отфильтровывали и очищали перекристаллизацией из пропанола-2.
1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-3-хлор-бензиламид
В ыход
60,7 %. Т.пл. 166-167С.
Rf= 0.37. Спектр ЯМР1Н,,
м.д. (J, Гц): 8,41 т (1H,
NH,3J= 5.6),
7,97 д (1Н, Н6,
3J= 2.6),
7.86 д (1Н, Н5,3J=2.5); 7.46 м (2Н, Н2’,6’);
7.43 т (2Н, Н3’,5’, 3J= 3.2); 3.73 м (2H,He2”,6”),
2.94 т (1Н, Ha2”,
11,7); 2.78 т (1H,Ha6”,3J= 11.6); 1.97 д (1H,He4”,3J= 12.2);
1,71 м (1Н, Ha4”);
1.85 д (1H,He5”,3J= 12.0), 1.65 м (1H,Ha5”);
2.62 м (1H,H3”);
7.31 т (1Н,
H5*,
3J= 7.8 ),
7.26 шс (1Н, Н2*),
7.24 д (1Н, Н4*,3J=7.6); 7.20 д (1Н, Н6*,3J=7.6);
4.27 д, (2Н, СН2N,3J
=5,5)
ыход
60,7 %. Т.пл. 166-167С.
Rf= 0.37. Спектр ЯМР1Н,,
м.д. (J, Гц): 8,41 т (1H,
NH,3J= 5.6),
7,97 д (1Н, Н6,
3J= 2.6),
7.86 д (1Н, Н5,3J=2.5); 7.46 м (2Н, Н2’,6’);
7.43 т (2Н, Н3’,5’, 3J= 3.2); 3.73 м (2H,He2”,6”),
2.94 т (1Н, Ha2”,
11,7); 2.78 т (1H,Ha6”,3J= 11.6); 1.97 д (1H,He4”,3J= 12.2);
1,71 м (1Н, Ha4”);
1.85 д (1H,He5”,3J= 12.0), 1.65 м (1H,Ha5”);
2.62 м (1H,H3”);
7.31 т (1Н,
H5*,
3J= 7.8 ),
7.26 шс (1Н, Н2*),
7.24 д (1Н, Н4*,3J=7.6); 7.20 д (1Н, Н6*,3J=7.6);
4.27 д, (2Н, СН2N,3J
=5,5)
1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-циклогептиламид.
Выход 68%. Т.пл. 154-155С. Rf= 0.82. Спектр ЯМР1Н,, м.д. (J, Гц): 7.67 д (1H, NH,3J= 8.1); 7.97 д (1Н, Н6,3J= 2.4); 7.86 д (1Н, Н5,3J=2.5); 7.47 м (2Н, Н2’,6’); 7.46 м (2Н, Н3’,5’); 3.73 м (2H,He2”,6”); 2,93 т (1Н,Ha2”, 11.3); 2.77 м (1H,Ha6”); 1.90 м (1H,He4”); 1.70 м (1Н,Ha4”); 1.83 м (1H,He5”); 1.63 м (1H,Ha5”); 2.50 м (1H,H3”); 3.72 д, (1Н, Н1*,3J=12,5); 1.89 м (2Н, Не2*7*); 1.82 м (2Н, На2*7*); 1.73 м (2Н, Не3*6*); 1.85 м (2Н, На3*6*); 1.86 м (4Н, На4*5*).

1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-(фуран-2-ил-метил)амид.
Выход 63,6%. Т.пл. 160-161С.Rf= 0.82. Спектр ЯМР1Н,, м.д. (J, Гц): 8.30 т (1H, NH, 3J= 5.6); 7.97 дд (1Н, Н6), 7.86 дд (1Н, Н5); 7.48 м (2Н, Н2’,6’); 7.43 т (2Н, Н3’,5’,3J= 3,0); 3.72 м (2H,He2”,6”); 2.93 т (1Н,Ha2”,3J= 11,8); 2.76 т (1H,Ha6”,3J=11,8); 1.97 д (1H,He4”,3J= 12.0); 1.72 м (1Н,Ha4”); 1.82 д (1H,He5”,3J= 12.0); 1.62 м (1H,Ha5”); 2.60 м (1H,H3”); 7.46 м (1Н, Н3*); 6.34 шс (1Н, Н4*); 6.19 д (1Н, Н5*,3J=3,2); 4.27 д (2Н, СН2N,3J = 5,6).

1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-(4-метоксибензил)амид.
Выход 57%. Т.пл. 167-1680С. Rf= 0.83. Спектр ЯМР1Н,, м.д. (J, Гц): 8.26 т (1H, NH,3J=6,0); 7.97 д (1Н, Н6,3J= 2.4); 7.86 д (1Н, Н5,3J=2.4); 7.47 м (2Н, Н2’,6’); 7.45 м (2Н, Н3’,5’); 3.71 шс (2H,He2”,6”); 3.94 т (1Н,Ha2”, 3J= 11.5); 2.78 т (1H,Ha6”,3J = 11.6); 1.94 д (1H,He4”,3J= 12.0); 1.70 м (1Н,Ha4”); 1.83 д (1H,He5”,3J= 12.2); 1.64 м (1H,Ha5”); 2.60 м (1H,H3”); 7.16 д (2Н, Н2*,6*,3J=8.0); 6.83 д (2Н, Н3*,5*,3J =8.3); 4.21 д (2Н, СН2N,3J=6.1); 3.73 с (3Н, СН3).

1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-(3,4,5-триметоксифенил) амид.
Выход 64% Т.пл.160-1610С.Rf= 0.82. Спектр ЯМР1Н,, м.д. (J, Гц): 9.82 с (1H, NH), 7.98 д (1Н, Н6, 3J= 2.7 ), 7.88 д (1Н, Н5,3J= 2.7), 7.46 м (2Н, Н2’,6’), 7.43 т (2Н, Н3’,5’,3J= 3.0), 3.77 шс (2H, He2”,6”), 3.00 т (1Н,Ha2”, 3J=11.6), 2.79 м (1Н, На6”), 2.0 д (1H,He4”,3J= 12.0), 1.73 м (1Н,Ha4”), 1.86 м (1H,He5”), 1.68 м (1H,Ha5”), 2.73 м (1H,H3”), 6.98 с (2Н, Н2*,6*); 3.75 с (6Н, Н3*,5*OCH3); 3.62 с (3Н, Н4*OCH3).

1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо –циклопропиламид.
Выход 68% Т.пл. 151-1520С. Rf= 0.93. Спектр ЯМР1Н,, м.д. (J, Гц): 7.84 шс (1H, NH), 7.96 д (1Н, Н6,3J= 2,4), 7.86 д (1Н, Н5,3J=2.5), 7.47 м (2Н, Н2’,6’), 7.46 т (2Н, Н3’,5’,3J= 3.2), 3.73 кв (2H,He2”,6”), 2.90 т (1Н, Ha2”,3J=11.6), 2.78 т (1H,Ha6” ,3J=11.5), 1.90 д (1H,He4”,3J= 12.0), 1.70 м (1Н,Ha4”), 1.83 д (1H,He5”,3J= 12.2), 1.61 м (1H,Ha5”), 2.63 м (1H,H3”), 2.46 м (1Н, Н1*); 0.61 дд (2Н, Не2*,3*3J=7,0;4J=2,0); 0.40м (2Н, На2*,3*).

1-[3-(фенилтио)пиразин-2-ил]-пиперидин- 3-карбоксо –(тетрагидрофуран – 2 – ил – метил)-амид
Выход 58%. Т.пл. 146-1470С.Rf= 0.83. Спектр ЯМР1Н,, м.д. (J, Гц): 7.89 шд (1H, NH,3J= 5.4), 7.97 д (1Н, Н6,3J= 2.4), 7.86 д (1Н, Н5,3J=2.4), 7.47 м (2Н, Н2’,6’), 7.46 т (2Н, Н3’,5’,3J= 3.2), 3.14 т (2H,He2”,6”,3J= 6.0), 2.92 т (1Н,Ha2”,3J= 11.7), 2,78 т (1H,Ha6”,3J= 11.5), 1.90 д (1H,He4”,3J= 12.0), 1.62 м (1Н,Ha4”), 1.83 д (1H,He5”,3J= 12.2), 1.53 м (1H,Ha5”), 2.60 м (1H,H3”), 3.83 т (1Н, Н2*,3J = 6,0), 3.80 т (2Н, Н5*,3J = 7,1); 3.72м (2Н, СН2N); 1.93м (1Н, Не3*), 1.72м (1Н, На3*), 1.91 м (2Н, Н4*).

1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо -пентиламид
Выход 62%. Т.пл. 150-1510СRf= 0.92. Спектр ЯМР1Н,, м.д. (J, Гц): 7.73 т (1H, NH,3J= 5.65), 7.87 д (1Н, Н6,3J= 2.5), 7.86 д (1Н, Н5,3J= 2.5), 7.46 м (2Н, Н2’,6’), 7.43 м (2Н, Н3’,5’), 3.70 т (2H,He2”,6”,3J=12.6), 3.02 кв (1Н,Ha2”), 2.88 т (1H,Ha6”,3J= 11.6), 1.90 м (1H,He4”), 1.72 м (1Н,Ha4”), 1.82 м (1H,He5”), 1.60 м (1H,Ha5”), 2.76 т (1H,H3”,3J= 11.2), 3.04 м (2Н, Н1*), 1.41 м (2Н, Н2*), 1.29 м (4Н, Н3*4*), 0.89 т (3Н СН3 , 3J= 6.9).

1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо –(3-метоксибензил)-амид.
Выход 68%. Т.пл. 148-1490С. Rf= 0.88 Спектр ЯМР1Н,, м.д. (J, Гц): 8.34 т (1H, NH,3J= 6.35), 7.96 д (1Н, Н6,3J=2.7), 7.86 д (1Н, Н5 ,3J=2.7), 7.46 м (2Н, Н2’,6’), 7.43 т (2Н, Н3’,5’,3J= 3.15), 3.76 шс (2H,He2”,6”), 2.93 т (1Н,Ha2”, 11.5), 2.78 т (1H,Ha6”,3J= 11.6), 1.99 д (1H,He4”,3J= 12.2), 1.72 м (1Н,Ha4”), 1.84 д (1H,He5”,3J= 12.0), 1.68 м (1H,Ha5”), 2.62 м (1H,H3”), 7.19 т (1Н, Н5*,3J = 8.0), 6.81 шс (1Н, Н2*), 6.79 д (1Н, Н4*,3J = 2.7), 6.77 д (1Н, Н6*,3J = 8.3), 4.26 д (2Н, СН2N,3J=5.9), 3.74c(3H,OCH3).

1-[3-(фенилтио)пиразин-2-ил]-пиперидин- 3-карбоксо – (пиперидин- п- 1,3-диоксолан)амид.
Выход 66%. Т.пл. 124-1250С.Rf= 0.22. Спектр ЯМР1Н,, м.д. (J, Гц): 7.96 д (1Н, Н6,3J= 2.6), 7.86 д (1Н, Н5,3J=2.6), 7.46 м (2Н, Н2’,6’), 7.43 м (2Н, Н3’,5’), 3.70 м (2H,He2”,6”), 3.01 м (1Н,Ha2”), 2.86 м (1H,Ha6”), 1.89 м (1H,He4”,), 1.70 м (1Н,Ha4”), 1.80 м (1H,He5”), 1.63 м (1H,Ha5”), 2.82 м (1H,H3”), 3.92с (4Н, Н5*6*), 3.70 м (4Н, Н2*9*), 1.69 м (4Н, Н3*8*)

1-[3-(м-толлилтио)пиразин-2-ил]-пиперидин- 3 -карбоксо- N - 3 –хлор-бензиламид
Выход 67% Т.пл. 129-1300С.Rf= 0.85. Спектр ЯМР1Н,, м.д. (J, Гц): 8.41 т (1H, NH,3J= 5.65), 7.96 д (1Н, Н6 , 3J=2.6), 7.86 д (1Н, Н5, 3J=2.6), 7.32 т (2Н, Н5’,3J=7.5), 7.28 с (2Н, Н2’), 7.26 д (1Н, Н4’, 3J=9.0), 7.21 д (1Н, Н6’, 3J=8.2), 2.35 с (3H,CH3), 3.76 т (2H,He2”,6” , 3J= 10.05), 2.94 т (1Н,Ha2”,3J= 11.7), 2.78 т (1H,Ha6”,3J= 11.15), 2,00 д (1H,He4”,3J= 11.1), 1.71 м (1Н,Ha4”), 1.84 д (1H,He5”,3J= 12,4), 1.68 м (1H,Ha5”), 2.63 м (1H,H3”), 7.32 м (2Н, Н4*5*), 7.30 м (1Н, Н2*), 7.20 м (1Н, Н6*), 4.28 д (2Н, СН2N, 3J=5.7)

1-[3-(м-толлилтио)пиразин-2-ил]-пиперидин- 3-карбоксо- N –(пиридин – 3 – илметил)амид
Выход 67% Т.пл. 132-1330С.Rf= 0.83. Спектр ЯМР1Н,, м.д. (J, Гц): 7.63 д (1H, NH,3J= 7.7), 7.95 д (1Н, Н6 , 3J=2.7), 7.85 д (1Н, Н5, 3J=2,4), 7.30 т (2Н, Н5’,3J=7.5), 7.28 с (2Н, Н2’), 7.26 д (1Н, Н4’, 3J=9,0), 7.21 д (1Н, Н6’, 3J=8,2), 2.35 с (3H,CH3), 4.30 кв (2H,He2”,6” ), 2.94 т (1Н,Ha2”,3J= 11.85), 2.77 т (1H,Ha6”,3J= 10.85), 1.96 д (1H,He4”,3J= 12.4), 1.73, м (1Н,Ha4”), 1.83, д (1H,He5”,3J= 12.8), 1.64 м (1H,Ha5”), 2.61 м (1H,H3”), 8,45 д ( 3J=1.6, 1Н, Н2*), 8.41 м (2Н, Н4*6*), 7.23 м (1Н, Н5*), 3.74 д (2Н, СН2N)
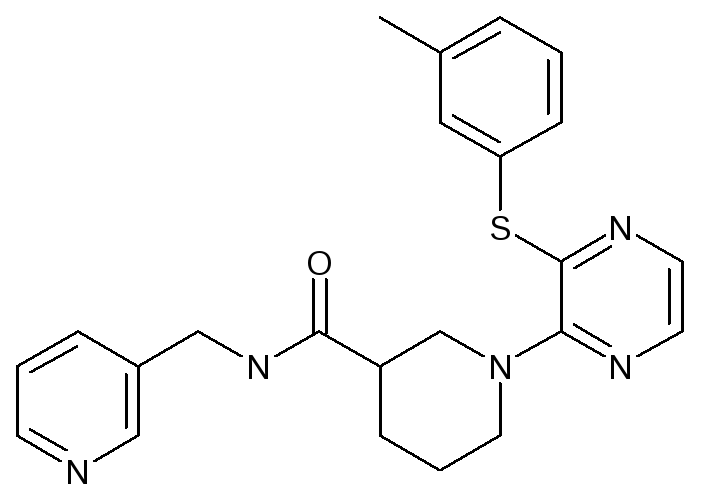
1-[3-(м-толлилтио)пиразин-2-ил]-пиперидин-3-карбоксо- N – циклогептиламид
Выход 56% Т.пл. 162-1630С.Rf= 0.82. Спектр ЯМР1Н,, м.д. (J, Гц): 7.64 д (1H, NH,3J= 7.7), 7.96 д (1Н, Н6 , 3J=2.6), 7.85 д (1Н, Н5, 3J=2.6), 7.30 т (2Н, Н5’,3J=7.4), 7.28 с (2Н, Н2’), 7.26 д (1Н, Н4’, 3J=9.3), 7.23 д (1Н, Н6’, 3J=8.2), 2.35 с (3H,CH3), 3.72 кв (2H,He2”,6” ), 2.90 т (1Н,Ha2”,3J= 11.85), 2.74 т (1H,Ha6”,3J= 11.15), 1.90 м (1H,He4”), 1.73 м (1Н,Ha4”), 1.80 м (1H,He5”) 1,70 м (1H,Ha5”), 2.52 м (1H,H3”), 3.72 м (1Н, Н1*), 1.58 т (10,05 4Н, Н2*7*), 1.51 м (4Н, Н3*Н6*), 1.41 м (4Н, Н4*5*).

1-[3-(м-толлилтио)пиразин-2-ил]-пиперидин - 3-карбоксо- N – циклопентиламид
Выход 70% Т.пл. 123-1240С.Rf= 0.88. Спектр ЯМР1Н,, м.д. (J, Гц): 7.69 д (1H, NH,3J= 7.3), 7.95 д (1Н, Н6 , 3J=2.7), 7.85 д (1Н, Н5, 3J=2.6), 7.30 т (2Н, Н5’,3J=7.4), 7.28 с (2Н, Н2’), 7.26 д (1Н, Н4’, 3J=9.0), 7.21 д (1Н, Н6’, 3J=8.2), 2.35 шс (3H,CH3), 3.73 кв (2H,He2”,6” ), 2.90 т (1Н,Ha2”,3J= 11.85), 2.74 т (1H,Ha6”,3J= 11.4), 1.91 д (1H,He4”,3J= 11.5), 1.68 м (1Н,Ha4”), 1.82 м (1H,He5”), 1.52 м (1H,Ha5”), 2.50 м (1H,H3”), 3.99 кв (1Н, Н1*), 1.80 м (2Н, Не2*5*), 1.65 м (2Н, На2*5*), 1.51 м (2Н, Не3*, Не4*), 1.38 кв (2Н, На3*, На4*).

1-[3-(м-толлилтио)пиразин-2-ил]-пиперидин- 3-карбоксо- N – (3-фенилпропиламид)
Выход 63% Т.пл. 123-1240С.Rf= 0.82. Спектр ЯМР1Н,, м.д. (J, Гц): 7.81 т (1H, NH,3J= 5.4), 7.96 д (1Н, Н6 , 3J=2.4), 7.85 д (1Н, Н5, 3J=2.4), 7.35 т (2Н, Н5’,3J=7.5), 7.28 с (2Н, Н2’), 7.26 д (1Н, Н4’, 3J=9.0), 7.23 д (1Н, Н6’, 3J=8.1), 2.35 с (3H,CH3), 3.11 кв (2H,He2”,6” ), 2.91 т (1Н,Ha2”,3J= 11.80), 2.77 т (1H,Ha6”,3J= 11.2), 1.95 д (1H,He4”,3J= 11.3), 1.70 м (1Н,Ha4”), 1.82 д (1H,He5”,3J= 12.4), 1.63 м (1H,Ha5”), 2.55 м (1H,H3”), 7.30 д (3J=6.9, 2Н, Н3*5*), 7.25 м (2Н, Н2*6*), 7.24 м (1Н, Н4*), 3.72 м (2Н, СН2N), 2.59 т (3J=7,85, 2Н, СН23*), 1.72 т (2Н,3J=7.5, СН22*)

1-[3-(м-толлилтио)пиразин-2-ил]-пиперидин-3-карбоксо- N – (3-метоксибензил)амид
Выход 64% Т.пл. 114-1150С.Rf= 0.83. Спектр ЯМР1Н,, м.д. (J, Гц): 8.31 т (1H, NH,3J= 6.0), 7.96 д (1Н, Н6 , 3J=2.4), 7.85 д (1Н, Н5, 3J=2.4), 7.30 т (2Н, Н5’,3J=7.4), 7.28 с (2Н, Н2’), 7.26 д (1Н, Н4’, 3J=9.3), 7.23 д (1Н, Н6’, 3J=8.2), 2.35 с (3H,CH3), 3.75 шс (2H,He2”,6” ), 2.95 т (1Н,Ha2”,3J= 11.85), 2.77 т (1H,Ha6”,3J= 11.4), 1.97 д (1H,He4”,3J= 11.5), 1.74 м (1Н,Ha4”), 1.84 д (1H,He5”,3J= 12.1), 1.68 м (1H,Ha5”), 2.62 м (1H,H3”), 7.30 м (1Н, Н5*), 6.81 шс (1Н, Н6*), 6.79 д (1Н,3J=2.9, Н4*), 6.76 д (1Н,3J=8.4, Н2*), 4.26 д (2Н,3J=5.9, СН2N), 3.75 шс -ОСН3

1-[3-(м-толлилтио)пиразин-2-ил]-пиперидин-3-карбоксо- N – (бензо[d][1,3] диоксол – 5 –илметил)амид
Выход 69% Т.пл. 149-1500С.Rf= 0.82. Спектр ЯМР1Н,, м.д. (J, Гц): 8.27 т (1H, NH,3J= 5.85), 7.96 д (1Н, Н6 , 3J=2.7), 7.85 д (1Н, Н5, 3J=2.5), 7.32 т (2Н, Н5’,3J=7.3), 7.28 с (2Н, Н2’), 7.26 д (1Н, Н4’, 3J=10.0), 7.23 д (1Н, Н6’, 3J=8.0), 2.35 с (3H,CH3), 3.73 д (2H,He2”,6” ,3J= 11.5), 2.93 т (1Н,Ha2”,3J= 11.86), 2.77 т (1H,Ha6”,3J= 11.15), 1.95 д (1H,He4”,3J= 11.9), 1.71 м (1Н,Ha4”), 1.83 д (1H,He5”,3J= 12.1), 1.68 м (1H,Ha5”), 2.59 м (1H,H3”), 6.77 д (2Н,3J= 8.2, Н2*3*), 6.71 д (1Н,3J=8.1 Н9*), 5.94 с (2Н, Н6*), 4.18 д (3J= 6.2 СН2).

1-[3-(м-толлилтио)пиразин-2-ил]-пиперидин-3-карбоксо- N – циклопропиламид
Выход 62% Т.пл. 148-1490С.Rf= 0.88. Спектр ЯМР1Н,, м.д. (J, Гц): 7.82 д (1H, NH,3J= 3.8), 7.95 д (1Н, Н6 , 3J=2.5), 7.85 д (1Н, Н5, 3J=2.7), 7.30 т (2Н, Н5’,3J=7.4), 7.29 с (2Н, Н2’), 7.26 д (1Н, Н4’, 3J=10.4), 7.21 д (1Н, Н6’, 3J=8.2), 2.35 с (3H,CH3), 3.70 кв (2H,He2”,6”), 2.88 т (1Н,Ha2”,3J= 11.75), 2.74 т (1H,Ha6”,3J= 11.35), 1.90 д (1H,He4”,3J= 11.1), 1.70 м (1Н,Ha4”), 1.83 д (1H,He5”,3J= 12.3), 1.60 м (1H,Ha5”), 2.62 м (1H,H3”), 2.45 м (1Н, Н1*), 0.61 м, (2Н, Н2*), 0,41 д (2Н, 3J=2,7, Н3*).

