
- •Федеральное агентство по образованию рф
- •Введение
- •Литературный обзор
- •2.1 Исторический обзор
- •Пиразин. Общая характеристика
- •Нахождение в природе
- •2.4 Получение пиразинов
- •Строение пиразина и его производных
- •Химические свойства пиразина.
- •Электрофильное Замещение
- •Нуклеофильное замещение
- •Реакция с радикалами.
- •Металлирование галогендиазинов
- •Реакционноспособность заместителей боковой цепи
- •Окисление
- •Восстановление.
- •Производные пиразина
- •Аминопиразины.
- •Гидрированные пиразины.
- •Метилпиразины.
- •3. Обсуждение результатов
- •3.1 Синтез 1-[3-замещенных пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •3.1.1. Хлорирование 2-хлорпиразина сульфурилхлоридом
- •3.1.2. Синтез 2-хлор-3-(замещенных)пиразинов
- •3.1.3. Использование каталитической системы kf/Al2o3 для активации атома хлора в реакциях нуклеофильного замещения
- •Ямр 1н спектр 1-[3-(м-толилтио)пиразин-2-ил]-пиперидин-3-карбоновой кислоты
- •3.2. Амиды 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •3.2.1. Синтез карбамидных производных
- •3.2.2. Анализ спектров ямр 1н высокого разрешения амидов 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •3.2.3. Анализ спектров ямр 1н высокого разрешения амидов 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •Ямр1н спектр 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-3-хлор-бензиламида
- •Ямр1н спектр 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоксо-3-хлор-бензиламида (ароматическая зона)
- •4. Экспериментальная часть
- •4.1.5. Методика получения 2-хлор-3-(замещенного)пиразина
- •4.1.6. Методика получения 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот
- •4.2. Общая методика получения амидов 1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот.
- •4.3. Физико-химические методы исследований
- •6. Список литературы
- •Приложение
- •Данные спектров 1н ямр производных 1-[3-(фенилтио)пиразин-2-ил]-пиперидин-3-карбоновой кислоты в дмсо-d6, δ (м. Д.), j (Гц)
- •В дмсо-d6, δ (м. Д.), j (Гц)
- •Физико-химические свойства исследуемых веществ
- •Физико-химические свойства исследуемых веществ
3.1.3. Использование каталитической системы kf/Al2o3 для активации атома хлора в реакциях нуклеофильного замещения
Использование избытка нуклеофильного агента, замена толуола на ДМСО или ДМФА, повышение температуры до 1000С и увеличение времени реакции не позволило в данных условиях заместить второй атом хлора. Положительный результат был получен при использовании в качестве катализатора калий фторида, нанесенного на алюминий оксид, и краун-эфира. Нагревание реакционной смеси в течение 24 часов при температуре 100С дает необходимые 2,3-дизамещенные пиразины с умеренным выходом (60%) (схема 2).
Схема 2
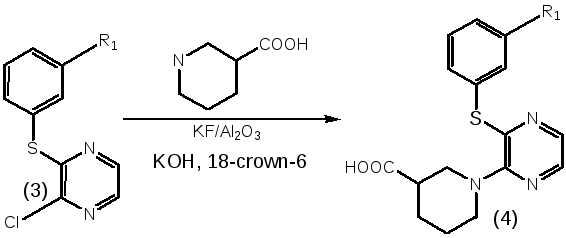
(R1,R2=Alkyl, Сycloalkyl,Aryl,Heterylи др).
Смесь 2-хлор-3-(замещенного)пиразина (3), этилового эфира пиперидин-3-карбоновой кислоты,KOH,KF/Al2O3, 18-краун-6 в ДМСО перемешивали 24 час при температуре 100°С. К фильтрату после отделения осадка неорганических солей прибавляли водный раствор КОН, перемешивали 2 часа при 80-90°С. Раствор отфильтровывали, фильтрат нейтрализовали концентрированной соляной кислотой и оставляли на ночь для кристаллизации. Выпавший осадок промывали водой и высушивали.
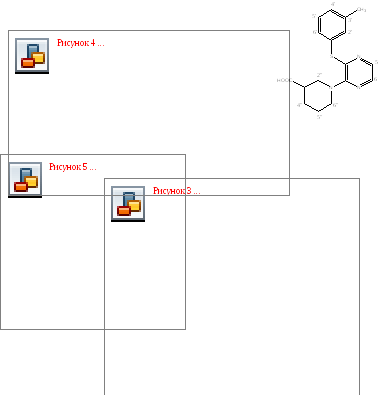
Строение полученного соединения 4 доказывали методом ЯМР1Н спектроскопии.
В наиболее слабом поле при δ 12,20 м.д. проявляется уширенный сигнал карбоксильной группы (рис. 2). При δ 7,96 и 7,86 м.д. наблюдаются два узких дублетных сигнала (3J= 2.7 Гц) незамещенных протонов пиразинового цикла. Четырехспиновая система протоновм-замещенной тиофенольной группы проявляется в виде триплета при δ = 7,29 (2Н,Н5’6’,3J= 3,55), синглета при δ = 7,26 (1Н, Н2’) мультиплета при δ = 7,23 (1H,H4’). Протоны метильной группы дают синглет приδ2,35 м.д. Аксиальные и экваториальные протоны метиленовых групп пиперидинового цикла, преимущественно находящегося в конформациикресло, образуют группу хорошо разрешенных отдельных сигналов при δ = 3.82 д (1Н,He2” , 3J = 12,8 ), 3.62 д (1Н,He6”, 3J = 12.8), 2.96 т (1Н,Ha2”, 3J = 11.5), 2.85 т (1Н,Ha6”, 3 J = 10.75), 2.08 м (1Н,He4”), 1.85 м (1Н,He5”), 1.70 (1Н,Ha4”), 1.60 м (1Н,Ha5”)м.д., метиновый протон при атоме С-3 наблюдается в виде мультиплета при δ 2.60 м.д..
Рис.2
Ямр 1н спектр 1-[3-(м-толилтио)пиразин-2-ил]-пиперидин-3-карбоновой кислоты
3.2. Амиды 1-[3-(замещенных) пиразин-2-ил]-пиперидин-3-карбоновых кислот.
3.2.1. Синтез карбамидных производных
1-[3-(замещенных)пиразин-2-ил]-пиперидин-3-карбоновых кислот
Полученная по схеме41-[3-(замещенная)пиразин-2-ил]-пиперидин-3-карбоновая кислота4была затем использована для синтеза широкого ряда карбоксамидных производных5. Кислоту4вводили в реакцию с аминами с использованием карбодиимидазольной активации (КДИ) (схема 3).
Схема 3
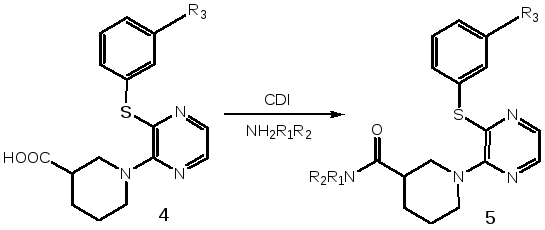
(R1, R2 = Alkyl, Сycloalkyl, Aryl, Heteryl и др., R3 = H, CH3)
К раствору 1-[3-(замещенной)пиразин-2-ил]-пиперидин-3-карбоновой кислоты (4)в абсолютном ДМФА добавляли КДИ (1,1′-N,N′-карбонилдиимидазола). Реакционную смесь перемешивали при температуре 40–500С в течение 1.5 часов. По окончании первой стадии реакции, о которой судят по завершению выделения углекислого газа, к образовавшемуся имидазолиду добавляли амин при температуре 50–600С. Через 8 – 10 часов выделяли целевые продукты высаждением растворомNa2CO3. Образовавшиеся осадки отфильтровывали и очищали перекристаллизацией из пропанола-2. Выход соединений составил 40-70 %.
Для увеличения структурного разнообразия целевых продуктов использовали первичные и вторичные амины алифатического, циклоалифатического, ароматического и гетероциклического рядов. В ходе экспериментов было выяснено, что природа амина оказывает заметное влияние на скорость и полноту указанной реакции. В общем случае алифатические амины наиболее эффективно участвуют в этой реакции, позволяя получать более высокие выходы целевых соединений. Менее нуклеофильные ароматические и гетероароматические амины реагируют несколько медленнее. Это обстоятельство следует учитывать при планировании синтеза больших рядов соединений общей структуры 5в условиях проведения параллельных реакций.
