
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
- •1. Цели и задачи дисциплины:
- •2. Требования к уровню освоения содержания дисциплины:
- •3. Объем дисциплины и виды учебной работы
- •4. Содержание дисциплины
- •4.3. Лабораторный практикум
- •5. Учебно-методическое обеспечение дисциплины
- •5.2 Дополнительные Средства обеспечения освоения дисциплины
- •Ядерная энергетика в мирных целях
- •Молекулярная физика
- •Критическое состояние эфира
- •Зеркало Френеля
- •Полосы интерференции от бипризмы Френеля
- •Получение изображения при помощи собирающей линзы
- •Квантовая физика
- •7. Содержание текущего и промежуточного контроля
- •7.3. Примерный перечень вопросов к зачетам и к экзамену
- •Вопросы к экзамену (Оптика).
- •Министерство образования и науки российской федерации
- •5. Движение материальной точки по окружности
- •Учебные наглядные пособия:
- •1.Система отсчета (относительность траектории)
- •Часть 1. Что такое система отсчета? Относительность покоя. Тела отсчета. Координатные оси. Отсчет времени. Понятие системы отсчета. Движение тел в различных системах отсчета.
- •Учебные наглядные пособия:
- •1. Инерция тела
- •2. Третий закон Ньютона
- •Учебные наглядные пособия:
- •1. Переход потенциальной энергии в кинетическую энергию и обратно
- •Раздел: Физические основы механики Лекция № 5 Механика твердого тела
- •Краткое содержание лекционного материала
- •3. Закон сохранения момента импульса
- •Учебные наглядные пособия:
- •1. Закон сохранения момента количества движения
- •2. Демонстрация вращения тел правильной геометрической формы
- •Раздел: Физические основы механики Лекция № 6 Колебания и волны
- •Краткое содержание лекционного материала
- •Графически это решение выглядит следующим образом: т– период колебаний зависит от параметров системы.
- •Логарифмический декремент затухания обратно пропорционален числу колебаний,совершенных за время, в течение которого амплитуда затухания колебаний уменьшается в е раз:
- •Раздел: Молекулярная физика и термодинамика
- •Учебные наглядные пособия:
- •Изобарический (изобарный) процесс
- •На каждую степень свободы молекулы приходится одинаковая энергия хаотического движения, которая равна .
- •Часть 2. Понятие о статических закономерностях.
- •Внутренней энергией идеального газа – называется полная энергия всех молекул, из которых состоит идеальный газ.
- •Работа и теплота
- •4. Первый закон термодинамики
- •2. Тепловые машины
- •Раздел: Электричество и магнетизм Лекция № 11 Электростатика
- •1 Электрический заряд
- •2 Взаимодействие зарядов. Закон Кулона
- •3. Электрическое поле и его характеристики
- •4. Принцип суперпозиции
- •5. Линии вектора напряжённости, поток вектора напряжённости электростатического поля
- •Учебные наглядные пособия:
- •3. Силовые линии электрического поля двух одноименных зарядов
- •3. Связь между напряжённостью и потенциалом
- •2. Закон Ома для участка цепи.
- •3. Электродвижущая сила
- •5. Работа и мощность постоянного тока. Закон Джоуля - Ленца
- •Учебные наглядные пособия:
- •1. Закон Ома для участка цепи Подготовка и проведение опыта
- •Раздел: Электричество и магнетизм Лекция № 14 Магнитное поле
- •Краткое содержание лекции
- •3. Поток вектора магнитной индукции
- •2. Влияние диэлектрика на электроемкость конденсатора Подготовка и проведение опыта
- •3. Перенос заряда Подготовка и проведение опыта
- •Раздел: Электричество и магнетизм Лекция № 15 Тема: Электромагнитная индукция
- •Краткое содержание лекции
- •2. Явление самоиндукции. Индуктивность контура
- •Раздел: Электричество и магнетизм
- •2. Постулаты Бора. Модель атома водорода по Бору
- •3. Закон Ридберга и объяснение на его основе спектров излучения
- •Учебные наглядные пособия:
- •Учебные наглядные пособия:
- •Молекулярная физика. 6 часов.
- •Электродинамика. 14часов.
- •Оптика и квантовая физика. 16 часов.
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
- •Колебания и волны
- •51. Задание {{ 63 }} тз 63 Тема 1-3-0
- •124. Задание {{ 251 }} тз 251 Тема 4-9-0
- •Заведующий кафедрой ______________Новичихина т.И.
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
Раздел: Электричество и магнетизм
Лекция № 17
Электромагнитные колебания и волны
Основные вопросы, рассматриваемые на лекции:
Колебательный контур.
Формула Томсона.
Электромагнитные волны.
Уравнение Максвелла.
Шкала электромагнитных волн.
Краткое содержание лекции
1–2. Колебательный контур. Формула Томсона
Электрическая цепь, состоящая из индуктивности и емкости, называется колебательным контуром.
В контуре происходят электрические колебания тока. Рассмотрим закон, по которому происходят колебания в контуре.
![]() ;
;
![]()
По
второму правилу Кирхгофа следует, что
![]()
д![]() ифференцированное
уравнение колебаний.
ифференцированное
уравнение колебаний.
![]() Обозначим:
Обозначим:![]()
![]()
![]()
![]() –формула Томсона.
–формула Томсона.
3. Электромагнитные колебания
Периодически повторяющиеся изменения силы тока в катушке и напряжения между обкладками конденсатора без потребления энергии от внешних источников называются свободными электромагнитными колебаниями.
4. Уравнения Максвелла
![]()
![]() Iуравнение Максвелла
Iуравнение Максвелла
![]() –IIуравнение Максвелла
–IIуравнение Максвелла
![]() IIIуравнение Максвелла (теорема
Остроградского–Гаусса)
IIIуравнение Максвелла (теорема
Остроградского–Гаусса)
![]() IVуравнение Максвелла
IVуравнение Максвелла
![]() –Vуравнение Максвелла
–Vуравнение Максвелла

Раздел: Атомная и ядерная физика
Лекция № 24
Атомная физика
Основные вопросы, рассматриваемые на лекции:
1. Исторический обзор развития атомной и ядерной физики.
2. Постулаты Бора. Модель атома водорода по Бору.
3. Закон Ридберга и объяснение на его основе спектров излучения.
Краткое содержание лекции
1. Исторический обзор развития атомной и ядерной физики
I1896-1918 г.г.
В 1896 Беккерель обнаружил явление радиоактивности урана.
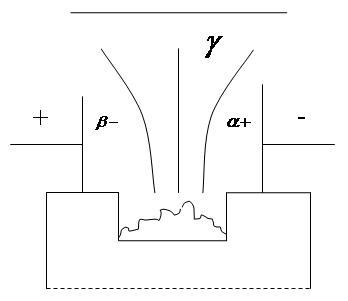
![]() -
«+»
-
«+»
![]() - «-»
- «-»
![]() - нейтральное
- нейтральное
В 1903 г. Томпсон предложил модель атома
В 1911 г. Резерфорд предложил планетарную модель атома.
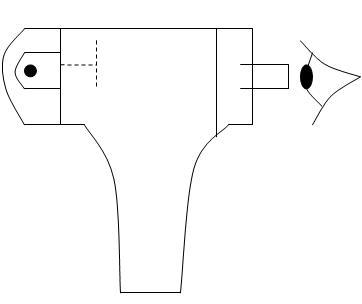
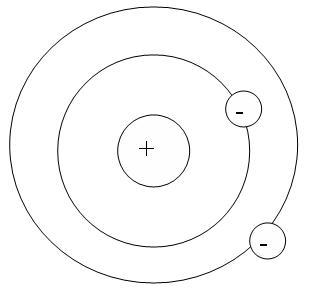
В 1913 г. Нильс Бор предложил свою модель:
Электроны движутся по орбитам, соблюдая свои законы.
II1919-1913 г.г.
А)
искусственное превращение атомов под
действием
![]() -
частиц;
-
частиц;
Б) исследованы космические лучи;
В) открыты новые элементарные частицы (нейтрино)
III1935-1938 г.г.
А) открыто деление урана под действием нейтронов;
Б) изобретены искусственные источники быстрых частиц;
IV1938-1945 г.г.
А) в этот период создана атомная бомба, так как
-была открыта реакция деления тяжёлых ядер;
-осуществлена цепная ядерная реакция;
V1946-2006 г.г.
Открыты новые элементарные частицы и началось использование атомных электростанций:
в 1954 г. – в России
в 1956 г. – в Англии
в. 1958 г. – в США
в. 1959 г. – во Франции
2. Постулаты Бора. Модель атома водорода по Бору
Предполагается, что ядро заряжено положительно, вокруг находятся отрицательные электроны, атом в целом нейтрален.
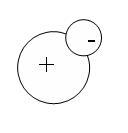
Постулаты Бора:
IЭлектроны в атоме могут находиться только в некоторых устойчивых состояниях (стационарное состояние). Находясь в этом состоянии атом не излучает электромагнитных волн.
IIАтом излучает или поглощает энергию при переходе из одного стационарного состояния в другое.
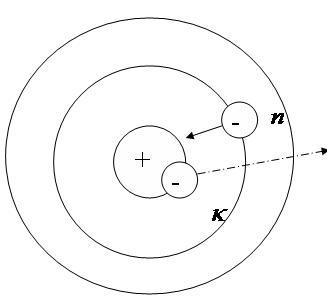
![]() - так появляется спектральная линия
- так появляется спектральная линия
IIIИз всех возможных состояний в атоме осуществляются только те, для которых момент количества движения равен целому числу.
![]() - момент количества движения
- момент количества движения
![]()
![]()
![]() ;
;
![]()
![]()
![]()
![]()
![]() - радиус орбиты
- радиус орбиты
![]() - радиус орбиты по Бору
- радиус орбиты по Бору
![]() - энергия электростатического поля
(энергия орбиты)
- энергия электростатического поля
(энергия орбиты)
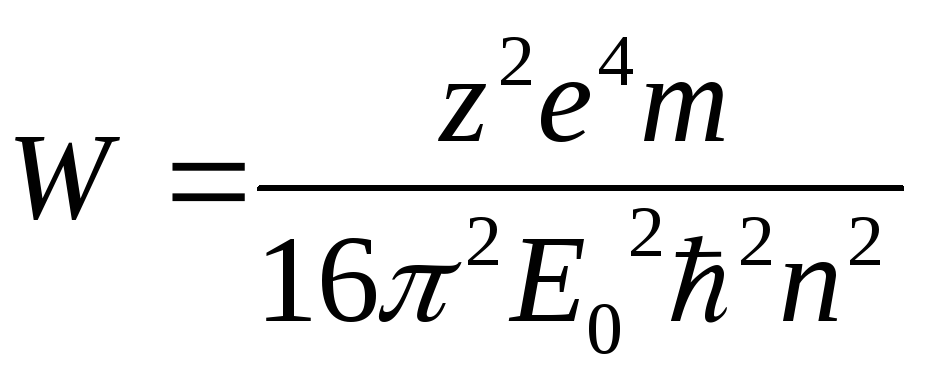
![]() ;
;
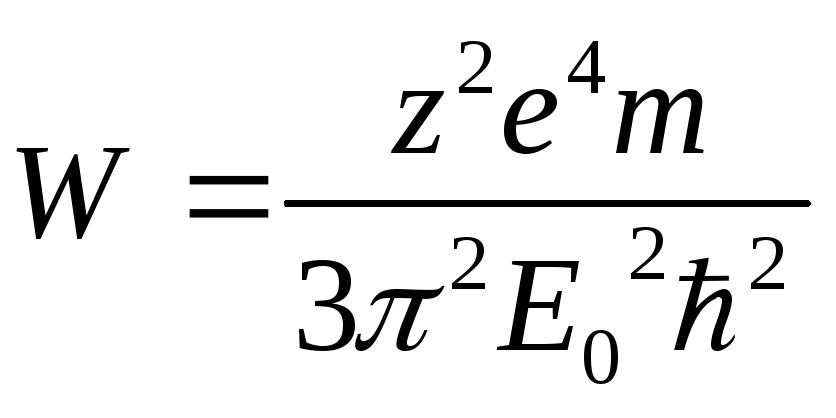 - полная энергия электрона на орбите
- полная энергия электрона на орбите
3. Закон Ридберга и объяснение на его основе спектров излучения
![]() - гдеnиk–
номера орбит
- гдеnиk–
номера орбит
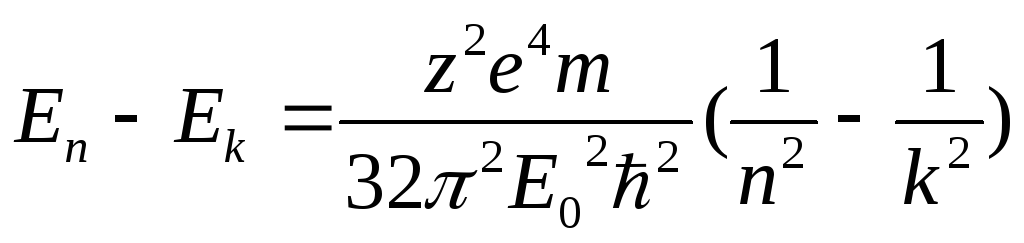
![]()
![]()
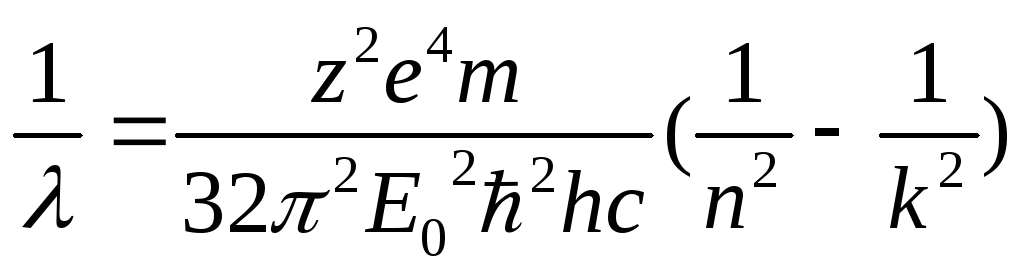
![]()
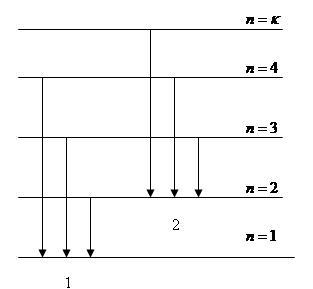
1 серия Лаймана
2 серия Бальмера
3 серия Пашена
Учебные наглядные пособия:
Демонстрации:
1. Строение атома. 2 ч., ВУЗ, ч-б, 1977г.;DVD–фильм
Часть 1. Модель атома Томсона. Опыты Резерфорда. Планетарная модель атома и ее несовместимость с классической электродинамикой.
Спектральные закономерности в спектре атома водорода. Серия Бальмера. Понятие о спектральных термах. Постулаты и модель атома Бора. Объяснение теорией Бора спектральных закономерностей в спектре атома водорода.
Гипотеза де Бройля. Корпускулярно-волновой дуализм микрочастиц.
Раздел: Атомная и ядерная физика
Лекция № 25
Атомная физика
Основные вопросы, рассматриваемые на лекции:
1. Размер и состав атомного ядра. Опыты Резерфорда.
2. Дефект масс и энергия связи.
3. Радиоактивность и виды радиоактивных распадов.
4. Законы радиоактивного распада.
Краткое содержание лекции
1. Размер и состав атомного ядра. Опыты Резерфорда
Опыты показали, что размер ядра 10-14; 10-15; размеры ядраd=10-10м.
Атомное ядро состоит из протонов (р) и нейтронов (n)
Протон – положительно заряженная частица
![]()
![]()
Нейтрон – нейтрален
![]()
Нейтроны и протоны называют нуклонами
X– любое вещество
Z– зарядовое число
А – массовое число
![]()
![]()
![]()
Z– число протонов
А – общее число нуклонов
(А-Z) – число нейтронов
Число электронов равно числу протонов
2. Дефект масс и энергия связи.
Эксперимент показал, что масса ядра меньше, чем масса составляющих его нуклонов.
Это явление получило название дефект масс.
![]() - дефект масс
- дефект масс
Всякому изменению массы должно следовать изменение энергии.
![]() - энергия связи
- энергия связи
3. Радиоактивность и виды радиоактивных распадов
В 1896 г. Беккерель обнаружил самопроизвольное испускание ураном нового вида излучения.
Явление испускания радиоактивного излучения получило название радиоактивность.
Радиоактивность – это способность некоторых атомных ядер самопроизвольно превращаться в другие ядра с испусканием различных видов излучения.
Виды радиоактивного излучения:
- искусственное;
- естественное.
![]() -
излучение - это поток ядер гелия
-
излучение - это поток ядер гелия
![]() -
излучение – это поток электронов
-
излучение – это поток электронов
![]() -
излучение – это электромагнитное
излучение
-
излучение – это электромагнитное
излучение
4. Законы радиоактивного распада
Эксперименты
показывают, что число ядер (![]() )
распавшихся в интервале времени от
)
распавшихся в интервале времени от![]() до
до![]() будет определяться по формуле:
будет определяться по формуле:
![]()
![]() - число не распавшихся ядер к моменту
времени
- число не распавшихся ядер к моменту
времени![]() .
.
![]() - постоянная радиоактивного распада
- постоянная радиоактивного распада
Знак
«-» показывает, что
![]() >0,то
>0,то![]() <0
или число
<0
или число![]() уменьшится
при распаде.
уменьшится
при распаде.
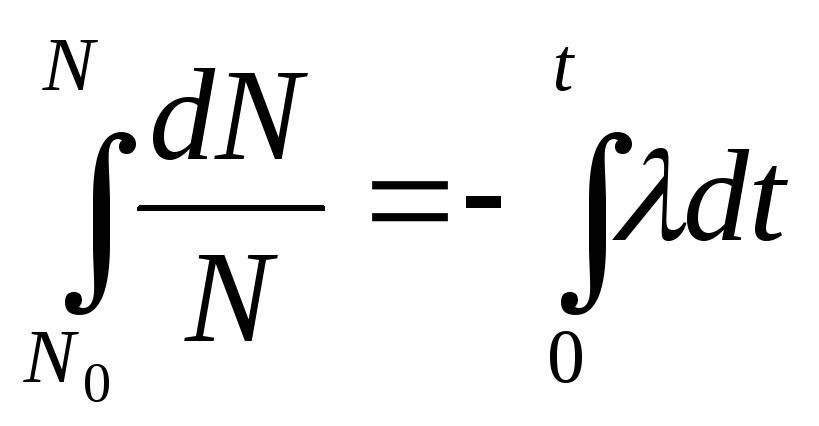 ;
;
![]() ;
;
![]() ;
;
![]() - закон радиоактивного распада
- закон радиоактивного распада
![]() - число не распавшихся ядер в начальный
момент времени
- число не распавшихся ядер в начальный
момент времени
![]() - число не распавшихся ядер по прошествии
времени
- число не распавшихся ядер по прошествии
времени
![]() ;
;
![]()
![]() - активность нуклонов – число распадов
за единицу времени.
- активность нуклонов – число распадов
за единицу времени.
![]()
![]()
IIзакон радиоактивного распада
Пусть вещество:
![]()
![]()
![]() - закон сохранения зарядового и массового
чисел
- закон сохранения зарядового и массового
чисел
Пример:
![]()
![]() - протон
- протон
![]() - нейтрон
- нейтрон
