- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
- •1. Цели и задачи дисциплины:
- •2. Требования к уровню освоения содержания дисциплины:
- •3. Объем дисциплины и виды учебной работы
- •4. Содержание дисциплины
- •4.3. Лабораторный практикум
- •5. Учебно-методическое обеспечение дисциплины
- •5.2 Дополнительные Средства обеспечения освоения дисциплины
- •Ядерная энергетика в мирных целях
- •Молекулярная физика
- •Критическое состояние эфира
- •Зеркало Френеля
- •Полосы интерференции от бипризмы Френеля
- •Получение изображения при помощи собирающей линзы
- •Квантовая физика
- •7. Содержание текущего и промежуточного контроля
- •7.3. Примерный перечень вопросов к зачетам и к экзамену
- •Вопросы к экзамену (Оптика).
- •Министерство образования и науки российской федерации
- •5. Движение материальной точки по окружности
- •Учебные наглядные пособия:
- •1.Система отсчета (относительность траектории)
- •Часть 1. Что такое система отсчета? Относительность покоя. Тела отсчета. Координатные оси. Отсчет времени. Понятие системы отсчета. Движение тел в различных системах отсчета.
- •Учебные наглядные пособия:
- •1. Инерция тела
- •2. Третий закон Ньютона
- •Учебные наглядные пособия:
- •1. Переход потенциальной энергии в кинетическую энергию и обратно
- •Раздел: Физические основы механики Лекция № 5 Механика твердого тела
- •Краткое содержание лекционного материала
- •3. Закон сохранения момента импульса
- •Учебные наглядные пособия:
- •1. Закон сохранения момента количества движения
- •2. Демонстрация вращения тел правильной геометрической формы
- •Раздел: Физические основы механики Лекция № 6 Колебания и волны
- •Краткое содержание лекционного материала
- •Графически это решение выглядит следующим образом: т– период колебаний зависит от параметров системы.
- •Логарифмический декремент затухания обратно пропорционален числу колебаний,совершенных за время, в течение которого амплитуда затухания колебаний уменьшается в е раз:
- •Раздел: Молекулярная физика и термодинамика
- •Учебные наглядные пособия:
- •Изобарический (изобарный) процесс
- •На каждую степень свободы молекулы приходится одинаковая энергия хаотического движения, которая равна .
- •Часть 2. Понятие о статических закономерностях.
- •Внутренней энергией идеального газа – называется полная энергия всех молекул, из которых состоит идеальный газ.
- •Работа и теплота
- •4. Первый закон термодинамики
- •2. Тепловые машины
- •Раздел: Электричество и магнетизм Лекция № 11 Электростатика
- •1 Электрический заряд
- •2 Взаимодействие зарядов. Закон Кулона
- •3. Электрическое поле и его характеристики
- •4. Принцип суперпозиции
- •5. Линии вектора напряжённости, поток вектора напряжённости электростатического поля
- •Учебные наглядные пособия:
- •3. Силовые линии электрического поля двух одноименных зарядов
- •3. Связь между напряжённостью и потенциалом
- •2. Закон Ома для участка цепи.
- •3. Электродвижущая сила
- •5. Работа и мощность постоянного тока. Закон Джоуля - Ленца
- •Учебные наглядные пособия:
- •1. Закон Ома для участка цепи Подготовка и проведение опыта
- •Раздел: Электричество и магнетизм Лекция № 14 Магнитное поле
- •Краткое содержание лекции
- •3. Поток вектора магнитной индукции
- •2. Влияние диэлектрика на электроемкость конденсатора Подготовка и проведение опыта
- •3. Перенос заряда Подготовка и проведение опыта
- •Раздел: Электричество и магнетизм Лекция № 15 Тема: Электромагнитная индукция
- •Краткое содержание лекции
- •2. Явление самоиндукции. Индуктивность контура
- •Раздел: Электричество и магнетизм
- •2. Постулаты Бора. Модель атома водорода по Бору
- •3. Закон Ридберга и объяснение на его основе спектров излучения
- •Учебные наглядные пособия:
- •Учебные наглядные пособия:
- •Молекулярная физика. 6 часов.
- •Электродинамика. 14часов.
- •Оптика и квантовая физика. 16 часов.
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
- •Колебания и волны
- •51. Задание {{ 63 }} тз 63 Тема 1-3-0
- •124. Задание {{ 251 }} тз 251 Тема 4-9-0
- •Заведующий кафедрой ______________Новичихина т.И.
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
Раздел: Молекулярная физика и термодинамика
Лекция № 7
Молекулярная физика
Основные вопросы, рассматриваемые на лекции:
Основные положения и опытные обоснования молекулярно-кинетической теории строения вещества.
Масса и размеры молекул.
Краткое содержание лекционного материала
1. Основные положения и опытные обоснования МКТ строения вещества
Молекулярная физика изучает:
Строение тела (из чего состоит вещество и какими свойствами обладает).
При каких условиях вещество находится в жидком, твердом и газообразном состоянии.
Тепловые явления.
Молекула – это мельчайшая частица вещества, которая сохраняет его химические свойства.
Молекулу нельзярассмотреть через оптический микроскоп из-за ее маленьких размеров. Некоторые молекулы состоят из одного атома (простейшие). Атом можно рассматривать как одноатомную молекулу.
Основные положения МКТ:
Вещество состоит из мельчайших частиц – молекул (атомов). Масса вещества равна сумме масс частиц (молекул).
Вывод:тело может изменять массу на величину, равную массе микрочастице.
Молекулы всех тел находятся в непрерывном хаотическом тепловом движении. Чем выше температура, то и интенсивность теплового движения возрастает.
В газе расстояния между молекулами большие, в жидкостях меньше, в твердых телах – очень малые расстояния между молекулами.
Кристаллическимтелом называется тело, если при мысленном соединении узлов образуется правильная конфигурация. Если фигура имеет неправильную форму, то тело называютаморфным. В жидком состоянии узлы меняют положение, в твердом состоянии узлы остаются неподвижными.
Молекулы взаимодействуют между собой. В зависимости от расстояния между молекулами – они притягиваются или отталкиваются.
Опытное обоснование МКТ:
Всякое тело делится на части:
А) механическое разделение
Б) растворение
В) переход из одного агрегатного состояния в другое.
Диффузия – проникновение одного вещества в другое. Пример: растворимость порошка в воде, проникновение запахов и т.д.
Сжимаемость. Существуют промежутки между узлами.
Упругая деформация (возвращение в исходную форму).
Два свинцовых цилиндра при сильном сжатии слипаются, т.к. между молекулами свинца действуют силы притяжения.
Броуновское движение.
Перечисленные методы служат косвенным доказательством существования молекул и их непрерывного хаотического движения. Сами молекулы в опытах не наблюдаются, но результаты экспериментов качественно и количественно совпадают с теоретическими предпосылками.
Масса и размеры молекул
В природе существует громадное количество различных молекул. Некоторые получены искусственно. Для описания молекул используют понятия «количество вещества», «число Авогадро», «молярная масса».
Количество
вещества
![]() (количество
молекул),
(количество
молекул),![]()
Число Авогадро – число атомов (молекул), которое содержится в 1 моле вещества.
![]() .
.
![]()
Примеры:
молярная масса атома кислорода –![]() ,
молярная масса молекулы водорода -
,
молярная масса молекулы водорода -![]() ,
молярная масса молекулы воды –
,
молярная масса молекулы воды –![]()
Количества
вещества определяют по формуле:
![]() .
.
Задача 1: Определить число молекул в любой массе вещества
![]()
Задача 2: Дан объем вещества. Сколько молекул находится в данном объеме?
![]()
Задача 3: Найти массу одной молекулы.
![]()
Задача 4: Оценить массу одной молекулы воды?
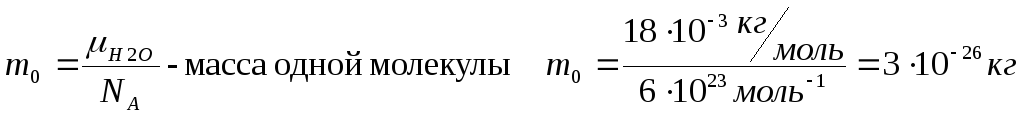
Задача 5: Оценить размеры молекулы?
Рассмотрим один моль вещества в виде кубика. N1– количество молекул в 1-м ряду.
NA=N=N13– общее количество всех молекул. Определим объем ячейки.
![]()
Задача 6: Определить размеры одной молекулы воды?