
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
- •1. Цели и задачи дисциплины:
- •2. Требования к уровню освоения содержания дисциплины:
- •3. Объем дисциплины и виды учебной работы
- •4. Содержание дисциплины
- •4.3. Лабораторный практикум
- •5. Учебно-методическое обеспечение дисциплины
- •5.2 Дополнительные Средства обеспечения освоения дисциплины
- •Ядерная энергетика в мирных целях
- •Молекулярная физика
- •Критическое состояние эфира
- •Зеркало Френеля
- •Полосы интерференции от бипризмы Френеля
- •Получение изображения при помощи собирающей линзы
- •Квантовая физика
- •7. Содержание текущего и промежуточного контроля
- •7.3. Примерный перечень вопросов к зачетам и к экзамену
- •Вопросы к экзамену (Оптика).
- •Министерство образования и науки российской федерации
- •5. Движение материальной точки по окружности
- •Учебные наглядные пособия:
- •1.Система отсчета (относительность траектории)
- •Часть 1. Что такое система отсчета? Относительность покоя. Тела отсчета. Координатные оси. Отсчет времени. Понятие системы отсчета. Движение тел в различных системах отсчета.
- •Учебные наглядные пособия:
- •1. Инерция тела
- •2. Третий закон Ньютона
- •Учебные наглядные пособия:
- •1. Переход потенциальной энергии в кинетическую энергию и обратно
- •Раздел: Физические основы механики Лекция № 5 Механика твердого тела
- •Краткое содержание лекционного материала
- •3. Закон сохранения момента импульса
- •Учебные наглядные пособия:
- •1. Закон сохранения момента количества движения
- •2. Демонстрация вращения тел правильной геометрической формы
- •Раздел: Физические основы механики Лекция № 6 Колебания и волны
- •Краткое содержание лекционного материала
- •Графически это решение выглядит следующим образом: т– период колебаний зависит от параметров системы.
- •Логарифмический декремент затухания обратно пропорционален числу колебаний,совершенных за время, в течение которого амплитуда затухания колебаний уменьшается в е раз:
- •Раздел: Молекулярная физика и термодинамика
- •Учебные наглядные пособия:
- •Изобарический (изобарный) процесс
- •На каждую степень свободы молекулы приходится одинаковая энергия хаотического движения, которая равна .
- •Часть 2. Понятие о статических закономерностях.
- •Внутренней энергией идеального газа – называется полная энергия всех молекул, из которых состоит идеальный газ.
- •Работа и теплота
- •4. Первый закон термодинамики
- •2. Тепловые машины
- •Раздел: Электричество и магнетизм Лекция № 11 Электростатика
- •1 Электрический заряд
- •2 Взаимодействие зарядов. Закон Кулона
- •3. Электрическое поле и его характеристики
- •4. Принцип суперпозиции
- •5. Линии вектора напряжённости, поток вектора напряжённости электростатического поля
- •Учебные наглядные пособия:
- •3. Силовые линии электрического поля двух одноименных зарядов
- •3. Связь между напряжённостью и потенциалом
- •2. Закон Ома для участка цепи.
- •3. Электродвижущая сила
- •5. Работа и мощность постоянного тока. Закон Джоуля - Ленца
- •Учебные наглядные пособия:
- •1. Закон Ома для участка цепи Подготовка и проведение опыта
- •Раздел: Электричество и магнетизм Лекция № 14 Магнитное поле
- •Краткое содержание лекции
- •3. Поток вектора магнитной индукции
- •2. Влияние диэлектрика на электроемкость конденсатора Подготовка и проведение опыта
- •3. Перенос заряда Подготовка и проведение опыта
- •Раздел: Электричество и магнетизм Лекция № 15 Тема: Электромагнитная индукция
- •Краткое содержание лекции
- •2. Явление самоиндукции. Индуктивность контура
- •Раздел: Электричество и магнетизм
- •2. Постулаты Бора. Модель атома водорода по Бору
- •3. Закон Ридберга и объяснение на его основе спектров излучения
- •Учебные наглядные пособия:
- •Учебные наглядные пособия:
- •Молекулярная физика. 6 часов.
- •Электродинамика. 14часов.
- •Оптика и квантовая физика. 16 часов.
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
- •Колебания и волны
- •51. Задание {{ 63 }} тз 63 Тема 1-3-0
- •124. Задание {{ 251 }} тз 251 Тема 4-9-0
- •Заведующий кафедрой ______________Новичихина т.И.
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
Внутренней энергией идеального газа – называется полная энергия всех молекул, из которых состоит идеальный газ.
Полная энергия всех молекул складывается из энергиивзаимодействия молекул (потенциальная энергия) и энергии движения (кинетическая энергия). НО для идеального газа взаимодействия молекул отсутствуют, поэтому, когда рассматривается полная энергия всех молекул, мы говорим, что полная энергия равна суммарной кинетической энергии.
Подсчитаем, чему равна внутренняя энергия идеального газа:
![]() средняя
кинетическая энергия одной молекулы.
средняя
кинетическая энергия одной молекулы.
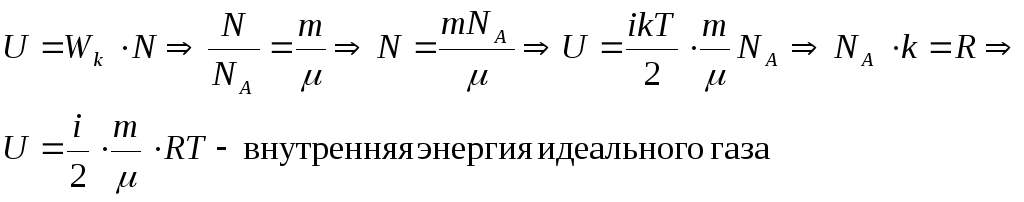
Работа и теплота
Если привести в соприкосновение два тела, то в процессе взаимодействия они смогут обмениваться энергией, как в той так и в другой форме. Этот обмен различными формами энергии характеризуется понятиями совершенной работы А и переданного тепла Q.
Работа есть мера переданной другому телу или телам механической энергии. Работа сама по себе не есть какая-либо особая форма энергии. Совершая работу над телом, мы меняем его энергию.
![]()
Процесс передачи энергии от быстрых молекул к медленным без совершения работы сокращенно называется теплообменом. Мера теплообмена – теплота (Q). Теплота не является особой формой энергией. Тепло есть мера переданному телу или отданной им энергии хаотического молекулярного движения.
![]()
4. Первый закон термодинамики
Первый закон термодинамики называют законом сохранения энергии.
![]() 1-й
закон термодинамики (первое начало).
1-й
закон термодинамики (первое начало).
Формулировка: Количество тепла, подведенное к системе равно изменению внутренней энергии системы и работе системы, совершенной над внешним телом.
d–полный дифференциал,![]() неполный дифференциал (зависит от того,
как протекает процесс).
неполный дифференциал (зависит от того,
как протекает процесс).
![]()
Знак «+» ставится тогда, когда система сама совершает работу, знак «–» – когда над системой совершают работу.
Применение первого закона термодинамики к изопроцессам и изобарическому процессу
Задачи: 1) рассчитать работу, 2) рассчитать внутренную энергию, 3) как будет выглядеть 1-й закон термодинамики для данного изопроцесса.
Изохорический
![]() теплоемкость
при постоянном объеме.
теплоемкость
при постоянном объеме.![]() .
.
Сравнивая
эти две формулы можно установить, что:
![]()
Изобарический
![]()
Первый
закон термодинамики:
![]()
Определим
работу:
![]()
Подставим
в выражение (*) известные значения,
получим:![]()
Это
соотношение можно выразить через
изменение температуры:
![]()
Продифференцируем:
![]() ,
подставим и получим:
,
подставим и получим:
![]() связь
между теплоемкостями при Р-constиV-const–
уравнение Майера.
связь
между теплоемкостями при Р-constиV-const–
уравнение Майера.
Изотермический
![]()
Из
уравнения Клапейрона–Менделеева:
![]() выразим Р и подставим в этот интеграл:
выразим Р и подставим в этот интеграл:
![]()
Адиабатический (адиабатный)
Процесс, протекающий без теплообмена с окружающей средой, называется адиабатическим.
Выведем уравнение адиабатического процесса:
![]()
Подставим
известные значения:
![]()
Разделим
обе части на mиT:![]()
Перенесем слагаемое и проинтегрируем:
![]() Пусть
Пусть![]() ,
тогда
,
тогда
![]()
![]() уравнение
адиабатического процесса (уравнение
Пуассона).
уравнение
адиабатического процесса (уравнение
Пуассона).
![]() .
.
Работа при адиабатного процессе:
![]()
![]()
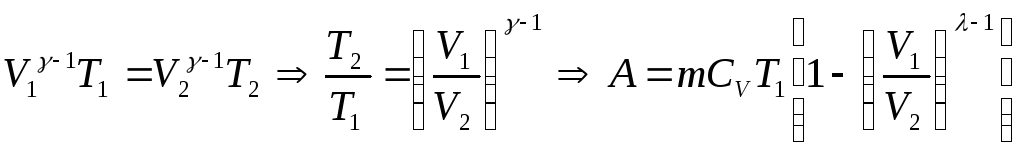
Учебные наглядные пособия:
Демонстрации:
1. Работа пара при нагревании воды в пробирке
П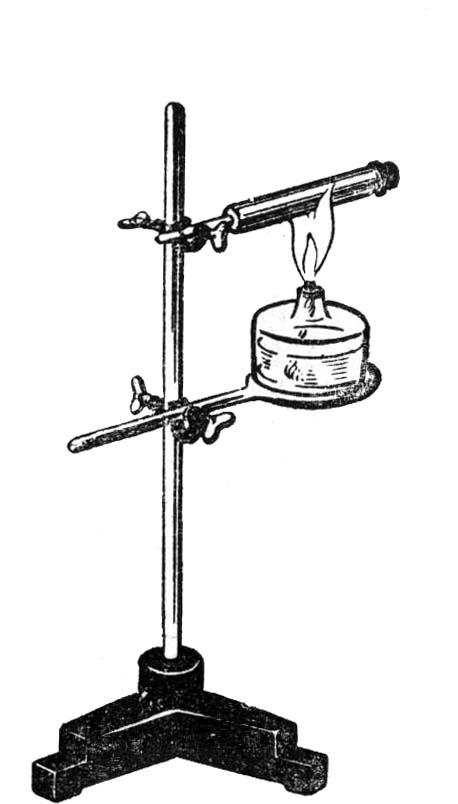 одготовка
и проведение опыта
одготовка
и проведение опыта
Собрать штатив универсальный. В муфте прямоугольной (сверху) вертикально укрепить пробирку, затем слегка наклонить ее. В пробирку налить 2-3 мл воды. Пробку смочить в воде и закрыть пробирку. В муфте прямоугольной (снизу) закрепить трехпалую лапку, в которой укрепить свечу таким образом, чтобы нижняя часть пробирки находилась в пламени свечи. Нагревать пробирку. При нагревании пробка вылетает - пар совершает работу.
2. Адиабатное расширение
П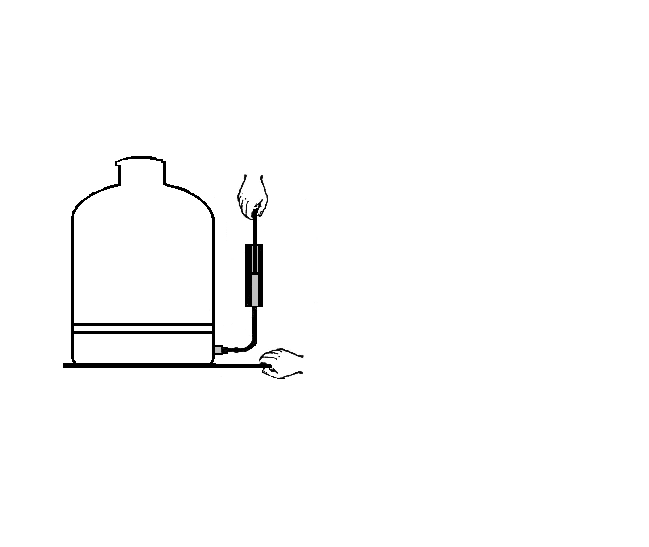 одготовка
и проведение опыта
одготовка
и проведение опыта
В сосуд добавить воды и спирта. Смочить пробку водой. Плотно, но не сильно, закрыть сосуд (верхняя горловина). Накачать воздух в сосуд (20-30 движений). При определенном давлении в сосуде – пробка вылетает из горловины, а в сосуде образуется “туман”.
Раздел: Молекулярная физика и термодинамика
Лекция № 10
Основы термодинамики
Основные вопросы, рассматриваемые на лекции:
Обратимый и необратимый процессы.
Тепловые машины.
Цикл Карно и его КПД.
Второй закон термодинамики.
Краткое содержание лекционного материала
Обратимый и необратимый процессы
Процесс – переход системы из одного состояния в другое. Эти процессы осуществляются по-разному, поэтому они и разнообразны.
1
2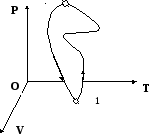 или 2 точка называется фаза (мгновенное
состояние). Кривая называется фазовая
траектория.
или 2 точка называется фаза (мгновенное
состояние). Кривая называется фазовая
траектория.
Если процесс можно провести в обратном порядке, т.е. система возвратиться в исходное состояние, и в окружающей среде не происходит никаких изменений, то процесс называется обратимым, а когда система не возвращается в исходное состояние, то процесс называютнеобратимым.
При обратимом процессе система проходит те же точки фазовой траектории, что она проходила и в прямом процессе (иначе круговом).
Пример: Рассмотрим работу поршня. Процесс поднятия поршня бесконечен. Расширение газа в цилиндре под поршнем будет обратимым, если этот процесс производить бесконечно медленно.
При круговом процессетраектория – замкнутая кривая. Круговой процесс может быть обратимым. Круговой процесс называютциклом.
