
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
- •1. Цели и задачи дисциплины:
- •2. Требования к уровню освоения содержания дисциплины:
- •3. Объем дисциплины и виды учебной работы
- •4. Содержание дисциплины
- •4.3. Лабораторный практикум
- •5. Учебно-методическое обеспечение дисциплины
- •5.2 Дополнительные Средства обеспечения освоения дисциплины
- •Ядерная энергетика в мирных целях
- •Молекулярная физика
- •Критическое состояние эфира
- •Зеркало Френеля
- •Полосы интерференции от бипризмы Френеля
- •Получение изображения при помощи собирающей линзы
- •Квантовая физика
- •7. Содержание текущего и промежуточного контроля
- •7.3. Примерный перечень вопросов к зачетам и к экзамену
- •Вопросы к экзамену (Оптика).
- •Министерство образования и науки российской федерации
- •5. Движение материальной точки по окружности
- •Учебные наглядные пособия:
- •1.Система отсчета (относительность траектории)
- •Часть 1. Что такое система отсчета? Относительность покоя. Тела отсчета. Координатные оси. Отсчет времени. Понятие системы отсчета. Движение тел в различных системах отсчета.
- •Учебные наглядные пособия:
- •1. Инерция тела
- •2. Третий закон Ньютона
- •Учебные наглядные пособия:
- •1. Переход потенциальной энергии в кинетическую энергию и обратно
- •Раздел: Физические основы механики Лекция № 5 Механика твердого тела
- •Краткое содержание лекционного материала
- •3. Закон сохранения момента импульса
- •Учебные наглядные пособия:
- •1. Закон сохранения момента количества движения
- •2. Демонстрация вращения тел правильной геометрической формы
- •Раздел: Физические основы механики Лекция № 6 Колебания и волны
- •Краткое содержание лекционного материала
- •Графически это решение выглядит следующим образом: т– период колебаний зависит от параметров системы.
- •Логарифмический декремент затухания обратно пропорционален числу колебаний,совершенных за время, в течение которого амплитуда затухания колебаний уменьшается в е раз:
- •Раздел: Молекулярная физика и термодинамика
- •Учебные наглядные пособия:
- •Изобарический (изобарный) процесс
- •На каждую степень свободы молекулы приходится одинаковая энергия хаотического движения, которая равна .
- •Часть 2. Понятие о статических закономерностях.
- •Внутренней энергией идеального газа – называется полная энергия всех молекул, из которых состоит идеальный газ.
- •Работа и теплота
- •4. Первый закон термодинамики
- •2. Тепловые машины
- •Раздел: Электричество и магнетизм Лекция № 11 Электростатика
- •1 Электрический заряд
- •2 Взаимодействие зарядов. Закон Кулона
- •3. Электрическое поле и его характеристики
- •4. Принцип суперпозиции
- •5. Линии вектора напряжённости, поток вектора напряжённости электростатического поля
- •Учебные наглядные пособия:
- •3. Силовые линии электрического поля двух одноименных зарядов
- •3. Связь между напряжённостью и потенциалом
- •2. Закон Ома для участка цепи.
- •3. Электродвижущая сила
- •5. Работа и мощность постоянного тока. Закон Джоуля - Ленца
- •Учебные наглядные пособия:
- •1. Закон Ома для участка цепи Подготовка и проведение опыта
- •Раздел: Электричество и магнетизм Лекция № 14 Магнитное поле
- •Краткое содержание лекции
- •3. Поток вектора магнитной индукции
- •2. Влияние диэлектрика на электроемкость конденсатора Подготовка и проведение опыта
- •3. Перенос заряда Подготовка и проведение опыта
- •Раздел: Электричество и магнетизм Лекция № 15 Тема: Электромагнитная индукция
- •Краткое содержание лекции
- •2. Явление самоиндукции. Индуктивность контура
- •Раздел: Электричество и магнетизм
- •2. Постулаты Бора. Модель атома водорода по Бору
- •3. Закон Ридберга и объяснение на его основе спектров излучения
- •Учебные наглядные пособия:
- •Учебные наглядные пособия:
- •Молекулярная физика. 6 часов.
- •Электродинамика. 14часов.
- •Оптика и квантовая физика. 16 часов.
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
- •Колебания и волны
- •51. Задание {{ 63 }} тз 63 Тема 1-3-0
- •124. Задание {{ 251 }} тз 251 Тема 4-9-0
- •Заведующий кафедрой ______________Новичихина т.И.
- •Министерство образования и науки российской федерации
- •Министерство образования и науки российской федерации
Изобарический (изобарный) процесс
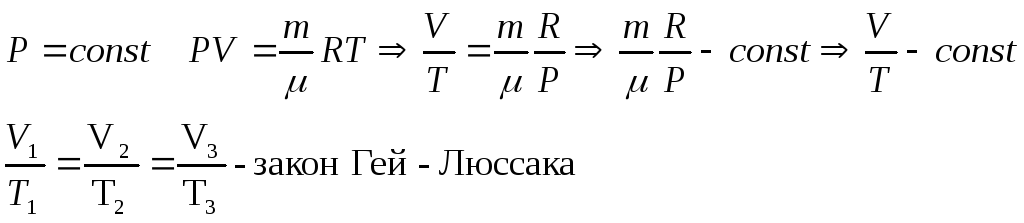
Основное уравнение кинетической теории газов
Основное уравнение устанавливает связь между давлением и кинетической энергией газа. Рассмотрим один моль газа. Определим давление, которое осуществляет молекула на стенку (заштрихованная).
П усть
усть![]()
Допустим,
что какая-то i–тая молекула
столкнулась со стенкой и возник упругий
удар:![]() .
.
Из
второго закона Ньютона:
![]()
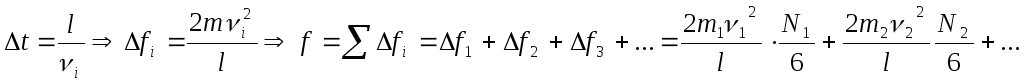
![]() .
Введем обозначение:
.
Введем обозначение:
![]() .
.![]()
Тогда
получим выражение:
![]() .
.
Т.к.
![]() –
концентрация молекул (число молекул в
единице объема).
–
концентрация молекул (число молекул в
единице объема).
![]() средняя
кинетическая энергия всех молекул.
средняя
кинетическая энергия всех молекул.
![]() основное
уравнение кинетической теории газов.
основное
уравнение кинетической теории газов.
Формулировка:давление газа прямо пропорционально кинетической энергии хаотического движения молекул.
Следствие:
Т. к.![]() Приравняем обе части уравнений,
преобразуем и получим:
Приравняем обе части уравнений,
преобразуем и получим:
![]() .
.
Температура – мера хаотического движения молекул.
Распределение энергии молекул по степеням свободы
Число независимых координат, с помощью которых можно описать движение данной системы в пространстве называется числом степеней свободы некоторых переменных.
С помощью трех координат мы можем определить
положение молекулы, состоящей из двух
атомов. Двухатомная молекула обладает
двумя степенями свободы, трехатомная
– 6 степенями свободы.
помощью трех координат мы можем определить
положение молекулы, состоящей из двух
атомов. Двухатомная молекула обладает
двумя степенями свободы, трехатомная
– 6 степенями свободы.
Теорема: О равномерном распределении энергии по степеням свободы
На каждую степень свободы молекулы приходится одинаковая энергия хаотического движения, которая равна .
![]() предположение
Больцмана.
предположение
Больцмана.
Распределение молекул по скоростям
Молекулы в газе движутся с различными скоростями:
![]() ,
,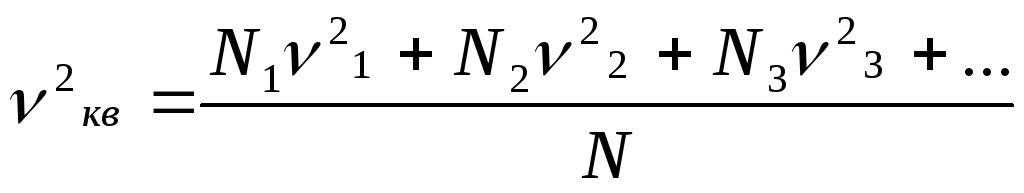
Первым функцию распределения молекул по скоростям определил Максвелл, поэтому ее называют функцией Максвелла.
Н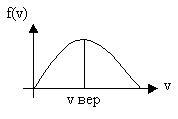 аиболее
вероятная скорость:
аиболее
вероятная скорость:
![]()
![]() средняя скорость
теплового движения молекул.
средняя скорость
теплового движения молекул.
![]() Функция распределения
молекул по скоростям.
Функция распределения
молекул по скоростям.
![]() .
Если
.
Если![]()
Учебные наглядные пособия:
Демонстрации:
1.Статистическая закономерность распределения
П одготовка
и проведение опыта
одготовка
и проведение опыта
Воронку укрепить на доске Гальтона. В воронку вертикально расположенного прибора сначала опустить один металлический шарик и наблюдать, как, падая, он сталкивается с многими гвоздями и совершенно случайно попадает в тот или иной отсек. Затем поочередно опустить еще 2-3 шарика и убедиться в том, что, несмотря на одинаковые условия, эти одиночные шарики попадают совсем в другие, случайные отсеки. Наконец, в воронку высыпать пластмассовые шарики и предоставить им возможность поочередно попадать в отсеки сквозь заслон гвоздей. В результате оказывается, что шарики в отсеках размещаются неравномерно, и, в то же время неслучайно. Процесс будет подчиняться статистическому закону распределения: больше всего шариков будет в среднем отсеке, а в другом шариков будет тем меньше, чем дальше отсек отстоит от середины, но расположение их будет симметрично. Заметить полученное распределение и, повторить опыт. Картина распределения останется прежней.
2. Молекулы и молекулярное движение. 2ч., шк., ч-б, 1959г.;DVD–фильм
Часть 2. Понятие о статических закономерностях.
Распределение молекул по скоростям. Опыт Штерна. Описание установки. Сравнение результатов опыта с теорией Максвелла.
Раздел: Молекулярная физика и термодинамика
Лекция № 9
Основы термодинамики
Основные вопросы, рассматриваемые на лекции:
Термодинамический и статистический подходы к макроскопическим системам.
Внутренняя энергия идеального газа.
Работа и теплота.
Первый закон термодинамики.
Применение первого закона термодинамики к изопроцессам и адиабатическому процессу.
Краткое содержание лекционного материала
Термодинамический и статистический подходы
Макроскопические
параметры выступают как усредненные
значения микроскопических характеристик
молекул. Температура выступает как
усредненная скорость хаотического
движения молекул:
![]() ~Wk~v2ср
, P~Wk~v2кв.
~Wk~v2ср
, P~Wk~v2кв.
Метод, при котором пользуются лишь усредненными значениями огромного числа частиц, называется статистическим.
Термодинамика в отличие от статистической теории изучает макроскопические свойства тел, не интересуясь их микроскопической природой. В основе термодинамики лежит ряд положений.
Внутренняя энергия идеального газа
