- •Понятие, задачи, предмет, методы, содержание и компетенции дисциплины «Биологическая химия».
- •Роль отечественных ученых в развитии биохимии.
- •Разделы биохимии. Значение биохимии для других специальных дисциплин (зоопсихология, кормление животных, кинологии).
- •Периоды развития биохимии.
- •2.11 Ионное произведение воды и его следствия.
- •2.16 Буферные системы крови.
- •2.17 Характеристика коллоидных состояний веществ.
- •2.18 Условия, необходимые для получения коллоидных растворов.
- •2.19 Методы получения коллоидных растворов.
- •2.20 Методы очистки коллоидных растворов.
- •2.21 Механизм адсорбции.
- •2.22 Адсорбционная хроматография.
- •2.24 Факторы устойчивости коллоидных растворов.
- •2.25 Механизм коагуляции под действием электролитов.
- •2.26 Коллоидная защита.
- •2.27 Студни.
- •2.28 Методы получения студней.
- •3.1 Общая характеристика углеводов, их роль в питании и жизнедеятельности организма.
- •3.2 Классификация углеводов.
- •3.3 Моносахариды, их типы и классификация по числу атомов.
- •3.4 Триозы, их строение.
- •3.5 Характеристика и строение пентоз.
- •3.6. Характеристика и строение гексоз.
- •3.7. Общая характеристика и образование дисахаридов (мальтозы, лактозы, целлобиозы и галактозы).
- •3.8. Общая характеристика полисахаридов и классификация.
- •3.9. Характеристика, строение и роль крахмала, целюллозы и инулина в питании животных.
- •3.10. Характеристика и строение гликогена.
- •3.11. Строение и роль в организме гепарина, гиалуроновой, хондроитинсерной кислоты.
- •3.12. Химизм переваривания углеводов.
- •3.13. Переваривание у разных видов животных.
- •3.14. Пути использования всосавшейся глюкозы.
- •3.15. Роль печени в углеводном обмене.
- •3.16. Содержание гликогена в печени и мышцах.
- •3.17. Роль гликогена в мышечной ткани.
- •3.18. Гликонеогенез.
- •3.19. Пути расщепления углеводов в организме.
- •3.20. Гликогенолиз.
- •3.21. Гликолиз.
- •3.22. Цикл трикарбоновых кислот.
- •3.23. Пентозофосфатный путь окисления глюкозы и его роль в организме.
- •Действие инсулина на углеводный обмен.
- •Антагонисты инсулина по действию на углеводный обмен.
- •Нарушение углеводного обмена.
- •Гипогликемия, гипергликемия, глюкозурия. Гипогликемия.
- •4.1. Общая характеристика белков, их значение и функции в организме. Свойства белков.
- •4.2. Классификация и строение аминокислот.
- •Ациклические:
- •2. Циклические:
- •4.3. Незаменимые, частично заменимые и заменимые аминокислоты. Полноценные и неполноценные белки.
- •4.4. Полипептидная теория строения белков.
- •4.7. Характеристика и строение нуклеопротеидов.
- •4.8. Характеристика и строение хромопротеидов, фосфопротеидов, липопротеидов, гликопротеидов.
- •4.9. Строение днк, её роли и функции.
- •4.10. Строение рнк, её роль и функции.
- •4.11. Переваривание белков.
- •4.12. Всасывание белков.
- •4.13 Гниение белков в толстом отделе кишечника.
- •4.15 Дезаминирование аминокислот.
- •4.19 Количественная сторона белкового обмена, баланс азота.
- •4.20 Нарушение и регуляция белкового обмена.
- •5.1. Общая характеристика. Биологическая роль липидов.
- •5.2 Классификация липидов.
- •5.3 Строение нейтрального жира. Характеристика высших жирных кислот. Структурные и запасные жиры.
- •5.4 Стерины и стериды.
- •5.5 Воски.
- •5.7. Сфиногофосфолипиды, цереброзиды их роль.
- •5.9 Всасывание продуктов гидролиза жира. Строение желчных кислот и их участие во всасывании жирных кислот. Круговорот желчи.
- •5.10 Ресинтез. Липидов в клетках тонкого кишечника.
- •5.11Липолиз. Окисление глицерина.
- •5.12. Теория ф.Кнооп и современная схема β – окисления высших жирных кислот.
- •5.13. Липосинтез. Синтез глицерина и высших жирных кислот.
- •5.14. Регуляция липидного обмена.
- •5.15. Патология липидного обмена.
- •6.1. Витамины, биологическая роль. Функции витаминов и классификация.
- •1. Жирорастворимые а, d, e, k, f.
- •6.2. Жирорастворимые витамины. Строение и значение.
- •6.7. Гормоны. Строение, значение и роль.
- •6.8. Свойства и механизм действия гормонов. Общие свойства гормонов.
- •6.9. Функциональная классификация гормонов.
- •6.10. Макро- и микроэлементы. Значение, классификация и биологическая роль.
- •7.1. Биохимия крови. Значение и функции.
- •7.2. Биохимия мочи. Общая характеристика.
- •7.3. Биохимия печени.
- •7.4. Биохимия костной ткани.
- •7.5. Биохимия нервной ткани.
- •7.6. Биохимия яйца.
2.22 Адсорбционная хроматография.
Хроматография — метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами — неподвижной (твёрдая фаза) и подвижной (газовая или жидкая фаза, элюент).
Адсорбционная хроматография — разделение за счёт адсорбции основано на различии адсорбируемости компонентов смеси на данном адсорбенте; вид хроматографии, при которой разделение веществ, входящих в смесь и движущихся в потоке подвижной фазы, происходит за счёт их различной способности адсорбироваться и десорбироваться на поверхности адсорбента с развитой поверхностью, например, силикагеля.
Процесс взаимодействия может сопровождаться химическим взаимодействием примесей с неподвижной фазой, то есть хемосорбцией.
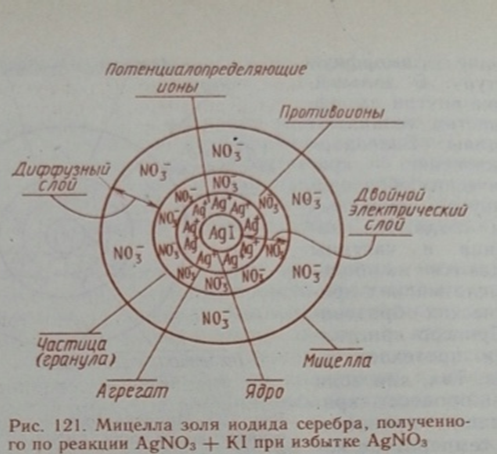
2.23 Строение коллоидной мицеллы. Золи состоят из 2 частей: 1. Мицеллы – структурная единица дисперсионной фазы, обладает определенным размером, электронетральностью и сложным строением. 2. Межмицеллярная жидкость. На основании обширного экспериментального материала было сформулировано правило: на поверхности твёрдого вещества предпочтительно адсорбируются ионы, способные достраивать его кристаллическую решётку или образующие с ионами, входящими в состав кристаллической решётки, наиболее трудно, растворимые соединения. Ионы, создающие + или – заряд ядра называются потенциалопределяющими. Естественно, после возникновения заряда агрегат начинает притягивать из раствора ионы с противоположительным знаком (противоионы) образуется двойной электрический слой. Некоторая часть противоионов очень прочно притягивается к агрегату, образуя адсорбционный слой противоионов. Агрегат вместе с адсорбированным слоем называют частицей или гранулой. Таким образом, частица (гранула) характеризуется двойным электрическим слоем, который образуется из потенциалопределяющих ионов и противоионов. Противоионы которые не входят в двойной электрический слой и находятся на более далёком расстоянии от ядра, образуют так называемый диффузный слой противоионов. |
|
2.24 Факторы устойчивости коллоидных растворов.
Для устойчивых коллоидных систем необходимо:
1. Размеры частиц должны составлять от 1 до 100 миллимикрон.
2. Присутствие стабилизатора (электролит). Он сообщает коллоидным частицам одноименный заряд на поверхности, противоположный заряд имеет среда вокруг частиц => не слипаются.
3. Фаза должна обладать плохой растворимостью.
2.25 Механизм коагуляции под действием электролитов.
Правила коагуляции:
1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию. Минимальная концентрация электролита, вызывающая коагуляцию золя за определённый короткий промежуток времени, называется порогом коагуляции. Величина, обратная порогу коагуляции, называется коагулирующей способностью электролита. Значит, чем меньше порог коагуляции, тем больше коагулирующая способность электролита.
2. Коагулирующим действием обладает не весь электролит. Заряд коагулирующего иона противоположен заряду коллоидной частицы. Этот ион называют ионом – коагулянтом.
3. Коагулирующая способность иона – коагулянта тем больше, чем больше заряд иона.
4. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке: Ag +> Cs+> Rb+> NH4+> K+> Na+> Li+. Этот ряд называется лиотропным.