
- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
На основе второго начала термодинамики можно выяснить возможность протекания процесса в данном направлении в различных условиях.
Из выражения второго начала термодинамики в интегральном виде
S
![]()
следует, что изменение энтропии может служить критерием направления процесса:
если S>![]() , то процесс является необратимым, т.е.
может протекать самопроизвольно.
, то процесс является необратимым, т.е.
может протекать самопроизвольно.
Если же S<![]() ,
то процесс в данном направлении
невозможен; еслиS=
,
то процесс в данном направлении
невозможен; еслиS=![]() ,
то система находится в состоянии
равновесия.
,
то система находится в состоянии
равновесия.
Из-за сложности
расчета
![]() удобнее использовать энтропию, как
критерий направления процесса, в
изолированной системе. В изолированной
системе нет обмена энергией,т.е.
δQ
= 0, тогда
удобнее использовать энтропию, как
критерий направления процесса, в
изолированной системе. В изолированной
системе нет обмена энергией,т.е.
δQ
= 0, тогда
(S)v,u > 0
S > 0 - процесс идет в прямом направлении;
S < 0 - процесс невозможен в прямом направлении;
S = 0 - состояние равновесия.
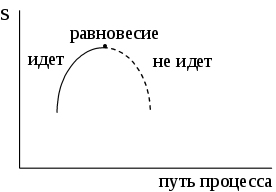
Рисунок 1.5 – Зависимость энтропии изолированной системы от пути процесса
Таким образом, в
изолированных системах возможны те
процессы, которые идут с ростом
энтропии, а
равновесие наступает при достижении
максимального значения энтропии,
![]() < 0 (условие максимума).
< 0 (условие максимума).
Характеристика энтропии
1. Энтропия
– это экстенсивное свойство системы.
S,
![]() .
Она может быть удельнойS,
.
Она может быть удельнойS,
![]() и молярнойS,
и молярнойS,
![]() (интенсивное свойство).
(интенсивное свойство).
Изменение энтропии
не зависит от способа проведения процесса
(обратимого или необратимого). Однако
для обратимого процесса
![]() ,
а для необратимого
,
а для необратимого![]() >
>![]() .
Это объясняется не увеличением ΔS,
а тем, что
.
Это объясняется не увеличением ΔS,
а тем, что
![]() >
>![]() ,
поскольку теплота является функцией
процесса.
,
поскольку теплота является функцией
процесса.
2. Изменение энтропии характеризует направление процесса (описано выше).
3. Энтропия – мера неупорядоченности системы.
Степень беспорядоченности можно характеризовать затруднительностью возвращения системы в более упорядоченное состояние: два газа легко смешиваются, но разделение их сложно. После перемешивания энтропия системы возросла, поэтому энтропия является мерой неупорядоченности системы.
4. Энтропия и термодинамическая вероятность.
Состояние газа, определяемое значениями параметров P, V, T, называют макросостоянием. Однако частицы газа находятся в тепловом движении, из-за этого их положения в объеме непрерывно меняются и в каждом положении энергия частицы так же меняется. Совокупность значений координат и импульсов всех частиц называется микросостоянием системы. Одному макросостоянию отвечает множество микросостояний.
Число микросостояний при одном макросостоянии называется термодинамической вероятностью этого макросостояния, W.
W может иметь целочисленные значения от единицы до весьма большого числа.
Согласно формуле Больцмана
![]()
В состоянии равновесия энтропия достигает своего максимального значения, поскольку равновесие есть наиболее вероятное состояние и, следовательно, является макросостоянием, осуществляемым посредством максимального числа микросостояний, т.е. W = max.
В случае идеального кристалла при Т = 0 макросостояние осуществляется только одним микросостоянием, W = 1, S = 0. (S = 0 термодинамически следует из теплового закона Нернста и постулата Планка).
1.2.4 Критерии направленности процессов в реальных системах
Реальные процессы проводятся не в изолированной системе. Поэтому оказалось целесообразным отыскать другие функции состояния, связанные с энтропией, которые могут служить критерием направления процесса и указывать на состояние равновесия не в изолированной системе. Это функции U = f (V, S); H = f (P, S); G = f (P, T) и F = f (V, T).
Наиболее удобными в применении являются функции G и F, энергии Гиббса и Гельмгольца соответственно.
Изобарно-изотермический процесс, т.е. при Р, Т = const.
Процесс идёт в сторону убыли энергии Гиббса, а равновесие наступает при достижении минимального значения энергии Гиббса, т.е.
(ΔG)pt ≤ 0; G = U - TS + PV
Изохорно- изотермический процесс, т.е. при V,T = const
Процесс идёт в сторону убыли энергии Гельмгольца, а равновесие наступает при минимальном значении энергии Гельмгольца:
(F)V,T ≤ 0; F = U – TS
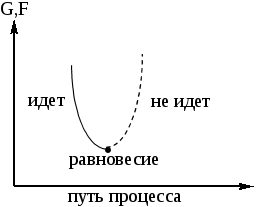
Рисунок 1.6 – Зависимость энергии Гиббса и энергии Гельмгольца от пути процесса
