
- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
2.3 Примеры решения задач
Задача 1
Зависимость температуры плавления нафталина от давления выражается уравнением: tпл = 80,10 + 0,037110-5P(Па) – 186,9910-18Р2 (Па).
Рассчитать изменение объема при плавлении 1 кг нафталина при Р = 1 атм, если его теплота плавления равна 138,6 Дж/г.
Дано:
mнафт. = 1 кг
Нпл. = 138,6 Дж/г
Р = 1 атм = 1,0133105 Па
Vпл. - ?
Решение
![]()
Для фазовых
переходов конденсированных фаз
применяется уравнение:
![]() .
.
Определим сначала
производную
![]() .
Так как Т =t
+ 273,15;
.
Так как Т =t
+ 273,15;
![]() ;
;
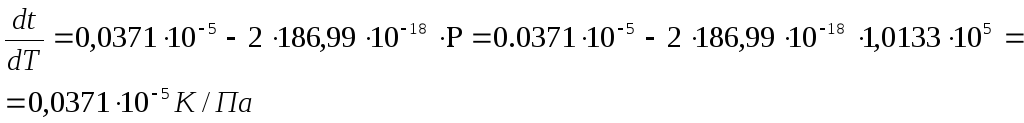
Откуда
![]()
![]()
![]()
![]()
Задача 2
Давление пара хлороформа при 50 0С равно 535 мм. рт. ст., теплота испарения хлороформа 30,836 кДж/моль. Определить нормальную температуру кипения хлороформа.
Дано:
T1=50 0C = 323 К
Р1 = 535 мм. рт. ст.
Р2 = 1 атм. = 760 мм.рт.ст.
Нисп. = 30,836 кДж/моль
Т2 кип. - ?
Решение
Нормальная температура кипения (н.т.к.) – температура кипения при Р = 1 атм.
![]()
Для решения используется уравнение для фазового перехода с участием газов:
![]()
![]()
![]()
Т2 = 333 К
Примечание. В данной задаче теплота испарения в данном температурном интервале принята постоянной, поэтому было использовано уравнение для Н = соnst.
Если же Нисп. = f (Т), то надо использовать дифференциальное уравнение для нахождения Нисп или Нвозг. Поскольку зависимости lnP=f(T) и lnKP=f(T) аналогичны, предлагаем обратиться к решению задачи № 3, в разделе 1.3.7.
2.4 Вопросы для самоконтроля
1. Что называется фазой?
2. Какими точками начинается и заканчивается кривая зависимости давления насыщенного пара жидкости от температуры?
3. Путем анализа уравнения Клапейрона-Клаузиуса объясните, почему давление насыщенного пара над твердой фазой всегда растет при увеличении температуры.
4. Путем анализа уравнения Клапейрона-Клаузиуса объясните, почему с повышением давления температура плавления льда понижается, а ртути – повышается.
5. Сколько термодинамических степеней свободы в тройной точке?
6. Плотность жидкого галлия больше плотности твердого галлия. Как изменится температура плавления этого металла при повышении давления?
7. Как можно осуществить непрерывный переход из жидкого состояния в газообразное, чтобы система все время оставалась однофазной?
8. Чему равно изменение энтропии при переходе жидкости в пар при критической температуре?
9. Можно ли для
расчета теплоты плавления льда
использовать уравнение:
![]()
10. В чем заключается правило Трутона?
2.5 Двухкомпонентные системы
2.5.1 Термический анализ как часть физико-химического анализа
При изучении многокомпонентных систем широко применяется метод физико-химического анализа, сущность которого заключается в исследовании функциональной зависимости между свойствами равновесной химической системы и составом системы. В основе теории современного физико-химического анализа лежат два принципа, введенных Н. Курнаковым, - принцип непрерывности и принцип соответствия, с помощью которых проводится геометрический анализ получаемых химических диаграмм.
Принцип непрерывности: при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных ее фаз изменяются непрерывно; при этом свойства системы, взятой в целом, изменяются тоже непрерывно, но при условии, что не возникают новые фазы и не исчезают имеющиеся.
Принцип соответствия: каждому комплексу фаз, находящихся в данной системе в равновесии, соответствует на диаграмме определенный геометрический образ.
На основании изучения физических свойств, строятся диаграммы в координатах: свойство - состав. По геометрическим особенностям диаграмм можно судить не только о химической природе образующихся веществ, но и о числе, границах, условиях совместного существования разных фаз в системе. Изучаемые свойства могут быть самыми разнообразными - плотность, вязкость, электропроводность, температура начала кристаллизации и т.д. Раздел физико-химического анализа, где в качестве свойства берется температура начала кристаллизации (достижения состояния насыщения раствора каким-либо компонентом), называется термическим анализом. Свойство системы обычно откладывается по оси ординат, а состав по оси абсцисс. Вся ось абсцисс диаграммы принимается за 100 %. Крайние точки оси - чистые компоненты А и В. Любая точка на оси абсцисс изображает состав двухкомпонентной системы. Так, точка "а" на оси (см. рисунок 2.3) отвечает двухкомпонентной системе, в которой отрезок аА дает содержание компонента В, а аВ -содержание компонента А (так называемое "правило рычага").
При перемещении точки "а" к точке "В" увеличивается в системе содержание компонента В, а компонента А - уменьшается.

Рисунок 2.3 – Изображение состава двухкомпонентной системы на диаграмме «свойство – состав»
