
- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
2. Диаграмма с перитектическим превращением
В этом случае образуются твердые растворы, содержащие больше растворенного вещества, чем жидкие растворы, из которых они кристаллизуются. При этом температура начала кристаллизации таких твердых растворов выше температуры кристаллизации вещества, на основе кристаллической решетки которого образуется твердый раствор (можно назвать его растворителем). Это раствор α на рисунке 2.13.
СαВ. > СВжидк Тα > Т0А

Рисунок 2.13 - Диаграмма состояния системы с ограниченной растворимостью в твердом виде при наличии перитектического превращения
Линии ликвидуса Т0Аd и Т0Вd – линии кристаллизации ненасыщенных растворов α и β соответственно. Кристаллы β в этой диаграмме и β в предыдущей – принципиально ничем не отличаются друг от друга: это твердый раствор А в В, где жидкость содержит больше растворенного вещества (А) по сравнению с твердой фазой.
Твердый раствор α (В в А) содержит больше растворенного вещества (В), чем жидкость. Например, для равновесных жидкого раствора «m» и α – твердого раствора «n» СαВ. > СВжидк.
Линия df – перитектическая, здесь происходит кристаллизация α – твердого раствора состава «с» и растворение ранее выпавших кристаллов «β».
Перитектический процесс для систем, попадающих на линию «сf» заканчивается образованием α – твердого раствора и растворением части ранее выпавших β – кристаллов, а избыток β – кристаллов остается.
В области асfb – две фазы: αкр + βкр.
Если же система 1 попадает на участок «dc» - то кристаллы β все растворяются, а в избытке будет жидкая фаза и при дальнейшем ее охлаждении образуются кристаллы α – твердого ненасыщенного раствора (до точки 2). При охлаждении системы от точки 2 до точки 3 система становится однофазной и не меняет своего состава. В точке 3 твердый раствор α становится насыщенным и появляется новая твердая фаза β состава 4. При дальнейшем охлаждении увеличивается количество β – кристаллов, изменяется состав α – кристаллов по линии 3а и β – кристаллов по линии 4b.
2.8.3 Примеры разбора диаграмм
Разобрать диаграмму, используя план разбора диаграмм двухкомпонентных систем.
План разбора диаграммы двухкомпонентной системы
Найти химические соединения, обозначить их, определить состав:
а) устойчивые;
б) неустойчивые.
2. Найти твердые растворы, обозначить области их существования:
а) с неограниченной растворимостью;
б) с ограниченной растворимостью.
Определить, кристаллическая решетка какого компонента сохранена.
Определить и подписать участки линии ликвидуса, где кристаллизуются соединения и твердые растворы.
Определить фазы в областях, прилегающих к этим участкам линии ликвидуса.
Определить наличие эвтектик. Их состав: качественный (что совместно кристаллизуется) и количественный (% А и % В).
Определить перитектические превращения, перитектическую линию. Что кристаллизуется и что растворяется?
Определить монотектические превращения.
Определить фазы во всех других областях.
Для любой точки на диаграмме определить: число фаз; состав фаз; относительное количество фаз; число степеней свободы.
Для раствора любого состава провести охлаждение и уметь изобразить кривую охлаждения.
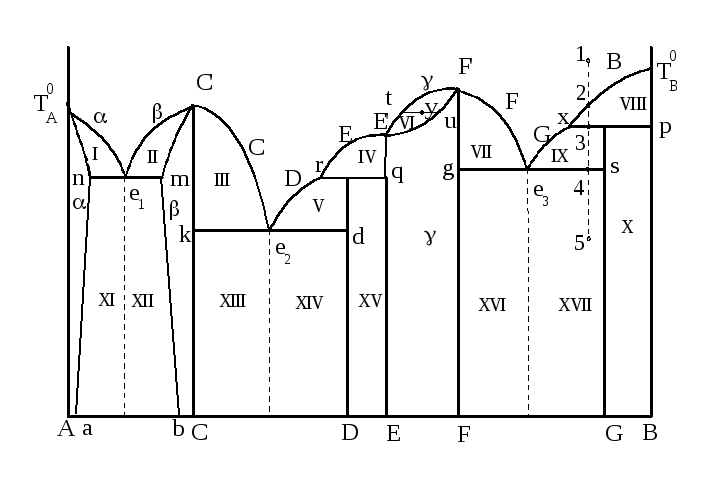
В данной системе есть три устойчивых соединения (С, Е, F) и два неустойчивых (Д, G). Устойчивым отвечают конгруэнтные точки их плавления (СI, ЕI, FI), а неустойчивым – линии разложения соединений при их нагревании (rq и хр). Состав соединений определяется по оси состава (% А и % В).
Есть три области существования твердых растворов:
с неограниченной растворимостью друг в друге веществ Е и F (γ – твердый раствор). Кристаллическая решетка обоих соединений одинакова, эту же решетку имеет и γ –раствор.
два твердых раствора с ограниченной растворимостью – α – твердый раствор с сохранением кристаллической решетки А и β – твердый раствор с сохранением решетки С.
На диаграмме подписаны участки линии ликвидуса и что начинает кристаллизоваться на них.
В областях, прилегающих к этим участкам линии ликвидуса, существует в равновесии две фазы: твердая (смотри пункт 3) и жидкая, отвечающая линии ликвидуса.
В системе есть три эвтектики: е1, е2 и е3. Качественный состав (что совместно кристаллизуется) определяется точками на концах эвтектической линии:
е1 : линия mn; совместно кристаллизуются твердые насыщенные растворы α (состав «n») и β (состава «m»);
е2 : линия кd; кристаллизуются соединения «С» и «Д».
е3 : линия gs; кристаллизуются соединения F и G.
Состав эвтектик (% А и % В) определяется проецированием точек е1, е2 и е3 на ось состава.
Перитектические превращения происходят при охлаждении растворов на перитектических линиях rq и xp.
На линии rq кристаллизуется неустойчивое «Д», что приводит к растворению ранее выпавших (в области IV) кристаллов Е.
На линии xp кристаллизуется неустойчивое соединение «G», что вызывает растворение ранее выпавших (в области VIII) кристаллов В.
Монотектических превращений нет.
В областях ниже эвтектических линий находятся по две твердые фазы: ниже линии mn – α и β твердые растворы; кd – твердые С и Д; gs – соединения F и G. Эти фазы могут быть либо в чистом виде, либо входить в состав эвтектики.
Так в области XI – α + Э (α + β)
XII - β+ Э (α + β)
XIII – С + Э (С + Д)
XIV – Д + Э (С + Д)
В области XV две твердые фазы Д и Е, в области Х – две твердые фазы G и В.
9. Для точки «у» в области VI: число фаз – две (твердый раствор γ состава «u» и жидкий раствор состава «t»). Проецируя точки «u» и «t» на ось состава, находим % А и % В в этих фазах.
Относительное количество фаз определяется по конноде «tu», которая берется за 100 %:
![]()
Число степеней свободы рассчитывается по правилу фаз Гиббса: С= К-f+n = 2-2+1=1. Система моновариантна.
10. Проведем охлаждение раствора 1.
От точки 1 до 2 идет охлаждение жидкой системы без фазовых превращений.
От 2 до 3 – кристаллизуется В, при этом состав жидкости меняется от точки 2 до х. В точке 3 - перитектическое превращение: образование G и растворение В; состав жидкой фазы не меняется (точка х). По окончании процесса остается в избытке жидкая фаза.
От точки 3 до 4 – кристаллизуется G, состав жидкой фазы изменяется от точки х до е3.
В точке 4 – эвтектический процесс, совместная кристаллизация F и G.
Ниже точки 4 – охлаждение системы (F + G) без фазовых превращений.
На любой диаграмме двухкомпонентных систем горизонтальные линии отвечают равновесию трех фаз (одна жидкая и две твердые); такие системы инвариантны (С = 0). На кривых охлаждения это отразится в виде горизонтальных участков (Т = const). На рассмотренной диаграмме таких пять линий: mn, rq, gs, sp, kd.
