
- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
1.1.8 Примеры решения задач
Решая задачу, следует записать кроме полного условия и краткое, где четко обозначить, к какому компоненту относится данная величина, к какому состоянию, в каких единицах выражена величина, при необходимости перевести в систему СИ. При использовании справочных данных внимательно смотреть на название столбца или строки таблицы. Например, название столбца «b•103 », а число в этом столбце равно 3,45, то есть b•103 = 3,45, отсюда b = 3,45•10-3.
Задача 1
Какое количество теплоты необходимо для того, чтобы 2 кг воды, взятых при 25 °С, испарить при Р = 1 атм?
Дано:
m (H20) = 2,0 кг
t1 = 25 °C; Т1 = 298 К
t2=127 °C;T2 = 400 K
Н исп(Н20) = 40,59 кДж/моль = 40,59 .103 Дж/моль
Р = 1 атм
Q = ?
Решение
Процесс состоит из двух стадий:
1 - нагревание воды от 298 К до температуры кипения при 1 атм, т.е. до 373 К;
2 - испарение воды при 373 К и 1 атм.
Поскольку теплота испарения и теплоемкость в справочнике -молярные, следует рассчитать количество взятой воды в молях:
![]()
Q
= n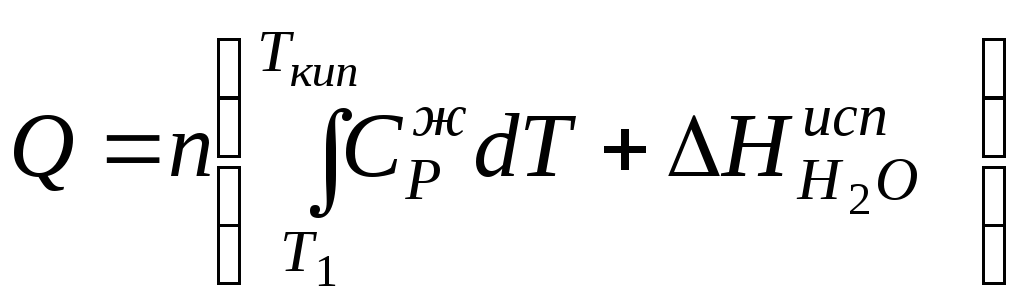
Из справочника находим коэффициенты интерполяционного уравнения
CP = a + вT + cT2 и подставляем в уравнение для Q
|
|
a |
b•103 |
c•106 |
|
Н2О |
39,2 |
76,64 |
11,96 |
а = 39,2 b = 76,63•10-3 с = 11,96•10-6
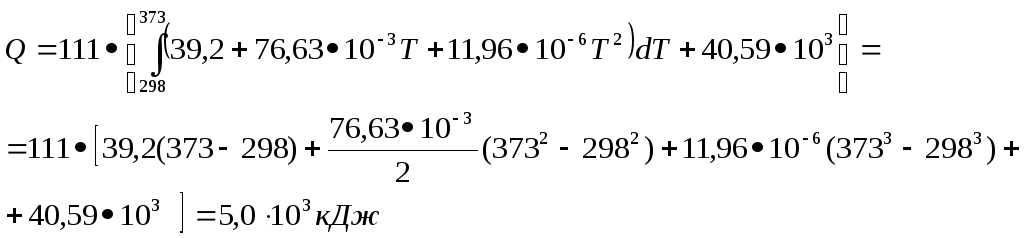
Задача 2
При 298 К 100 г кислорода сжимается адиабатически от 8,2 л до 5,1 л. Определить конечную температуру, работу сжатия, изменение энтальпии.
Дано:
m(O2) = 100 г
Т1 = 298 К
V1 = 8,2 л = 8,2.10-3 м3
V2 = 5,l л = 5,1.10 -3м3
T2 = ? H = ? W = ?
Решение
Из таблицы выбираем уравнение для расчета работы для адиабатического процесса, исходя из данных в условии задачи. Подходящим уравнением будет следующее:
![]()
![]()


![]()
W = -4,0 103 Дж
Конечную температуру находим, используя уравнение состояния
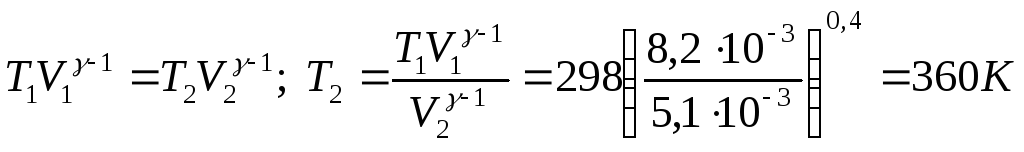
Изменение энтальпии не зависит от изменения давления или объема, а определяется лишь изменением температуры.
Примем Ср
= const
=
![]() R
= 3,5·8,31 =29,1 Дж/моль
R
= 3,5·8,31 =29,1 Дж/моль
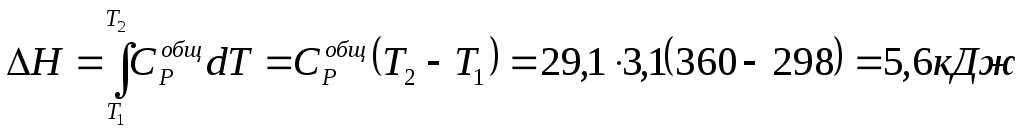
Задача 3
Вычислить тепловой эффект реакции
![]()
при 700 К : а) при постоянном давлении; б) при постоянном объеме.
Решение![]()
Тепловой эффект реакции находим, используя уравнение Кирхгофа. Будем решать двумя способами:
1. Без учета зависимости теплоемкости от температуры, т. е. СР = const = C0p 298
![]()
ΔН298 найдем из теплот образования, взятых в справочнике.
Н298
=
ni
![]() -
ni
-
ni![]() =
=
![]()
![]()
= -985,12 + 226,75 – (-59,83) – 2(-285,83) = 126,9 кДж = 126·103 Дж
![]()
Н700= 126,9·103 – 81,9(700 - 298) = 93,1·103 Дж
Теплоты при постоянном давлении и при постоянном объеме связаны соотношением:
QP = QV + Wрасш.
Н = U + Wрасш.
U = Н - Wрасш. = Н - n RT
n рассчитываем из реакции, учитывая только газообразные вещества,
n = n2 - n1 = 1 - 0 = 1
U = 93,1·103 – 8,31·700 = 87,2·103 Дж
2. С учетом зависимости теплоемкости от температуры.
Составим таблицу по справочным данным для конечных веществ и для начальных с учетом стехиометрических коэффициентов.
|
Вещество |
|
Коэффициенты уравнения Ср =f (T) | ||||
|
а |
b•103 |
сl•10-5 |
c•106 | |||
|
Конечные вещества |
Cа(ОН)2 |
- 985,12 |
105,19 |
12,01 |
-19,00 |
- |
|
С2Н2 |
+226,75 |
26,4 |
66,65 |
- |
- 26,48 | |
|
Исходные вещества |
СаС2 |
- 59,83 |
68,62 |
11,88 |
- 8,66 |
- |
|
2·Н2О |
-2·285,83 |
2·39,02 |
2·76,64 |
- |
2·11,96 | |
|
|
|
ΔНреак.=126,88 кДж = 126,9·103Дж |
Δа = -15,03 |
Δb = - 6,5•10-3 |
ΔсI = -10,34•105 |
Δс = 50,4•10-6 |
Полученные величины подставляем в уравнение 1.7.

