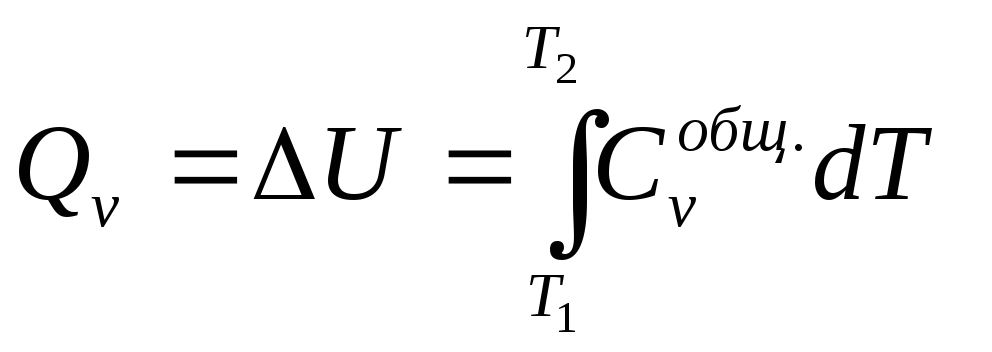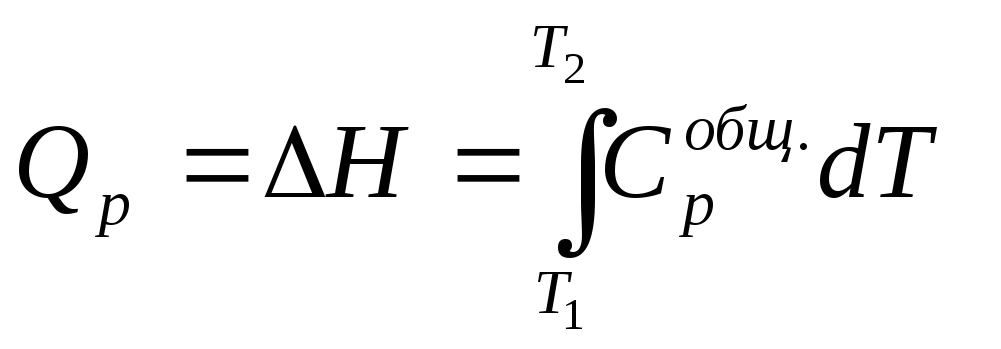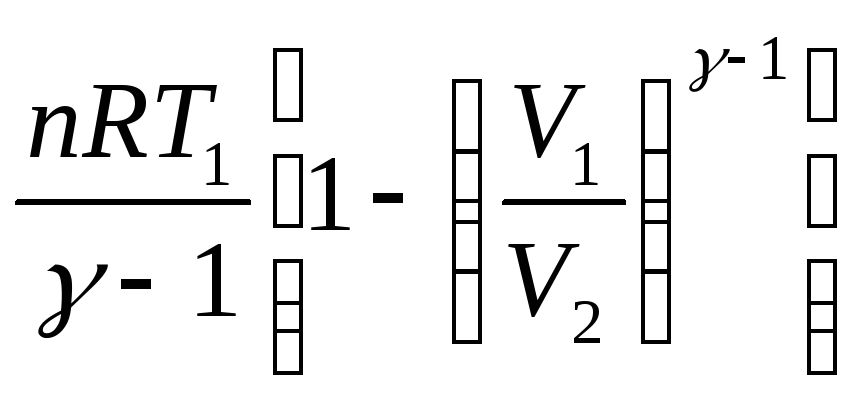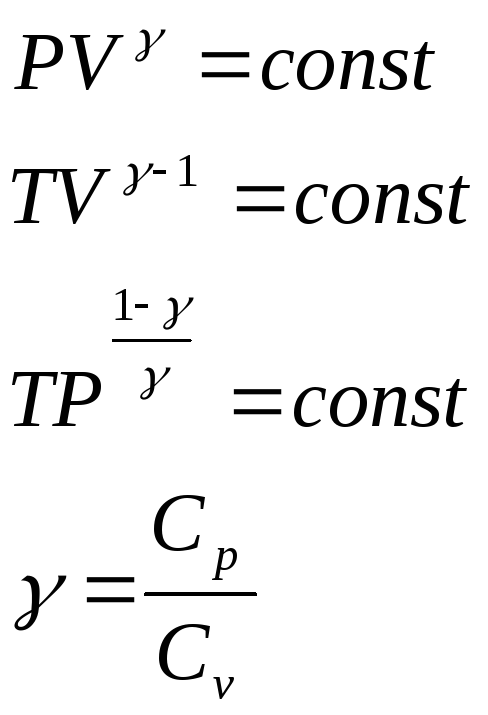- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
1.1.4 Работа и теплота термодинамических процессов
Приводим таблицу уравнений для расчета работы и теплоты в различных процессах. Здесь также приводятся уравнения состояния идеального газа ряда процессов, которые бывают очень полезны при нахождении параметров состояния при переходе из одного состояния в другое.
Так, уравнение изотермы РV = const. Это значит, что при Т = const при изменении состояния газа:
Р1V1 = Р2V2 = Р3V3…
Таблица 1.2 - Работа расширения идеального газа и теплота различных процессов
|
Процесс |
Работа |
Теплота |
Уравнение cостояния |
|
1 |
2 |
3 |
4 |
|
Изохорический V, n = const |
0 |
|
|
|
Изобарический P, n = const |
|
|
|
|
Изотермический T, n = const |
|
Q = W |
PV = const |
Продолжение таблицы 1.2
|
1 |
2 |
3 |
4 |
|
Адиабатический |
|
Q = 0 |
|
|
Изобарно – изо-термический Р,Т=сonst (химическая реак-ция или фазовые превращения) |
Работа
химической реакции или фазового
превращения с изменением числа молей
газообразной фазы:
|
Теплота химической реакции или фазового перехода, ΔН |
|
1.1.5 Типы тепловых эффектов
Для термохимических расчетов необходимо, чтобы все тепловые эффекты были отнесены к реагентам и продуктам в стандартном состоянии. Стандартное состояние вещества - это наиболее термодинамически устойчивая форма при давлении 1 атм, температуре 298,15 К.
Стандартная теплота образования H°f - тепловой эффект образования одного моля любого вещества из простых веществ, при стандартных условиях.
![]()
В связи с этим, теплоты образования простых веществ равны нулю, поскольку они отвечают реакциям

Однако, теплоты реакций
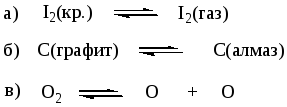
не равны нулю, так как являются теплотами процессов: агрегатного превращения (а), полиморфного превращения (б), диссоциации (в).
Стандартной теплотой образования иона в водном растворе называется теплота образования одного моля гидратированного иона в растворе с молярной концентрацией иона, равной единице, из простых веществ при стандартных условиях. При этом теплота образования иона водорода условно принята равной нулю.
С(графит) + 3/2О2 (газ) + аq + 2е → СО32-·аq, ΔНf (CO32-aq)
Стандартная теплота сгорания Н°сгор. - это теплота сгорания одного моля органического соединения при стандартных условиях до СO2, Н2O, SO2, N2. Если продукты сгорания, кроме СO2 и Н2O, есть и другие, это оговаривается в каждой реакции особо. Пример:
![]()
Теплоты сгорания водорода и углерода совпадают с теплотами образования Н2О и СО2, так как это тепловые эффекты реакций
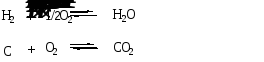
Стандартная теплота фазовых превращений - это теплота превращения одного моля вещества при температуре перехода при Р = 1 атм. Сюда относятся теплоты плавления, испарения, возгонки (сублимации), полиморфных превращений.
Интегральной теплотой растворения Нm называют тепловой эффект растворения с образованием раствора определенной концентрации при расчете на один моль растворенного вещества.
Теплота растворения газов обычно близка к теплоте их конденсации, а твердых веществ с атомной или молекулярной кристаллической решеткой - к теплоте плавления.
Более сложные процессы происходят при растворении электролитов. Теплоты растворения электролитов являются алгебраической суммой двух основных тепловых эффектов: поглощения теплоты при разрушении кристаллической решетки с удалением образовавшихся ионов на расстояния, отвечающие объему раствора, и выделения теплоты при сольватации (гидратации) каждого иона молекулами растворителя. Оба эффекта достигают сотен килоджоулей на моль. Алгебраическая сумма их - наблюдаемая теплота растворения - имеет порядок единиц и десятков килоджоулей. Знак суммарного эффекта зависит от того, какое из слагаемых больше по абсолютной величине.
Теплота гидратообразования - это теплота, выделяющаяся при присоединении к одному молю безводной соли кристаллизационной воды. Ее определяют из интегральных теплот растворения безводной соли и кристаллогидрата в таких количествах воды, чтобы полученный раствор имел бы одинаковую концентрацию. Например, получить водный раствор MgCl2 можно двумя путями:
1 - растворением безводной соли MgCl2
2 - растворением в воде кристаллогидрата MgCl2•6H20, предварительно полученного из MgCl2 и воды.

Из данной схемы по закону Гесса можно получить теплоту гидратообразования:
Н гидр = Hm(MgCl2) - Hm (MgCl2 .6H20)
Теплота нейтрализации. Опыт показывает, что в случае разбавленных растворов теплота реакции нейтрализации молярной массы эквивалента сильной кислоты (НС1, H2S04 и др.) сильным основанием (NaOH, КОН) не зависит от природы кислоты или основания. Это объясняется тем, что протекает только одна химическая реакция
![]()
Hнейтр. = -55,9 кДж/моль
При нейтрализации разбавленного раствора слабой кислоты или основания наблюдаемая теплота нейтрализации может быть меньше или больше за счет теплоты диссоциации. Теплота диссоциации складывается из теплоты, поглощаемой при распаде молекулы на ионы и теплоты гидратации (сольватации) ионов молекулами растворителя и потому может быть как положительной, так и отрицательной. Таким образом, теплота нейтрализации слабых кислот и оснований равна
Ннейтр. = - 55,9 + Ндисс.
Закон Гесса
Г.И. Гесс в 1836 г. еще до того, как было сформулировано l начало термодинамики (1842), экспериментально открыл основной закон термохимии:
«Тепловой эффект реакции не зависит от промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.»
При этом процесс должен протекать термодинамически необратимо, а получаемые продукты иметь ту же температуру, что и исходные вещества.
Этот закон может быть более строго получен на основании первого начала термодинамики. Пусть единственным видом работы является работа преодоления внешнего давления (отсутствует работа против магнитных, электрических и прочих сил). Тогда уравнение (1.2) примет вид:
![]()
При изохорном процессе V = const, dV = 0.
![]()
![]()
При изобарном процессе Р = const
![]()
где
![]()
![]()
Так как теплота процесса в общем случае зависит от пути процесса, а ΔU и ΔH не зависят (поскольку и внутренняя энергия и энтальпия являются функциями состояния), следовательно теплоты процесса в частных случаях при V = const или при Р = const также не зависят от пути процесса. Таким образом, термодинамически более строгой формулировкой закона Гесса будет являться следующая:
«Максимальная теплота реакции, проведенной в изобарных либо в изохорных условиях, когда единственной работой является работа против сил внешнего давления, не зависит от промежуточных реакций, а лишь от начальных и конечных веществ и их состояний».