
- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
1.2.8 Примеры решения задач
Задача 1
Рассчитать изменение энтропии при смешении 200 м3 азота при 700 К и 500 м3 гелия при Т = 300 К при Р = I атм.
Дано:
V(N2) = 200 м3 ; V(He) = 500 м3 ;
Т (N2) = 700 К; Т (He) = 300 К
Р = 1 атм
S = ?
Решение
Расчет
S
смешения производится по уравнению S
=
- R![]() .
.
Это уравнение можно использовать, если давление и температура обоих газов одинаковы. В данном случае давления равны, а температура при смешении газов будет выравниваться, поэтому необходимо найти температуру смеси Тх. При смешении температура азота уменьшается, то есть азот передает какое-то количество теплоты гелию, а гелий принимает эту теплоту и повышает свою температуру. По абсолютной величине количество теплоты одно и то же, но знаки разные, поэтому, чтобы составить уравнение теплового баланса, следует одну из теплот взять с обратным знаком, то есть Q (N2) = - Q (Не)
Примем Ср = const и рассчитаем по классической теории. Молярная теплоемкость для двухатомных газов Ср = 7/2 R , для одноатомных Ср = 5/2 R, Дж/моль·К; R = 8,31 Дж/моль·К;
![]() Дж/К
Дж/К
![]() Дж/К
Дж/К
![]() 20,3•103
моль
20,3•103
моль
![]() моль
моль
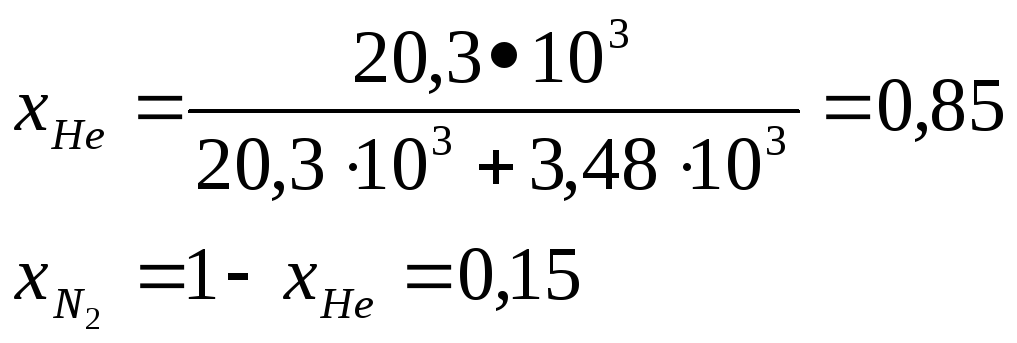
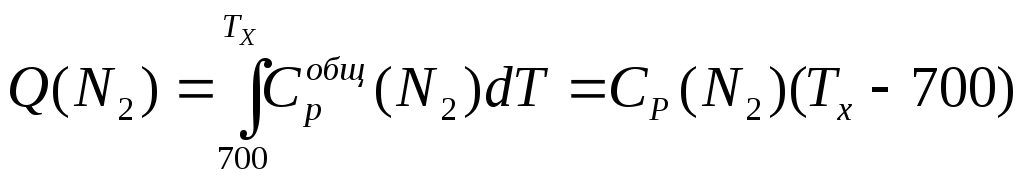

101.103(Tx-700) = -422•103(Tx-300)
Tx= 377 К
При выравнивании температур произошло изменение энтропии азота и гелия
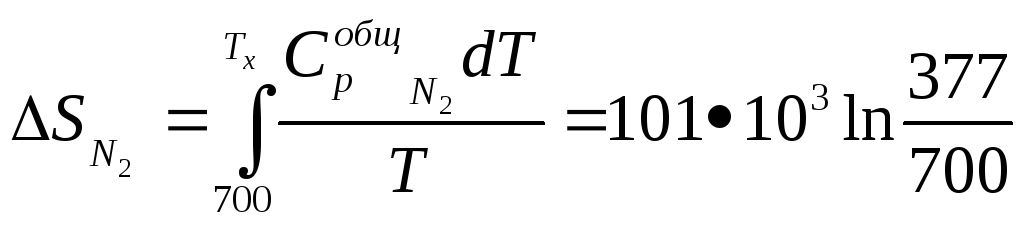 =
-62,5•.103
Дж/К
=
-62,5•.103
Дж/К
 Дж/К
Дж/К
Теперь рассчитываем изменение энтропии при смешении
![]()
Общее изменение энтропии системы равно сумме изменений энтропии всех стадий процесса
S = -62,5• 103 +530•103 + 82,3•103 = 549•103 Дж/К
Задача 2
Рассчитать S реакции 2 S02 + 02 = 2 S03 при стандартных условиях. Можно ли сделать вывод о возможности окисления S02 кислородом в этих условиях?
Решение
![]()
Значения
абсолютных значений энтропии берем из
справочника
![]() Дж/моль.К;
Дж/моль.К;
![]() Дж/моль.К;
Дж/моль.К;
![]() =205,04 Дж/моль.К
=205,04 Дж/моль.К
![]() .
= - 187,8
Дж/К
.
= - 187,8
Дж/К
Полученное значение нельзя использовать для определения возможности процесса, так как реакция идет при стандартных условиях, то есть при Р и Т = const, а не в изолированной системе.
При Р и Т = const
следует рассчитать значение
![]() .
.
![]() =
=![]()
![]()
Поскольку изменение энергии Гиббса меньше нуля, следовательно, реакция в прямом направлении пойдет.
1.2.9 Вопросы для самоконтроля
1. Какой процесс является термодинамически обратимым? Пояснить различие понятий «обратимый» и «обратный».
2. Сформулировать второе начало термодинамики.
3. Записать математическое выражение второго начала термодинамики: в общем случае и для изолированной системы.
4. Записать объединенное уравнение первого и второго начал термодинамики.
5. К какому значению стремится энтропия правильно образованного кристалла при приближении к абсолютному нулю?
6. В каком соотношении находятся энтропии трех агрегатных состояний одного вещества – пара, жидкости, твердого тела?
7. Изменение энтропии какого процесса будет наибольшей: возгонки, испарения, плавления?
8. При изобарно-изотермическом процессе ∆F<0,∆G>0. В каком направлении возможен процесс?
9. Расчет по справочным данным ∆Sо298 и ∆Gо298 для реакции
СО + ½ О2 ![]() СО2
дает
дает для обеих величин отрицательные
значения. Будет ли окисляться СО
при стандартных условиях?
СО2
дает
дает для обеих величин отрицательные
значения. Будет ли окисляться СО
при стандартных условиях?
10. При нагревании одного моля газа изменение энтропии какого процесса будет больше: изобарического или изохорического?
