
- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
1.1.2 Первое начало термодинамики
Первое начало термодинамики – частный случай закона сохранения и превращения энергии в применении к процессам, сопровождающимся выделением, поглощением или преобразованием теплоты. Первое начало термодинамики можно сформулировать так:
«Тепло, подводимое к системе, расходуется на изменение внутренней энергии и совершение системой работы против внешних сил».
Q = ΔU + W (1.1)
Для бесконечно малого изменения состояния системы математическое выражение первого закона термодинамики примет вид:
δQ = dU + δW (1.2)
где dU – изменение внутренней энергии системы.
δW = PdV + δWx – сумма работы по преодолению внешнего давления PdV и, так называемой, полезной работы δWx.
В изолированной системе Q = 0 и W = 0, следовательно, ΔU = 0, а
U = const. Формулировка первого начала термодинамики для изолированной системы:
«Запас внутренней энергии в изолированной системе постоянен».
1.1.3 Теплоемкость
При сообщении
системе теплоты δQ
ее температура изменяется на dT.
Величина
![]() называется теплоемкостью.
называется теплоемкостью.
Теплоемкость - это количество теплоты, затрачиваемое для повышения температуры тела на один кельвин.
Теплоемкость,
отнесенная к массе тела, называется
удельной, С,
![]() .
Теплоемкость одного моля вещества,
называется молярной, С,
.
Теплоемкость одного моля вещества,
называется молярной, С,![]() .
Теплоемкость зависит от условий, в
которых телу сообщается теплота и
измеряется его температура. Теплоемкость
при постоянном объеме равна
.
Теплоемкость зависит от условий, в
которых телу сообщается теплота и
измеряется его температура. Теплоемкость
при постоянном объеме равна
![]() ,
а при постоянном давлении
,
а при постоянном давлении
![]() .
.
Теплоемкость газов
Внутренняя энергия системы складывается из энергии поступательного, вращательного движения и энергии колебаний (кинетической и потенциальной) частиц:
![]()
На одну степень
свободы приходится энергия, равная
![]() (для одной молекулы) или
(для одной молекулы) или
![]() (для одного моля), поскольку
(для одного моля), поскольку![]()
Если молекула
имеет i
степеней свободы, то
![]() ,
а
,
а![]() .
.
По уравнению Майера
![]() (1.3)
(1.3)
Для одноатомных идеальных газов имеются лишь три степени свободы поступательного движения в координатах x, y, z:
![]() ;
;
![]() .
.
Для двухатомных идеальных газов и линейных многоатомных добавляется еще 2 степени свободы вращательного движения и, если молекула нежесткая, 2 степени свободы колебательного движения:
![]() ;
;
![]() - для жестких молекул (без учета колебаний).
- для жестких молекул (без учета колебаний).
Для многоатомных жестких добавляется третья степень свободы вращательного движения:
![]() ;
;
![]()
Несмотря на простоту, эти соотношения дают хорошее совпадение с экспериментом для одноатомных и многих двухатомных молекул при комнатной температуре. Но для многоатомных и ряда двухатомных молекул совпадений нет из-за неучтенного влияния на теплоемкость колебаний атомов в молекуле. Для реальных газов поступательная и вращательная составляющие могут быть вычислены с достаточной точностью из уравнений, приведенных выше, а для вычисления колебательной части теплоемкости требуется применение квантовой теории.
Эксперимент показал также зависимость теплоемкости от температуры, что находится в противоречии с формулами. Эмпирическую зависимость теплоемкости газов от температуры получают в виде интерполяционного уравнения:
![]() или
или
![]()
![]() (1.4)
(1.4)
Для органических и неорганических веществ, соответственно.
где а, в, с, сl – константы, применяемые в определенном интервале температур (берутся из справочника).
Теплоемкость твердых тел
Еще в 19 веке было установлено эмпирическое правило (закон Дюлонга и Пти), согласно которому:
«Молярная
изобарная теплоемкость Ср
при комнатных и более высоких температурах
для различных простых веществ в
кристаллическом состоянии одинакова
и равна приблизительно 26
![]() .»
.»
Многие элементы
действительно имеют теплоемкость,
равную
![]() 25…28
25…28![]() ,
однако известно немало отступлений:
так Ср(В)
= 11,3
,
однако известно немало отступлений:
так Ср(В)
= 11,3
![]() ;
Ср(Si)
= 15,9
;
Ср(Si)
= 15,9
![]() ;
Ср(алмаз)
= 7,6
;
Ср(алмаз)
= 7,6
![]() .
.
Для расчета молярной теплоемкости сложных кристаллических веществ Нейманном и Коппом предложено правило аддитивности, согласно которому:
«Молярная теплоемкость химических соединений равна сумме молярных теплоемкостей элементов, входящих в данное соединение.»
Принимая во внимание, правило Дюлонга и Пти, можно написать:
![]() ,
,
![]() ,
,
где n – число атомов в молекуле.
У ряда неметаллов
молярная теплоемкость значительно ниже
26
![]() ,
что следует учитывать при расчете Ср
сложных веществ. Величина вклада в
молярную теплоемкость сложных веществ,
приведена ниже, в таблице 1.1.
,
что следует учитывать при расчете Ср
сложных веществ. Величина вклада в
молярную теплоемкость сложных веществ,
приведена ниже, в таблице 1.1.
Таблица 1.1 – Эмпирические данные для вычисления теплоемкости
|
элемент |
С |
Н |
В |
Si |
O |
F |
P |
S |
|
Cр,
|
7,6 |
9,6 |
11,3 |
15,9 |
16,8 |
21,0 |
22,6 |
22,6 |
У твердых веществ наблюдается также зависимость теплоемкости от температуры:
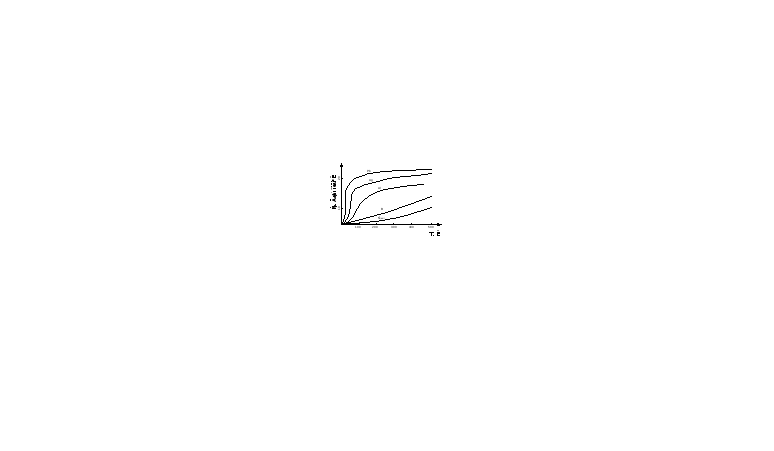
Рисунок 1.1 – Зависимость теплоемкости твердых тел от температуры
Зависимость теплоемкости твердых органических и неорганических веществ как и газов (формула 1.4) от температуры может быть представлена в виде эмпирических уравнений:
![]() или
или
![]()
где а, в, с, сl – константы, применяемые в определенном интервале температур.
При очень низких температурах теплоемкость зависит от температуры по уравнению Дебая (закон кубов Дебая):
![]()
Для расчета средней теплоемкости в интервале температур Т1 – Т2 используется уравнение:
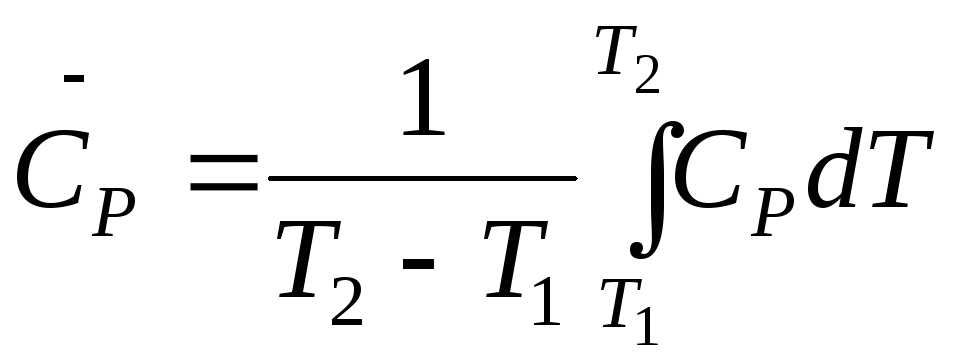
где СР берется в виде уравнения (1.4).
Для веществ с атомной кристаллической решеткой изобарная и изохорная молярные теплоемкости связаны уравнением:
![]()
Но без большой
погрешности при расчетах можно принять
![]() для твердых веществ.
для твердых веществ.
По свойству аддитивности можно рассчитывать теплоемкость сплавов:
1. для молярной теплоемкости
![]()
где
![]() -
молярная теплоемкость компонентов
сплава; Хi
– молярная доля компонента в сплаве.
-
молярная теплоемкость компонентов
сплава; Хi
– молярная доля компонента в сплаве.
2. для удельной теплоемкости
![]()
где
![]() -
удельная теплоемкость компонентов
сплава;Wi
– массовая доля компонента в сплаве.
-
удельная теплоемкость компонентов
сплава;Wi
– массовая доля компонента в сплаве.
