
- •Министерство образования и науки
- •Предисловие авторов
- •Содержание
- •1 Химическая термодинамика
- •1.1 Первое начало термодинамики
- •1.1.1 Основные понятия и определения
- •1.1.2 Первое начало термодинамики
- •1.1.3 Теплоемкость
- •1.1.4 Работа и теплота термодинамических процессов
- •1.1.5 Типы тепловых эффектов
- •1.1.6 Способы определения тепловых эффектов при постоянной температуре
- •1.1.7 Зависимость теплового эффекта реакции от температуры
- •1.1.8 Примеры решения задач
- •1.1.9 Вопросы для самоконтроля
- •1.2 Второе начало термодинамики
- •1.2.1 Основные понятия и определения
- •1.2.2 Математическое выражение
- •1.2.3 Изменение энтропии как критерий обратимости и необратимости процессов
- •1.2.4 Критерии направленности процессов в реальных системах
- •1.2.5 Расчет изменения энтропии в различных процессах
- •1.2.6 Фугитивность и коэффициент фугитивности реальных газов
- •1.2.7 Химический потенциал идеального и реального газа
- •1.2.8 Примеры решения задач
- •1.2.9 Вопросы для самоконтроля
- •1.3 Химическое равновесие
- •1.3.1 Закон действующих масс
- •1.3.2 Способы выражения константы равновесия
- •1.3.3 Выражение состава равновесной смеси
- •1.3.4 Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
- •1.3.5 Мера химического сродства. Направление самопроизвольного протекания химической реакции
- •1.3.6 Методы определения константы равновесия при различной температуре (из справочных данных)
- •1. Из термодинамических свойств веществ:
- •4. Из логарифмов констант равновесия реакций образования некоторых веществ, lgKaf.
- •1.3.7 Примеры решения задач
- •1.3.8 Вопросы для самоконтроля
- •2 Фазовые равновесия
- •2.1 Основные понятия и определения
- •2.2 Однокомпонентные системы
- •2.3 Примеры решения задач
- •2.4 Вопросы для самоконтроля
- •2.5 Двухкомпонентные системы
- •2.5.1 Термический анализ как часть физико-химического анализа
- •2.5.2 Равновесие раствор – кристаллический компонент
- •2.5.3 Кривые охлаждения
- •2.5.4 Диаграмма плавкости двухкомпонентной системы с простой эвтектикой
- •2.6 Диаграммы состояния с образованием химического соединения
- •2.6.1 Определение состава фаз и относительного количества фаз
- •2.6.2 Диаграмма состояния системы с устойчивым химическим соединением
- •2.6.3 Диаграмма состояния системы с неустойчивым химическим соединением (с перитектическим превращением)
- •2.7 Диаграмма состояния с ограниченной растворимостью в жидком состоянии (с монотектическим превращением)
- •2.8 Твердые растворы
- •2.8.1 Диаграмма состояния с полной растворимостью в жидком и твердом состоянии
- •2.8.2 Диаграмма состояния с ограниченной растворимостью в твердом виде
- •1. Диаграммы с эвтектическим превращением
- •2. Диаграмма с перитектическим превращением
- •2.8.3 Примеры разбора диаграмм
- •2.8.4 Вопросы для самоконтроля
- •Литература
1.1.6 Способы определения тепловых эффектов при постоянной температуре
Все способы определения тепловых эффектов реакции основаны на законе Гесса. Применение закона Гесса основано на том, что с термохимическими уравнениями можно оперировать так же, как с алгебраическими.
Термохимические уравнения – уравнения реакций, для которых указываются числовые значения тепловых эффектов.
Они могут быть записаны двумя способами:
N2 + 3H2 = 2 NH3 – 91,88 кДж или
N2 + 3H2 = 2 NH3, ΔН = - 91,88 кДж
Наиболее распространенными способами определения тепловых эффектов являются следующие:
1. Непосредственно из закона Гесса

Можно выделить два пути перехода из графита в С02:
- сгоранием Cграфита,:
- через образование Cалмаза и далее сгорания Салмаза. Теплоты для разных путей равны
Н1 = Нх + Н2
Нх = Н1 - Н2
2. Из теплот образования
Нреак.
=
ni
Н0f
(кон) -
ni
Н0f(нач)![]()
3. Из теплот сгорания
Нреак.
=
ni
Н0сг(нач)
-
ni
Н0сг(кон)![]()
4. Комбинированием.
Рассмотрим применение этого метода на примере.
Н![]() айти
теплоту реакции
айти
теплоту реакции
если известны тепловые эффекты реакций:
|
|
|
Реакции (а) и (б) следует переписать так, чтобы вещества в них находились в той части уравнения, в которой они присутствуют в искомом уравнении. То есть, если в искомом уравнении в левой части находятся С и О2, а в правой СО, то и в уравнениях (а) и (б) они должны находиться там же. Уравнение (а) этому соответствует, его не изменяем, а уравнение (б) переписываем, меняя местами компоненты:

Сложением этих уравнений мы пытаемся получить искомое уравнение. Но в уравнении (б) в правой части 2СО, а в искомом СО, значит все (б) уравнение надо умножить на 1/2, получим уравнение б':
![]()
Складываем теперь уравнения (а) и (б'), взаимно уничтожая С02, получаем
![]()
Сравнивая полученное уравнение с искомым, видим, что
НХ = Н1 - 1/2Н2
1.1.7 Зависимость теплового эффекта реакции от температуры
Приведенные ранее способы расчета тепловых эффектов применимы для определения Н при постоянной температуре (чаще всего стандартной, 298 К).
При температурах, отличных от стандартной, используют уравнение Кирхгофа.
В дифференциальном виде оно имеет вид,
![]() (1.5)
(1.5)
где
![]() есть
разность между суммарными теплоемкостями
продуктов реакции
(конечных веществ) и исходных веществ
(начальных).
есть
разность между суммарными теплоемкостями
продуктов реакции
(конечных веществ) и исходных веществ
(начальных).
Анализ уравнения (1.5)
1.
Если СР
>0, то первая производная![]() >
0, следовательнофункция
Н
растет с ростом температуры, то есть
тепловой эффект
возрастает, независимо от знака самого
теплового эффекта (рисунок 1.2 а).
>
0, следовательнофункция
Н
растет с ростом температуры, то есть
тепловой эффект
возрастает, независимо от знака самого
теплового эффекта (рисунок 1.2 а).
2.
Если СР
< 0, то первая производная
![]() ,
следовательно,функция
Н
убывает с ростом температуры.
,
следовательно,функция
Н
убывает с ростом температуры.
3.
Если СР=
0, то первая производная
![]() .
В этом случае Н
= const,
то есть не зависит от температуры. Если
.
В этом случае Н
= const,
то есть не зависит от температуры. Если
![]() при одной температуре, то при этой
температуре будет экстремум (рисунок
1.2 б).
при одной температуре, то при этой
температуре будет экстремум (рисунок
1.2 б).
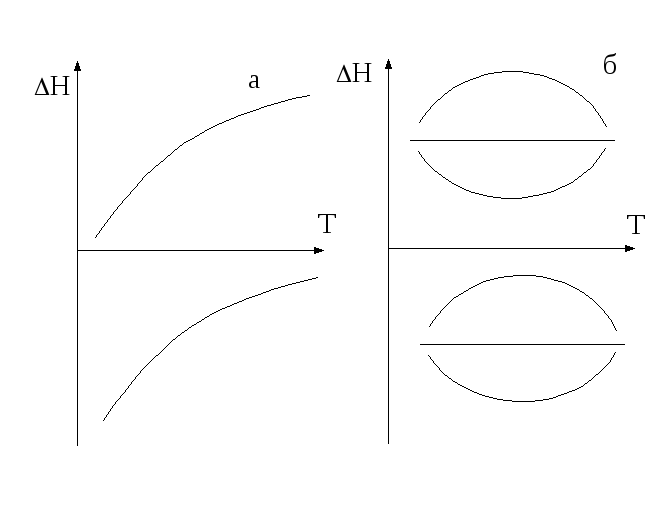
Рисунок 1.2 – Зависимость теплового эффекта от температуры
Интегрирование уравнения Кирхгофа приводит к уравнению, позволяющему рассчитать тепловой эффект реакции при любой температуре:
 (1.6)
(1.6)
где Н2 - тепловой эффект реакции при любой температуре; H1 - тепловой эффект реакции при Т1, рассчитанный одним из ранее приведенных способов; Ср - разность между суммарными теплоемкостями продуктов реакции и исходных веществ.
Расчет интеграла в уравнении 1.6 возможен с разной степенью точности:
1.
![]()
![]()
Это возможно в случае небольшого температурного интервала, а также в случае больших значений теплового эффекта, когда температурной зависимостью можно пренебречь.
2.
![]()
![]()
Если
значение
![]() в данном температурном интервале
неизвестно, можно принять
в данном температурном интервале
неизвестно, можно принять![]() .
.
3.
![]() .
Обычно эта зависимость может быть
получена из интерполяционных уравнений
для Ср
(1.4):
.
Обычно эта зависимость может быть
получена из интерполяционных уравнений
для Ср
(1.4):
∆Ср = ∆а + ∆вТ +∆сТ2 + ∆сlТ -2 (1.7)
где
![]() ;
Δв, Δс, Δсl
находятся аналогично.
;
Δв, Δс, Δсl
находятся аналогично.
Подстановка уравнения 1.7 в уравнение 1.6 и интегрирование дает развернутое уравнение Кирхгофа:
![]() (1.8)
(1.8)
Анализ температурной зависимости ΔН = f(T)
1. Исследование на экстремум.
Признаком
существования экстремума является
обращение в нуль первой производной
исследуемой функции ΔН = f
(T),
т.е.
![]() по уравнению (1.8).
по уравнению (1.8).
Из уравнения Кирхгофа:
![]() (1.9)
(1.9)
Приравнивая к нулю
полученное выражение, рассчитывается
температура, при которой производная
обращается в нуль. Приближенно можно
ограничиться двумя слагаемыми в уравнении
(1.9), т.е.
![]() .
.
Если Т > 0 и ее значение лежит в интервале температур, в пределах которых действуют интерполяционные уравнения (интервалы указаны в справочнике), значит экстремум на кривой ΔН = f (T) существует. Для уточнения, какой именно экстремум (максимум или минимум) следует взять вторую производную и определить ее знак:
![]()
Если
![]() > 0, то имеет место минимум, если
> 0, то имеет место минимум, если![]() < 0, то максимум.
< 0, то максимум.
Если же Т < 0 или лежит вне интервала температур, значит экстремум отсутствует и в исследовании функции переходим к пункту 2.
2. Для определения возрастающей или убывающей функции следует определить знак первой производной:
![]()
В это уравнение
подставляется любая температура, взятая
внутри интервала, и рассчитывается
![]() :
если
:
если![]() > 0, то ΔН - возрастающая функция; если
> 0, то ΔН - возрастающая функция; если![]() < 0, то убывающая функция.
< 0, то убывающая функция.
Для уточнения хода кривой определяют вторую производную и ее знак:
![]() > 0, то кривая
вогнутая, при
> 0, то кривая
вогнутая, при
![]() <0 - выпуклая.
<0 - выпуклая.

